“化學反應原理”相關模型在解題中的應用
李開標
(福建省上杭縣第一中學 364200)
一、原電池模型在解題中的應用
構建原電池模型應明確原電池內外電路的電子移動方向,能夠運用所學的氧化還原反應判斷正負極的反應方程式.另外,為使學生能夠在解題中靈活應用該模型,可圍繞原電池模型設計如下習題,要求學生思考解答.
例1 使用銅片和銀片設計成如圖1所示的原電池,則有關該電池的判斷正確的是( ).
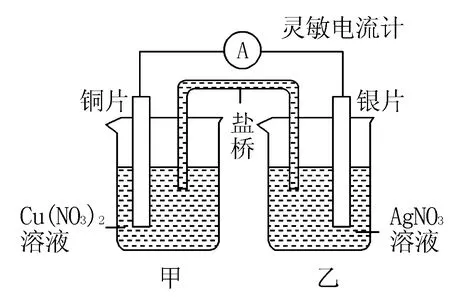
圖1
A.電子通過鹽橋從乙池流向甲池


D.將銅片浸入硝酸銀溶液中發生的化學反應與該原電池總反應相同

二、電解池模型在解題中的應用
應用電解池模型時應鼓勵學生采用對比方法分析電解池和原電池之間的區別與聯系,以更好的加深其印象,避免將兩種模型搞混淆.同時,為使學生更好的把握電解池模型本質,掌握解答相關問題的思路,課堂上可與學生一起分析相關的例題,如下題.
例2為減少二氧化碳的排放,我國科學家設計熔鹽電解池用于捕獲二氧化碳,如圖2所示,則以下說法不正確的是( ).
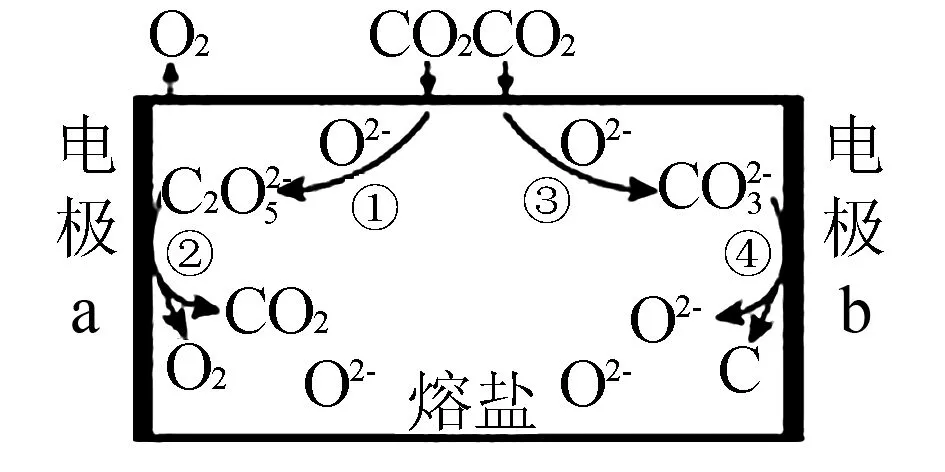
圖2
A.CO2過量排放是導致溫室效應的原因之一
D.CO2最終轉化為C和O2

三、化學平衡模型在解題中的應用
化學平衡模型是高中化學的重點、難點.該模型不僅涉及較多的概念,而且知識較為抽象,對學生的理解能力要求較高.教學中應結合具體的化學反應為學生展示改變濃度、壓強、溫度、催化劑等條件給化學平衡帶來的影響,使其能夠靈活運用勒夏特列原理分析化學平衡問題.同時,為使學生更好地把握化學平衡模型本質,可設計如下課堂訓練習題.

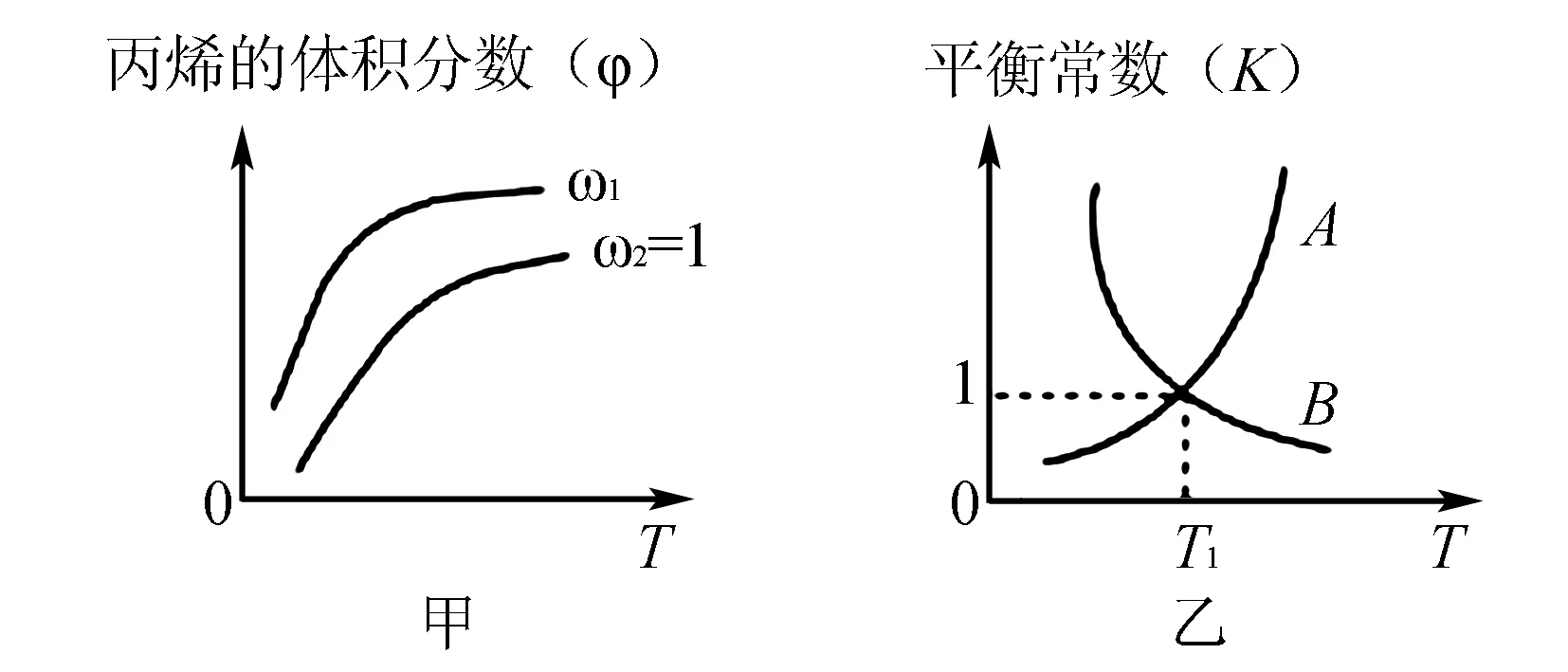
圖3
A.圖中ω1≥1
B.圖3乙中,線A表示正反應的平衡常數
C.在恒容容器中進行,壓強不變時反應達到平衡狀態
D.當溫度為T1,ω=2時,Cl2的轉化率為33.3%
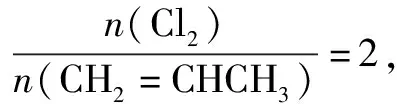
四、鹽類的水解模型在解題中的應用
鹽類的水解模型包括鹽類水解的規律、影響鹽類水解的因素等.為提高學生運用鹽類的水解分析問題的能力,應結合教學經驗,為學生布置相關的作業,更好的鞏固學生所學.如在布置作業中可要求學生作答以下習題.
例4室溫時,向20mL0.1mol/L的兩種酸HA、HB中分別滴加0.1mol/L的NaOH溶液,其pH變化分別對應圖4中的Ⅰ、Ⅱ,以下說法不正確的是( ).
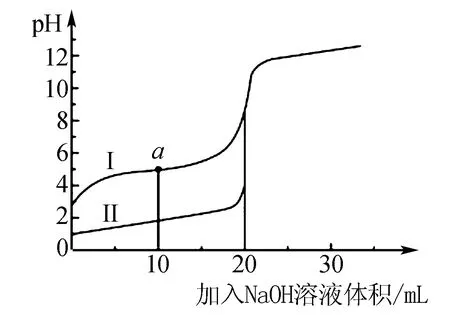
圖4
A.向NaA溶液中滴加HB可產生HA
B.滴加NaOH溶液至pH=7,兩種溶液中c(A-)=c(B-)
C.a點,溶液中微粒濃度:c(A-)>c(Na+)
D.滴加20mL NaOH溶液時Ⅰ中H2O的電離程度大于Ⅱ中
該題目結合圖像能很好的考查學生對鹽類水解模型的理解.A項,由圖可知HB溶液的pH較HA的小,表明HB的酸性強于HA,由強酸制弱酸原理可知,正確;B項,因HA和HB的酸性不同,消耗NaOH溶液的體積不同,則溶液中的c(Na+)不同,兩溶液中c(A-)一定不等于c(B-),錯誤;C項,a點為等濃度的HA和NaA混合液,溶液呈酸性,則HA的電離大于NaA的水解,溶液中微粒濃度c(A-)>c(Na+),正確.D項,當滴加NaOH溶液20mL時,等濃度的HB和HA剛好完全反應,但HB的酸性強于HA,則NaA水解大于NaB,Ⅰ中H2O的電離程度大于Ⅱ中,正確.

