電荷守恒在高中化學解題中的有效應用
黎婷婷
(廣西岑溪市第三中學 543200)
眾所周知,高中化學習題類型較多.部分習題只有掌握一定的解題技巧,才能進行高效的解答.電荷守恒是一種應用非常廣泛的重要解題方法,用于解題中可獲得的事半功倍的效果.為使學生更好地掌握這一重要的解題方法,更好地用于解題中,應積極采取措施做好該種方法的應用講解.
一、在分析化合價中的應用
電荷守恒不僅能夠用于配平化學方程式,而且還可計算未知元素的化合價.教學中為使學生學會運用電荷守恒解答相關習題,應注重優選經典例題,在課堂上展示給學生,先要求學生根據自己的理解進行解答,而后與學生一起分析解題過程,使學生對照自身的解題過程,找到解題的不足,把握電荷守恒應用的關鍵.
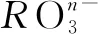
A.+5、5 B.+5、7 C. +4、6 D.+4、7
解答該題需要認真觀察離子方程式,運用電荷守恒進行分析,即,-n+6×(-1)+6×1=-1,解得n=1,則R的化合價為+5價.需要注意的是顯+5價時R元素并不穩定,顯-1價時R的最外層電子數達到穩定結構,因此,R原子的最外層的電子數為7.綜上可知,正確選項為B.
二、在求解物質質量中的應用
電荷守恒可用于間接的求解物質的質量.教學中為幫助學生更好地找到解答相關習題的思路,一方面,為學生認真講解物質的質量與電荷守恒之間的內在聯系,結合具體的化學反應,幫助其構建兩者之間的關系,在學生頭腦中留下深刻的印象,給其解答相關問題帶來良好啟發.另一方面,為學生講解代表性較強的習題,尤其詳細的板書解題過程,要求學生認真聽講,仔細揣摩,真正的消化吸收.
例2使用稀鹽酸溶解鋁與過氧化鈉的固體混合物.待固體全部溶解后測得溶液中c(Al3+)∶c(H+)∶c(Cl-)=1∶2∶8,則原固體混合物中m(Al)∶m(O)=( ).
A.9∶8 B.9∶16 C.9∶32 D.3∶4
根據已知條件可以判斷出稀鹽酸的量過量,溶液中的溶質為HCl、AlCl3、NaCl.由電荷守恒可得關系式:3n(Al3+)+n(Na+)+n(H+)=n(Cl-).由已知條件可設Al3+、H+、Cl-的物質的量分別為1mol、2mol、8mol,不難算出Na+的物質的量為8mol-1mol×3-2mol=3mol.則由鈉元素守恒可知Na2O2=1.5mol,因此,Al和O元素的質量之比為1mol×27g/mol∶1.5 mol×2×16g/mol=9∶16,正確選項為B.
三、在比較離子濃度大小中的應用
比較離子濃度大小是高中化學學習的重點,是高考必考知識點.為使學生能夠正確運用電荷守恒解答比較離子濃度大小習題,既要注重相關例題的講解,又要注重篩選經典習題,組織學生開展針對性訓練活動,使其能夠靈活運用電荷守恒構建物質電離、水解等式關系,尤其能夠配合使用物料守恒、質子守恒,正確的分析出問題答案.
例3在25℃條件下,向10mL濃度均為0.1mol/L的NH3·H2O和NaOH溶液中添加0.1mol/L的鹽酸,則下列關系式正確的是( ).
A.未加鹽酸時:
c(OH-)>c(Na+)=c(NH3·H2O)
B.加入10mL鹽酸時:
C.加入鹽酸至溶液pH=7時:
c(Cl-)=c(Na+)
D.加入20mL鹽酸時:
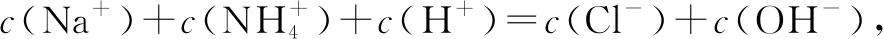
四、在電化學解題中的應用
電化學相關習題對學生分析問題的能力要求較高,既要能夠正確判斷物質先后放電關系,又要能夠靈活運用電荷守恒找到物質放電過程中轉移的電子數目,進而順利地求解出其它參數,因此在學生學習完電化學知識后,應及時為學生講解相關習題,深化其對電化學知識理解的同時,更好地掌握相關解題思路,不斷提高相關習題的解題能力與解題水平.
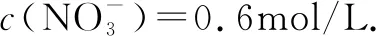
A.原混合溶液中c(K+)為0.2mol/L
B.上述電解過程共轉移0.2mol電子
C.電解得到Cu的物質的量為0.05mol
D.電解后溶液中c(H+)為0.2mol/L

電荷守恒是高中化學的重要知識點.為使學生能夠靈活應用于解題中,應結合自身教學經驗,總結能夠運用電荷守恒解題的習題類型,并針對每一種類型選擇代表性的習題,為學生進行深入的講解,使學生吃透電荷守恒的本質,掌握不同題型的解題思路與解題方法,為學生解題能力以及化學成績的提高奠定堅實基礎.

