新疆傳統(tǒng)乳制品中產(chǎn)蛋白酶乳酸菌的篩選及產(chǎn)酶條件優(yōu)化
張 偉,金庭飛,黎 旭 *,張凱莉
(1.廣東燕塘乳業(yè)股份有限公司,廣東 廣州 511356;2.廣東益可維生物技術(shù)有限公司,廣東 廣州 510520;3.石河子大學(xué) 食品學(xué)院,新疆 石河子 832000)
乳酸菌(lactic acid bacteria)是一類(lèi)可以發(fā)酵碳水化合物產(chǎn)生大量乳酸的無(wú)芽孢、革蘭氏陽(yáng)性菌的統(tǒng)稱(chēng)[1]。乳酸菌廣泛存在于人體腸道中,并對(duì)人體具有重要的益生功能[2-3],包括維持腸道粘膜的屏障功能,調(diào)節(jié)免疫力,改善腸道炎癥性疾病等。另外,乳酸菌被廣泛應(yīng)用于酸奶、奶酪、馬奶酒[4]、果蔬汁及谷物發(fā)酵中[5]。乳酸菌含有豐富的蛋白水解酶系[6],是重要的蛋白酶生產(chǎn)來(lái)源之一,通過(guò)發(fā)酵所產(chǎn)生的蛋白酶可在食品加工中將蛋白質(zhì)分解為功能多肽及游離氨基酸,起到提高食物消化效率、產(chǎn)生食品獨(dú)特風(fēng)味、生成功能性成分并進(jìn)一步增加發(fā)酵底物附加值等作用[7]。另外,高產(chǎn)蛋白酶乳酸菌能夠應(yīng)用于皮革加工[8]、絲綢加工[9]、食品[10]、釀造[11]、醫(yī)藥[12]等方面。
產(chǎn)蛋白酶乳酸菌的篩選在國(guó)內(nèi)外仍然有很高的研究?jī)r(jià)值;彈性蛋白酶可由動(dòng)物胰臟提取或由微生物發(fā)酵制得,其可用于生產(chǎn)治療高血脂癥、防止動(dòng)脈粥樣硬化的藥物[13],另外,彈性蛋白酶在肉的嫩化和動(dòng)物蛋白質(zhì)的水解等方面也有應(yīng)用[14]。張?zhí)m等[15]采用酪蛋白平板法從雞糞中篩選出一株短小芽孢桿菌,并對(duì)該菌所產(chǎn)蛋白酶酶學(xué)特性進(jìn)行分析。于豪杰[16]采用發(fā)酵的方法對(duì)豆粕中大分子蛋白進(jìn)行酶解處理,篩選出的產(chǎn)蛋白酶乳酸菌菌種有發(fā)酵乳桿菌、植物乳桿菌等。國(guó)外有研究表明[17],短乳桿菌產(chǎn)生的蛋白酶可以增強(qiáng)非洲山藥豆的營(yíng)養(yǎng)價(jià)值,并證明對(duì)白化病大鼠的生長(zhǎng)和血液指標(biāo)有改善作用。微生物生長(zhǎng)中所需能量和構(gòu)建細(xì)胞骨架所需原料主要由培養(yǎng)基中碳源提供,碳源不同,蛋白酶的活力也有所不同[18]。氮源主要為菌體的細(xì)胞結(jié)構(gòu)以及菌體內(nèi)的含氮代謝物(如核酸、氨基酸、蛋白質(zhì)等)提供合成原料,氮源種類(lèi)可以影響蛋白水解后的氨基酸回收率[19]。金屬離子在蛋白酶生物催化過(guò)程中,可作為酶的輔因子或輔基產(chǎn)生作用,可以控制蛋白酶水解反應(yīng),有研究表明,不同金屬離子對(duì)胰蛋白酶活性有影響[20]。磷酸鹽能調(diào)節(jié)培養(yǎng)基的pH,培養(yǎng)環(huán)境的氫離子濃度可以影響蛋白酶的活性[21]。于宏偉等[22]篩選出了一株產(chǎn)中性蛋白酶的菌株,并對(duì)其產(chǎn)酶條件和酶學(xué)性質(zhì)進(jìn)行了初步研究,發(fā)現(xiàn)牛肉膏作為碳源時(shí)效果最好,其次是玉米粉和小麥淀粉,氮源的效果為玉米漿>豆餅粉>氯化銨>硝酸鉀,金屬離子中對(duì)酶有顯著激活作用的為鐵離子。方芳等[23]對(duì)產(chǎn)耐熱蛋白酶乳酸菌的篩選和產(chǎn)酶特性進(jìn)行了研究,發(fā)現(xiàn)乳酸菌在以葡萄糖為碳源,蛋白胨+牛肉膏+酵母粉為復(fù)合氮源,碳氮比為0.8,pH值為7.0的培養(yǎng)基下,篩選的乳酸菌具有最大產(chǎn)酶量,產(chǎn)酶量為13.13 U/mL,并指出K2HPO4、MgSO4有促進(jìn)蛋白酶含量增加作用。
本研究采用福林-酚法與酪蛋白透明圈法對(duì)新疆傳統(tǒng)乳制品中的乳酸菌進(jìn)行分離篩選,結(jié)合菌株形態(tài)學(xué)觀察及16S rDNA序列對(duì)菌株進(jìn)行鑒定,并以蛋白酶活作為評(píng)價(jià)指標(biāo),以碳源、氮源、金屬鹽、磷酸鹽的種類(lèi)和添加量作為影響因素,通過(guò)單因素試驗(yàn)和正交試驗(yàn)優(yōu)化高產(chǎn)蛋白酶乳酸菌的產(chǎn)酶條件。可為高產(chǎn)蛋白酶乳酸菌的應(yīng)用提供參考與支持。
1 材料與方法
1.1 材料與試劑
1.1.1 材料
新疆少數(shù)民族傳統(tǒng)乳制品(奶疙瘩、酸牛奶、非蒸餾型馬奶酒)樣品:奶疙瘩采自新疆伊犁地區(qū);酸牛奶采自新疆石河子市南山牧場(chǎng);馬奶酒采自新疆塔城地區(qū)額敏縣。
1.1.2 化學(xué)試劑
F8060福林酚(分析純):北京索萊寶科技有限公司;三氯乙酸(分析純):美國(guó)Sigma-Aldrich公司;酪蛋白標(biāo)準(zhǔn)品(純度>98%):德國(guó)默克公司;DP302脫氧核糖核酸(deoxyribonucleic acid,DNA)提取試劑盒:天根生化科技(北京)有限公司。
1.1.3 培養(yǎng)基
菌種篩選固體培養(yǎng)基:南京信帆生物技術(shù)有限公司;MRS培養(yǎng)基:青島海博生物技術(shù)有限公司。
1.2 儀器與設(shè)備
5810R離心機(jī):德國(guó)艾本德公司;Alpha1500紫外分光光度計(jì):上海譜元儀器有限公司;ZXSD-1160全自動(dòng)生化培養(yǎng)箱:上海智誠(chéng)儀器有限公司;BX43顯微鏡:日本奧林巴斯公司;T-100型聚合酶鏈?zhǔn)椒磻?yīng)(polymerase chain reaction,PCR)儀、Mini-SubCell核酸電泳儀:美國(guó)Bio Rad公司。
1.3 方法
1.3.1 乳酸菌的富集與分離
取約1 g奶疙瘩中部樣品于生理鹽水中37 ℃浸泡軟化,移液器吹打均勻并進(jìn)行100倍稀釋?zhuān)捎脛澗€(xiàn)法蘸取稀釋樣品液進(jìn)行劃線(xiàn)分離培養(yǎng);酸牛奶、馬奶酒樣本旋渦混勻后各取1 mL進(jìn)行梯度稀釋?zhuān)『线m梯度,采用傾注法進(jìn)行培養(yǎng),獲得單菌落。
培養(yǎng)完成后觀察菌落形態(tài),挑取形態(tài)學(xué)特征不同的單菌落進(jìn)行多次培養(yǎng)劃線(xiàn),直至鏡檢視野下菌株形態(tài)一致,從而得到純化的菌株。將純化后的乳酸菌接種至液體MRS培養(yǎng)基中在37℃培養(yǎng)18h至對(duì)數(shù)生長(zhǎng)期后,進(jìn)行甘油管保藏。
1.3.2 產(chǎn)蛋白酶乳酸菌的復(fù)篩
取保藏的菌株甘油管,按2%接種量接種于MRS液體培養(yǎng)基,培養(yǎng)16~18 h,3 500×g、4 ℃離心10 min,得到菌泥后用生理鹽水再次重懸獲得菌懸液,將菌懸液按2%接種于50 mL發(fā)酵培養(yǎng)基,35 ℃誘導(dǎo)培養(yǎng)48 h后,取500 μL菌液(108CFU/mL)離心(3 500×g、4 ℃)10 min,取離心后的10 μL上清液加入牛津杯中,在脫脂牛乳瓊脂培養(yǎng)基35 ℃培養(yǎng)24 h,當(dāng)培養(yǎng)基中的酪蛋白被微生物分泌的蛋白酶分解后,在牛津杯的周?chē)纬赏该魅Γ暨xHE值較大的菌株進(jìn)行后續(xù)試驗(yàn),測(cè)定透明圈的HE值,其計(jì)算公式如下:

式中:ΦA(chǔ)為透明圈直徑,mm;ΦB為菌落直徑,mm。
1.3.3 目標(biāo)菌株的篩選
采用福林-酚法測(cè)定蛋白酶活性。研究表明[24-25]透明圈直徑大小以及透明圈與菌落直徑的比值與蛋白酶活力高低無(wú)顯著正相關(guān),蛋白酶水解酪蛋白,其產(chǎn)物酪氨酸能在堿性條件下使福林-酚試劑還原,生成組藍(lán)與鎢藍(lán),以比色法在波長(zhǎng)680 nm處測(cè)定OD680nm值,每個(gè)樣品做3次平行。乳酸菌于35 ℃的溫度下在液體發(fā)酵培養(yǎng)基上培養(yǎng)48 h后,將1 mL發(fā)酵液離心,所收集的上清液即為粗酶液,測(cè)定蛋白酶活性。
蛋白酶活力定義:1 g 酶粉或1 mL酶液,在40 ℃、pH=7.2條件下,每分鐘水解酪蛋白產(chǎn)生1 μg酪氨酸所需酶量為1個(gè)酶活力單位(U/mL)。
1.3.4 菌株的形態(tài)學(xué)觀察及分子生物學(xué)鑒定
將分離純化獲得的菌接種在MRS平板上充分培養(yǎng),待菌落形態(tài)成型時(shí),觀察其單個(gè)菌落的形狀、顏色、光滑度、透明度及邊緣整齊度。從MRS培養(yǎng)基挑選出的過(guò)氧化氫陰性菌經(jīng)革蘭染色后,若細(xì)胞在顯微鏡下呈藍(lán)紫色,則為乳酸菌,若呈紅色,則將其排除。
乳酸菌DNA的提取:本試驗(yàn)采用試劑盒法對(duì)乳酸菌菌株中的DNA進(jìn)行了提取,具體提取步驟按照生產(chǎn)商說(shuō)明書(shū)進(jìn)行。
PCR擴(kuò)增:乳酸菌使用引物27F和1492R[26],PCR擴(kuò)增體系均為50μL,先加入引物及菌株DNA各2.0μL,然后加入25μL的2×TaqMaster Mix(Dye Plus)和19 μL的雙蒸水(ddH2O)搖勻后進(jìn)行PCR擴(kuò)增,擴(kuò)增時(shí)步驟參考TARTORY等[27]的方法。
PCR產(chǎn)物檢測(cè):取5 μL的PCR擴(kuò)增產(chǎn)物加入到1%的瓊脂糖凝膠[28](含0.01%的goldview Ⅱ染料)孔中,將電泳儀的電壓和電流分別設(shè)置為100 V和90 mA,在1×TAE 電泳緩沖液中電泳40 min,待條帶跑至距膠孔另一端1/3處,即可將膠板取出用凝膠成像儀進(jìn)行觀察。
菌株序列比對(duì)及系統(tǒng)發(fā)育樹(shù)的構(gòu)建:在測(cè)序公司完成測(cè)序后,將所得的16Sr DNA序列提交到美國(guó)國(guó)家生物技術(shù)信息中心(national center of biotechnology information,NCBI)Gen Bank數(shù)據(jù)庫(kù)中與標(biāo)準(zhǔn)菌序列進(jìn)行基本局部比對(duì)搜索工具(basic local alignment search tool,BLAST)比對(duì),并構(gòu)建系統(tǒng)發(fā)育樹(shù)[29]。
1.3.5 乳酸菌產(chǎn)酶條件優(yōu)化
(1)單因素試驗(yàn)
碳源及最佳碳源添加量對(duì)菌株產(chǎn)蛋白酶活力影響:在發(fā)酵培養(yǎng)基中添加1%[30]的碳源(葡萄糖、蔗糖、D-果糖、低聚半乳糖、可溶性淀粉),最佳碳源添加量(1.0%、2.0%、4.0%),將篩選出來(lái)的目標(biāo)菌株在35 ℃培養(yǎng)24 h,測(cè)定蛋白酶活力。
氮源及最佳氮源添加量對(duì)菌株產(chǎn)蛋白酶活力影響:在發(fā)酵培養(yǎng)基中添加1%的氮源(蛋白胨、牛肉膏、硝酸鉀、硫酸銨、檸檬酸三銨),最佳氮源添加量(1.0%、2.0%、4.0%),測(cè)定蛋白酶活力。
金屬鹽及最佳金屬鹽添加量對(duì)菌株產(chǎn)蛋白酶活力影響:在發(fā)酵培養(yǎng)基中添加0.01%的金屬鹽(NaCl、CuSO4·7H2O、BaCl2、MgSO4·7H2O、MnSO4),最佳金屬鹽添加量(0.01%、0.02%、0.04%),測(cè)定蛋白酶活力。
磷酸鹽及最佳磷酸鹽添加量對(duì)菌株產(chǎn)蛋白酶活力影響:在發(fā)酵培養(yǎng)基中添加0.5%的磷酸鹽(K2HPO4、KH2PO4、Na2HPO4、NaH2PO4),最佳磷酸鹽添加量(0.5%、0.7%、0.9%),同上條件培養(yǎng),測(cè)定蛋白酶活力。
(2)正交試驗(yàn)
在單因素試驗(yàn)基礎(chǔ)上,以蛋白酶酶活為評(píng)價(jià)指標(biāo),分別選取葡萄糖添加量(A)、牛肉膏添加量(B)、MgSO4·7H2O添加量(C)、K2HPO4添加量(D)添加量為影響因素,采用L9(34)正交試驗(yàn)設(shè)計(jì),優(yōu)化菌株產(chǎn)酶條件。正交試驗(yàn)因素與水平見(jiàn)表1。
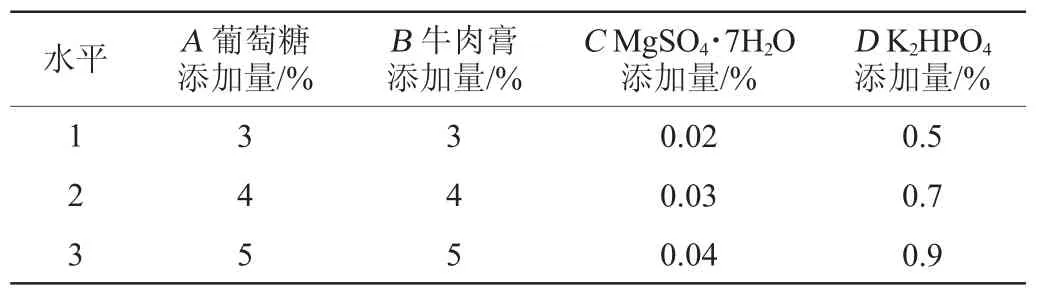
表1 產(chǎn)蛋白酶條件優(yōu)化正交試驗(yàn)因素與水平Table 1 Factors and levels of orthogonal experiments for proteaseproducing conditions optimization
1.3.6 數(shù)據(jù)處理
使用Origin 2017作圖,利用SPSS 25.0進(jìn)行差異性分析;實(shí)驗(yàn)數(shù)據(jù)均進(jìn)行3次平行,以平均值±標(biāo)準(zhǔn)偏差表示。數(shù)據(jù)分析過(guò)程中,當(dāng)P<0.05,表示具有顯著性差異。
2 結(jié)果與分析
2.1 產(chǎn)蛋白酶乳酸菌的分離與初篩
以菌落透明圈直徑作為依據(jù)對(duì)菌株進(jìn)行初篩,篩選菌株的菌落形態(tài)及透明圈直徑見(jiàn)表2。由表2可知,16株菌有10株菌產(chǎn)蛋白酶。
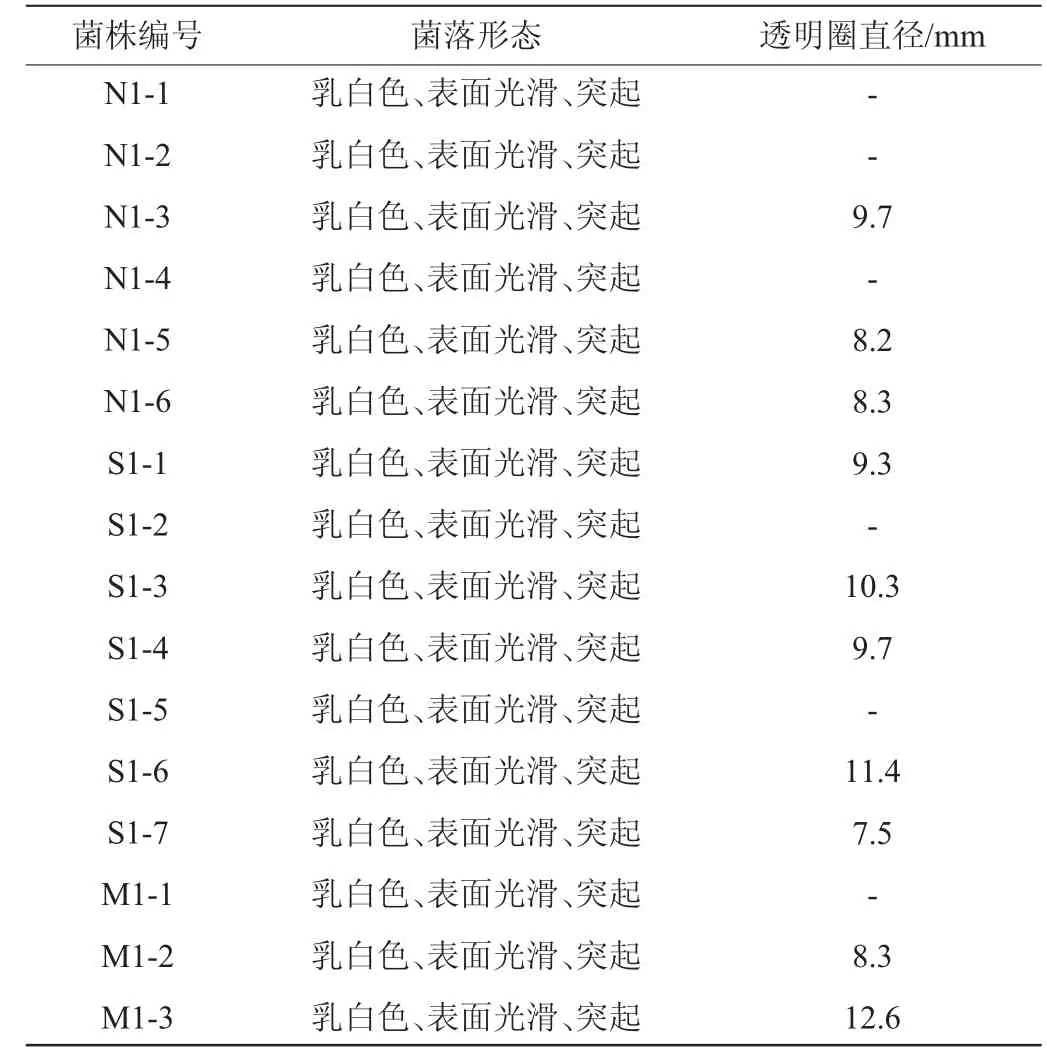
表2 產(chǎn)蛋白酶菌株的菌落形態(tài)及透明水解圈直徑Table 2 Colony morphology and hydrolysis circle of protease-producing strains
將初篩的16株乳酸菌菌株接種于脫脂牛乳培養(yǎng)基后,測(cè)定其透明圈直徑。將透明圈直徑與菌落直徑之比較大的菌株定義為目標(biāo)菌株,最終得到4株菌株,編號(hào)為A1~A4,4株菌的脫脂牛乳平板培養(yǎng)基透明圈見(jiàn)圖1。測(cè)量各菌株的HE值大小,依次排序?yàn)锳2>A4>A3>A1。

圖1 脫脂牛乳平板培養(yǎng)基上篩選菌株的透明圈Fig.1 Transparent circle of screened strains on the skimmed milk plate medium
2.2 產(chǎn)蛋白酶乳酸菌的復(fù)篩
初篩獲得的菌株產(chǎn)蛋白酶酶活力值結(jié)果見(jiàn)表3。不同菌株所產(chǎn)蛋白酶活性存在顯著差異(P<0.05),其中菌株A2的蛋白酶活力最高,為14.85 U/mL。因此,挑選菌株A2進(jìn)行后續(xù)試驗(yàn)。
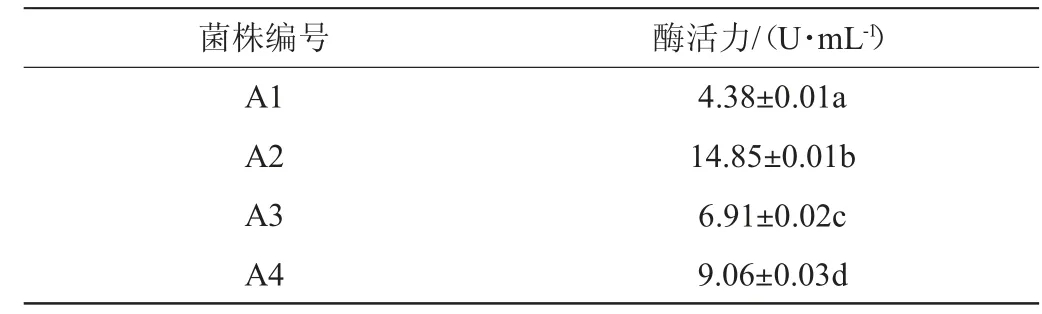
表3 篩選菌株產(chǎn)蛋白酶酶活測(cè)定結(jié)果Table 3 Determination results of enzyme activities of screened strains
2.3 產(chǎn)蛋白酶乳酸菌的菌種鑒定
2.3.1 菌株形態(tài)學(xué)觀察結(jié)果
對(duì)初步篩選得到的4株菌進(jìn)行劃線(xiàn)培養(yǎng),4株菌的菌落與菌體形態(tài)見(jiàn)圖2。
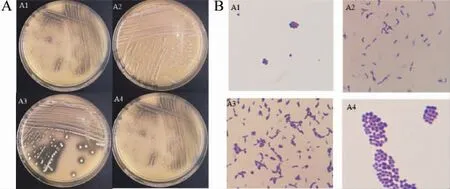
圖2 篩選菌株的菌落(A)與菌體形態(tài)(B)Fig.2 Colony (A) and cell (B) morphologies of screened strains
由圖2A可知,菌落表面光滑,顏色為乳白色,表面光滑、突起。由圖2B可知,4株菌的革蘭氏染色均為陽(yáng)性,菌株A1、A4細(xì)胞形態(tài)為球菌,菌株A2、A3細(xì)胞形態(tài)為桿狀或短棒狀。
2.3.2 分子生物學(xué)鑒定
對(duì)篩選出來(lái)的4株菌使用MEGA7軟件構(gòu)建系統(tǒng)發(fā)育樹(shù),結(jié)果見(jiàn)圖3。

圖3 基于16S rDNA序列篩選菌株的系統(tǒng)發(fā)育樹(shù)Fig.3 Phylogenetic tree of screened strains based on 16S rDNA sequence
由圖3可知,菌株A2與發(fā)酵乳桿菌(Lactobacillus fermentum),菌株A1、A3、A4分別與戊糖片球菌(Peciococcus pentosaceus)、短乳桿菌(Lactobacillxus brevis)、乳酸明串珠菌(Leuconostoc lactis)的同源性為100%。因此,菌株A1、A2、A3、A4分別被鑒定為戊糖片球菌(Peciococcus pentosaceus)、發(fā)酵乳桿菌(Lactobacillus fermentum)、短乳桿菌(Lactobacillxus brevis)、乳酸明串珠菌(Leuconostoc lactis)。
2.4 菌株A2產(chǎn)酶條件優(yōu)化單因素試驗(yàn)
2.4.1 不同碳源對(duì)菌株A2產(chǎn)蛋白酶的影響
考察不同種類(lèi)碳源在不同添加量下對(duì)A2菌株發(fā)酵產(chǎn)蛋白酶活力的影響,結(jié)果如表4所示,3個(gè)不同添加量下,葡萄糖均為最佳碳源,蛋白酶活力隨添加量的增加而增加;以4%葡萄糖作為碳源時(shí),蛋白酶活力最高,酶活力值達(dá)到16.25 U/mL。而乳酸菌對(duì)低聚半乳糖的利用率最低,蛋白酶活僅為6.17 U/mL。D-果糖和可溶性淀粉對(duì)蛋白酶活的影響較為相近。因此,選擇最佳碳源添加量為4%葡萄糖。
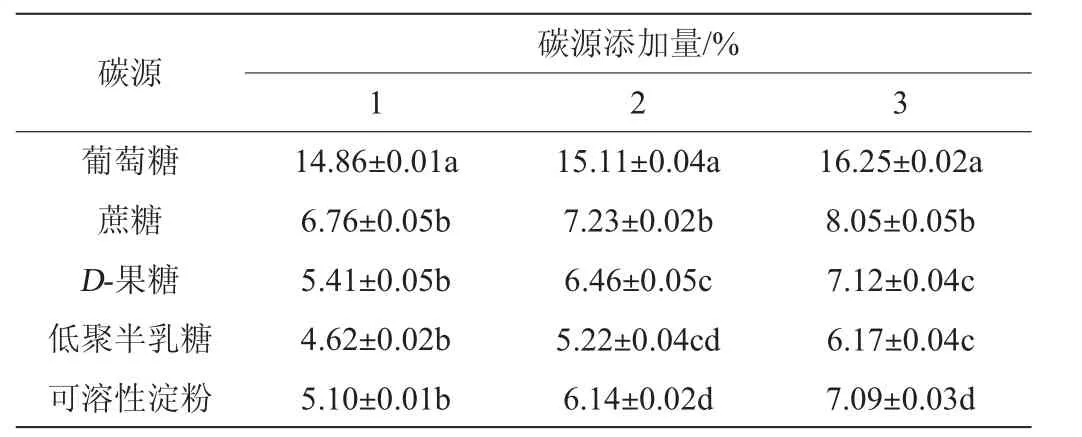
表4 不同碳源對(duì)乳酸菌A2產(chǎn)蛋白酶活力的影響Table 4 Effect of different carbon sources on protease activity produced by strain A2 U/mL
2.4.2 氮源對(duì)乳酸菌A2產(chǎn)蛋白酶的影響
以蔗糖作為碳源,測(cè)定菌株A2在1%氮源(牛肉膏、蛋白胨、檸檬酸三銨、硝酸鉀、硫酸銨)下發(fā)酵產(chǎn)蛋白酶活力,結(jié)果見(jiàn)表5。由表5可知,牛肉膏在4%添加量條件下,菌株A2產(chǎn)生的蛋白酶活力最高,可達(dá)到16.98 U/mL,并且隨著牛肉膏添加量的上升,酶活力不再上升。因此,最佳碳源添加量為4%牛肉膏。
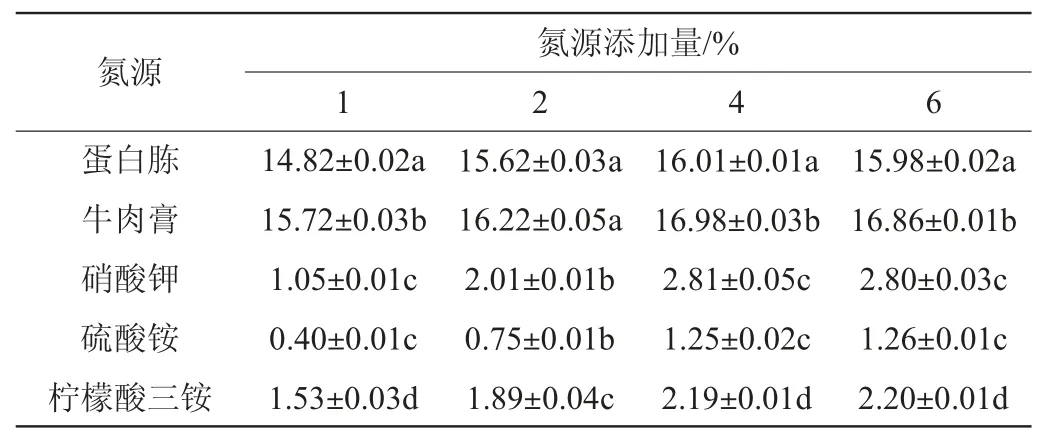
表5 不同氮源對(duì)菌株A2產(chǎn)蛋白酶活力的影響Table 5 Effect of different nitrogen sources on protease activity produced by strain A2 U/mL
2.4.3 金屬鹽對(duì)乳酸菌A2產(chǎn)蛋白酶的影響
以蔗糖為碳源,以蛋白胨為氮源,加入含量為0.01%的5種金屬鹽,考察對(duì)蛋白酶活力的影響,結(jié)果見(jiàn)表6。由表6可知,金屬鹽MgSO4·7H2O添加量為0.02%時(shí),蛋白酶活力最大,為14.98 U/mL。且蛋白酶活力依次為MgSO4·7H2O>BaCl2>CuSO4·7H2O>MnSO4>NaCl,顯示出鎂離子在菌株A2代謝蛋白酶過(guò)程中起到關(guān)鍵作用。因此,最佳金屬鹽MgSO4·7H2O添加量為0.02%。
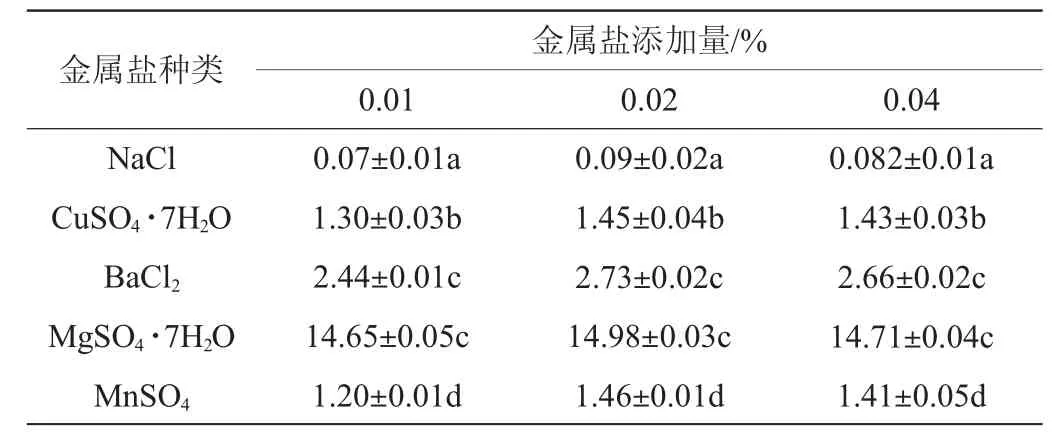
表6 不同金屬鹽對(duì)乳酸菌A2產(chǎn)蛋白酶活力的影響Table 6 Effect of different metal salts on protease activity produced by strain A2 U/mL
2.4.4 磷酸鹽對(duì)乳酸菌A2產(chǎn)蛋白酶的影響
以蔗糖為碳源,以蛋白胨為氮源,MgSO4·7H2O為金屬鹽,結(jié)果見(jiàn)表7。由表7可知,添加K2HPO4時(shí)菌株A2產(chǎn)蛋白酶活力最大,不同添加量比較下,K2HPO4添加量為0.7%時(shí)所有組的蛋白酶活力最高,磷酸鹽排序?yàn)椋篕2HPO4>Na2HPO4>KH2PO4>NaH2PO4。因此,最佳磷酸鹽K2HPO4添加量為0.7%。
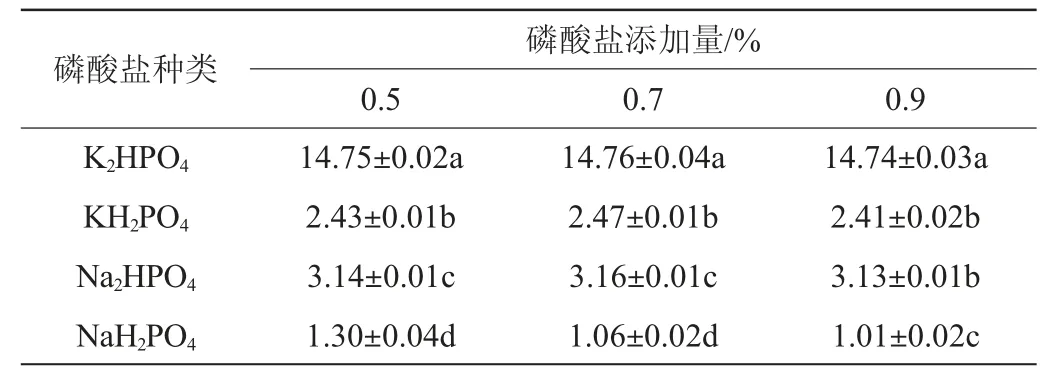
表7 不同磷酸鹽對(duì)產(chǎn)蛋白酶活力的影響Table 7 Effect of different phosphates on protease activity produced by strain A2 U/mL
2.5 產(chǎn)酶條件優(yōu)化正交試驗(yàn)
在單因素試驗(yàn)基礎(chǔ)上,以蛋白酶酶活為評(píng)價(jià)指標(biāo),分別選取葡萄糖添加量(A)、牛肉膏添加量(B)、MgSO4·7H2O添加量(C)、K2HPO4添加量(D)為考察因素,采用L9(34)正交試驗(yàn)設(shè)計(jì),優(yōu)化菌株A2產(chǎn)酶條件。正交試驗(yàn)結(jié)果與分析見(jiàn)表8,方差分析結(jié)果見(jiàn)表9。
由表8可知,各因素對(duì)產(chǎn)蛋白酶影響順序?yàn)锽>A>D>C,即牛肉膏添加量>葡萄糖添加量>K2HPO4添加量>MgSO4·7H2O添加量,最優(yōu)產(chǎn)酶條件組合為A2B2C1D2,即葡萄糖添加量4%、牛肉膏添加量4%、MgSO4·7H2O添加量0.02%、K2HPO4添加量0.7%。在此優(yōu)化條件下進(jìn)行3次平行驗(yàn)證試驗(yàn),菌株A2產(chǎn)蛋白酶最高為65.92 U/mL。由表9可知,4種因素對(duì)蛋白酶活的影響均極顯著(P<0.01)。

表8 產(chǎn)酶條件優(yōu)化正交試驗(yàn)結(jié)果與分析Table 8 Results and analysis of orthogonal tests for enzymatic production conditions optimization
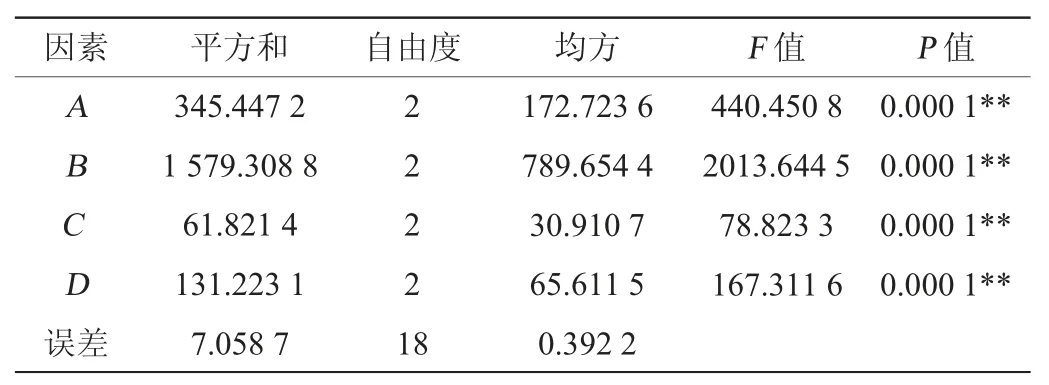
表9 正交試驗(yàn)結(jié)果方差分析Table 9 Variance analysis of orthogonal tests results
3 結(jié)論
本研究通過(guò)初篩與復(fù)篩,從傳統(tǒng)乳制品中篩選出產(chǎn)蛋白酶活力好的菌株4株,(編號(hào)為A1~A4),分別被鑒定為戊糖片球菌(Peciococcus pentosaceus)、發(fā)酵乳桿菌(Lactobacillus fermentum)、短乳桿菌(Lactobacillxus brevis)、乳酸明串珠菌(Leuconostoc lactis)。在以4.0%葡萄糖為碳源、4.0%牛肉膏為氮源、0.02%的鎂離子為金屬鹽、0.7%的K2HPO4為磷酸鹽的條件下,菌株A2產(chǎn)蛋白酶活最高為65.92 U/mL。

