產4-乙烯基愈創木酚細菌的篩選及酚酸脫羧酶基因的克隆與表達
鞏園園,毛 豪,晉湘宜,馮向東,陳茂彬,方尚玲*
(1.湖北工業大學 生物工程與食品學院 教育部發酵工程重點實驗室,湖北 武漢 430068;2.湖北稻花香酒業股份有限公司,湖北 宜昌 443000)
白酒作為世界六大蒸餾酒之一,其風味物質的種類與不同含量比對白酒的品質有著巨大的影響。與其他國家的蒸餾酒相比,中國白酒的呈香呈味物質量的含量與種類居于首位[1]。白酒作為一種新生代的養生保健食品,頻繁被媒體作為熱點關注。為了倡導科學養生,健康飲酒,各大酒廠開始挖掘白酒中的功能性風味物質來作為衡量保健效果好壞的指標[2]。
4-乙烯基愈創木酚(4-vinylguaiacol,4-VG)是一種丁香類香味的特殊揮發性成分,具有烘焙香、堅果香以及辛香,感官閾值低,為0.3 mg/L,其不僅是白酒中的主要香味成分之一,也是醫藥合成中間體,具有健康功能性[3-5]。研究表明,4-VG可以通過阻滯細胞周期和誘導細胞凋亡對癌細胞生長產生抑制作用[6],因此4-VG在食品中的含量及代謝途徑備受關注。現有研究報道,4-VG的生物合成法有微生物發酵法、植物細胞培養法和酶法[7]。相較于其他兩種,微生物發酵法以其避免使用重金屬,有機溶劑以及強酸和強堿,成本低、環保的優勢成為近年來生產4-VG的研究趨勢。產4-VG的微生物主要有細菌和真菌[8-9]。但是,真菌的代謝途徑比較復雜,且生長周期長,成本高,且細菌代謝合成4-VG是最經濟的一條途徑,因此篩選高產4-VG的細菌是當務之急[10-11]。
細菌產4-VG的主要途徑是以阿魏酸為底物,經酚酸脫羧酶將阿魏酸脫羧形成4-VG[12]。酚酸脫羧酶是細菌中產4-VG的關鍵酶,由于4-VG在工業中巨大的潛在商業價值,酚酸脫羧酶被廣泛關注,尋找適用于工業生產的酶資源已成為必然需求[13-14]。但是,由于酶易失活、酶活力受環境變化影響較大,尋找一種酶活較高的酚酸脫羧酶解決4-VG產率低的問題急需解決。
本研究采用傳統篩選方法對酒醅中產4-VG細菌篩選,利用形態學和分子生物學進行菌種鑒定,對產4-VG相關的酚酸脫羧酶基因進行克隆與表達,探究酚酸脫羧酶的表達水平,并采用微生物發酵法應用到白酒發酵過程,以期為實現提高白酒中4-VG含量提供一定的參考依據。
1 材料與方法
1.1 材料與試劑
1.1.1 樣品
發酵酒醅:湖北某酒廠。
1.1.2 試劑
大腸桿菌(Escherichia coli)感受態細胞DH5α、E.coliBL21(DE3):天根生化試劑有限公司;質粒pMD18-T和ExTaq聚合酶:日本Takara公司;質粒pET28a(+):德國Novagen公司;細菌脫氧核糖核酸(deoxyribonucleic acid,DNA)試劑盒、質粒提取試劑盒:美國Biomiga公司;限制性內切酶NcoI-HF(20 000 U/mL)、XhoI(20 000 U/mL)、T4 DNA連接酶(400 000 U/mL):美國New England Biolabs公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白濃度測定試劑盒、十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)試劑盒:上海碧云天生物技術有限公司;4-VG(色譜級):上海源葉生物技術有限公司;對香豆酸、咖啡酸、芥子酸、阿魏酸、異丙基β-D-半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)(均為分析純):上海阿拉丁生化科技股份有限公司。其他試劑均為國產分析純。
1.1.3 培養基
分離純化培養基[15]:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,瓊脂粉20 g,蒸餾水1 L。121 ℃高壓蒸汽滅菌20 min,使用前加入終質量濃度為25 μg/mL的制霉菌素。
種子培養基[15]:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,蒸餾水1 L。121 ℃高壓蒸汽滅菌20 min。
發酵培養基[16]:粗麩皮10 g,蒸餾水20 mL。121 ℃高壓蒸汽滅菌20 min。
LB液體培養基[17]:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,蒸餾水1 L。121 ℃高壓蒸汽滅菌20 min。
LB固體培養基:在LB液體培養基中加入瓊脂粉15 g。121 ℃高壓滅菌20 min。
1.2 儀器與設備
S1000梯度聚合酶鏈式反應(polymerase chain reaction,PCR)擴增儀:聯想生物技術有限公司;JY961N超聲波細胞粉碎機:寧波新芝生物科技有限公司;E6156 MiniProGel蛋白制膠與電泳系統:上海碧云天生物技術有限公司;Ulti-Mate 3000高效液相色譜(high performance liquid chromatography,HPLC)儀:賽默飛世爾科技(中國)有限公司;7890B-5977B氣相色譜-質譜聯用(gaschromatography-massspectrometer,GC-MS)儀:安捷倫科技(中國)有限公司。
1.3 方法
1.3.1 發酵酒醅中菌株的分離純化
采用無菌生理鹽水按10倍梯度稀釋酒醅,紗布過濾,取稀釋度為10-3~10-6的稀釋液100 μL均勻涂布于分離純化培養基中,37 ℃靜置培養24 h,挑取單菌落進行分離純化[18]。
1.3.2 發酵酒醅中產4-VG菌株的篩選
將分離純化的菌株接種于種子培養基中,37℃、180r/min條件下培養24 h,以10%(V/V)的接種量接入發酵培養基中,37 ℃、180 r/min條件下發酵7 d,每組做3組平行。取5 g(濕質量)發酵產物加入50 mL蒸餾水,搖勻30 min,1 000 r/min離心10 min。取10 mL上清液于頂空瓶中,加入20 μL乙酸正戊酯(17.104 g/L)作為內標,55 ℃條件下平衡15 min,55 ℃條件下吸附30 min,220 ℃條件下解吸5 min,采用GC-MS檢測4-VG含量[19]。
1.3.3 產4-乙烯基愈創木酚菌株的鑒定
形態學鑒定:將篩選得到的菌株接種于分離純化培養基,37 ℃靜置培養18 h,觀察菌落形態,挑取單菌落革蘭氏染色,采用油鏡觀察細胞形態[20]。
分子生物學鑒定:將篩選得到的菌株委托華大基因科技有限公司進行16S rRNA基因序列測序,將測序結果提交至美國國立生物技術信息中心(national center for biotechnology information,NCBI)的Genbank數據庫中進行基本局部比對搜索工具(basic local alignment search tool,BLAST)搜索,選取同源性較高的模式菌株的16S rRNA基因序列進行比對,采用MEGA7.0軟件中的鄰接(neighbor joining,NJ)法構建系統發育樹。
1.3.4 酚酸脫羧酶基因的TA克隆與異源表達
根據NCBI上的酚酸脫羧酶的基因序列設計該基因的特異性引物,上游引物為P(Bs)NcoI(5'-CATGCCATGGCCATGGAAAACTTTATCGGAAGCCACA-3'),下游引物為P(Bs)xhoI(5'-CCGCTCGAGTAATTTTCCCGCGCGAATAT CGTCT-3')。采用細菌DNA試劑盒提取篩選菌株的基因組DNA,以其為模板PCR擴增酚酸脫羧酶基因,PCR擴增體系(25 μL):雙蒸水(ddH2O)17.2 μL,10×ExTaqBuffer(Mg2+Plus)2.5 μL,脫氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)(10 mmol/L)2.0 μL,引物P(Bs)NcoI和P(Bs)xhoI(20 mmol/L)各1 μL,基因組DNA 1 μL,ExTaq(5 U/μL)0.3 μL。PCR擴增條件:94 ℃預變性1 min;94 ℃變性30 s,65 ℃退火30 s,72 ℃延伸1 min,30個循環;72 ℃再延伸10 min。將PCR擴增產物純化后與pMD18-T載體連接,轉染至感受態細胞E.coliDH5-α,然后涂布于LB平板(加1%的100 mg/mL氨芐抗生素),37 ℃條件培養16 h,挑取陽性菌株進行測序。提取克隆成功的菌株的質粒,采用核酸內切酶NcoI-HF、XhoI對該質粒及載體pET-28a分別進行雙酶切,酶切產物純化后進行連接,轉染至感受態細胞E.coliBL21,然后涂布于LB平板(加入1%的40 mg/mL硫酸卡那霉素),37 ℃條件培養16 h,挑取單菌落進行測序驗證,測序成功的菌株為重組工程菌。將重組工程菌接種于100 mLLB液體培養基(加入1%的40 mg/mL硫酸卡那霉素)中,37 ℃、180 r/min條件下擴大培養至OD600nm值為0.8時,添加100 μL IPTG(濃度為500 mmol/L),在20 ℃、180 r/min誘導表達16 h[21]。
1.3.5 4-乙烯基愈創木酚含量的測定
采用GC-MS檢測4-VG含量。
氣相色譜條件:DB-WAx色譜柱(30 m×0.25 mm×0.25 μm);進樣口溫度280 ℃;升溫程序為初始柱溫65 ℃,保持3min,以5℃/min升溫至150 ℃,保持2 min,再以10℃/min升溫至280 ℃,保持4 min;載氣為高純氦氣(He)(純度≥99.999%),流速0.8 mL/min;進樣方式為分流進樣,分流比20∶1;進樣量為1 μL。
質譜條件:電離方式為電子電離(electron ionization,EI)源;全掃描模式,質量范圍45~400 amu;電子能量70 eV;離子源溫度230 ℃;四級桿溫度150 ℃;溶劑延遲時間3 min。
定性分析:采用美國國家標準技術研究所(NIST)譜庫檢索,對發酵產物進行定性分析。
定量分析:以乙酸正戊酯(34.74 μg/mL)為內標,采用內標法定量。
1.3.6 酚酸脫羧酶酶活的測定
取50 mL誘導表達后的菌液在8 000 r/min條件下離心5 min,棄上清,加入10 mL 50 mmol/L Tris-HCl(pH 7.0)搖勻,70%功率超聲破壁15 min,離心取上清,得到粗酶液,將粗酶液進行鎳柱純化。
取50 mmol/L阿魏酸為底物,進行酶活力的測定。反應體系:Na2HPO4-檸檬酸緩沖液(pH 5.0)0.8 mL,50 mmol/L阿魏酸0.1 mL,酶液0.1 mL;反應條件:37 ℃水浴反應5 min后加2 mL甲醇終止反應。空白對照為Na2HPO4-檸檬酸緩沖液(pH 6.0)0.9 mL,50 mmol/L阿魏酸0.1 mL[22]。
采用HPLC測定酶液中4-VG的含量。HPLC色譜條件:HypersilGOLD C18色譜柱(3 μm,4.6 mm×250 mm)。流動相為甲醇∶0.1%乙酸=60∶40(V/V),流速1.0 mL/min,柱溫30 ℃,進樣量20μL,檢測波長280 nm[14]。根據4-VG的生成量計算酚酸脫羧酶酶活,其計算公式如下:

式中:e為所加酶液的量,mL;x為4-VG含量,mmol/L;v為酶促反應體系的最終體積,mL;t為酶促反應時間,min。
酚酸脫羧酶酶活定義:每分鐘生產1 μmol 4-VG所需要的酶量為1個單位酶活力(IU/mL)。
1.3.7 酚酸脫羧酶分子質量的測定
參照王勛等[23]的方法采用鎳柱親和層析純化重組菌發酵液,純化的酶液進行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)檢測,測定酚酸脫羧酶的分子質量。
2 結果與分析
2.1 產4-乙烯基愈創木酚菌株的分離及篩選
從發酵酒醅中共分離純化出23株細菌,其中5株細菌產4-VG,4-VG產量見表1。

表1 5株菌株的4-乙烯基愈創木酚產量Table 1 4-vinylguaiacol yield of 5 strains
由表1可知,菌株NF1的4-VG產量最高,達到0.301 mg/g,高于王少磊等[24]從中高溫大曲中篩選到的解淀粉芽孢桿菌(Bacillus amyloliquefaciens)的4-乙基愈創木酚產量(32.89 μg/g)。故將菌株NF1作為目的菌株進行形態學觀察及分子生物學鑒定。
2.2 菌株NF1的鑒定
2.2.1 形態學觀察
菌株NF1的菌落及細胞形態見圖1。
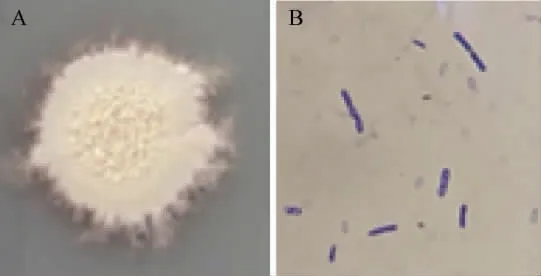
圖1 菌株NF1的菌落(A)及細胞(B)形態Fig.1 Colony (A) and cell (B) morphology of strain NF1
由圖1可知,菌株NF1的菌落表面粗糙不透明,呈污白色,外形不規則,外圈毛糙,內有褶皺。在顯微鏡下觀察,細胞無莢膜,呈長桿狀,周邊有芽孢,芽孢呈橢圓或柱狀,革蘭氏染色為紫色,故為革蘭氏陽性菌。因此,初步鑒定該菌株為芽孢桿菌屬(Bacillussp.)。
2.2.2 分子生物學鑒定
由圖2可知,菌株NF1與枯草芽孢桿菌(Bacillus subtilis)聚于一支,親緣關系最近,因此,鑒定菌株NF1為枯草芽孢桿菌(Bacillus subtilis)。
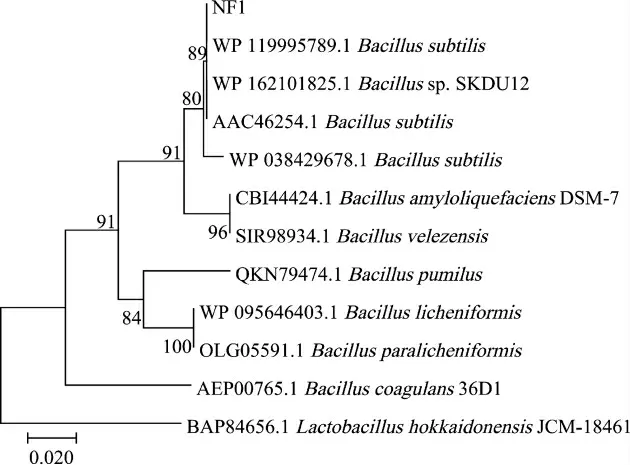
圖2 基于16S rRNA基因序列菌株NF1的系統發育樹Fig.2 Phylogenetic tree of strain NF1 based on 16S rDNA gene sequences
2.3 酚酸脫羧酶基因的克隆及表達
2.3.1 酚酸脫羧酶基因的PCR擴增
以NF1基因組DNA為模板,利用設計的引物進行PCR擴增,將PCR擴增產物進行瓊脂糖凝膠電泳,結果見圖3。由圖3可知,目的基因片段堿基長度為483 bp,與預期結果相符,共編碼161個氨基酸。
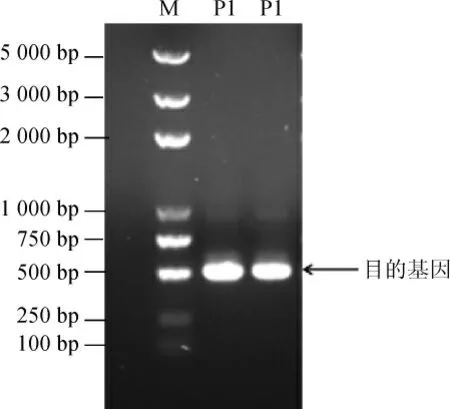
圖3 目的基因的瓊脂糖凝膠電泳分析結果Fig.3 Results of agarose gel electrophoresis analysis of the target gene
2.3.2 酚酸脫羧酶酶活及分子質量測定
采用HPLC 測定純化后的發酵液的4-VG 含量為11.123 mmol/L,通過計算得到酚酸脫羧酶酶活力為66.741 IU/mL。采用SDS-PAGE測定酚酸脫羧酶的分子質量,結果見圖4。
由圖4可知,與pET28a空載相比,重組蛋白成功表達,其蛋白分子質量大小約為20 kDa。該結果與文獻報道的解淀粉芽孢桿菌[14]、地衣芽孢桿菌[22]、短小芽孢桿菌[25]、植物乳桿菌[26]中的酚酸脫羧酶的分子質量大小是一致的。

圖4 重組蛋白的SDS-PAGE結果Fig.4 SDS-PAGE results of recombinant protein
3 結論
本研究從發酵酒醅中篩選出一株高產4-乙烯基愈創木酚的細菌NF1,其4-VG產量為0.301 mg/g。通過形態觀察及分子生物學技術鑒定該菌株為枯草芽孢桿菌(Bacillus subtilis)。從該菌株中成功克隆得到酚酸脫羧酶基因,并在大腸桿菌(Escherichia coli)表達系統中進行誘導表達,以50 mmol/L的阿魏酸為底物時,酚酸脫羧酶酶活力為66.741 IU/mL,經SDS-PAGE檢測,該酶的分子質量約為20 kDa。本研究通過掌握產特殊風味物質的功能菌,以期對白酒中的特定風味物質的含量及比例進行調控,進而提升白酒的風味物質。對產特定風味物質的關鍵酶進行探究,為未來酶的開發及利用提供一定的參考依據,旨在解決酶產率低、不耐高溫等劣勢。

