附子理中湯對慢加急性肝衰竭大鼠肝損傷的影響及其作用機制
陳 微,孫克偉,葉錫勇
(1湖南中醫藥大學第一附屬醫院感染性疾病科,長沙 410000;2湖南中醫藥大學第一附屬醫院肝病科;3湖南中醫藥大學第一附屬醫院院感科)
慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)是在肝硬化、慢性肝炎、慢性膽汁淤積性肝病等慢性肝病基礎上發生的急性或亞急性肝功能失代償綜合征,常伴隨一個甚至多個器官功能衰竭,病情進展迅速,病死率高[1,2]。目前臨床采用抗病毒、肝移植、人工肝等治療手段治療ACLF,明顯降低了病死率,但總體治療效果仍不夠理想[3]。研究認為,肝組織在肝衰竭過程中經受免疫損傷、缺血缺氧性損傷及內毒素血癥三重致死性打擊,炎癥反應是該病理進展過程的中心環節[4]。Toll樣受體4(Toll-like receptor 4,TLR4)是細胞內模式識別受體,能激活核因子-κB(nuclear factor-κB,NF-κB)信號通路,誘導炎癥級聯反應,參與多種疾病的炎癥損傷過程[5,6]。已有研究顯示,TLR4/NF-κB通路參與肝衰竭過程[7]。附子理中湯是傳統中藥湯劑,能顯著改善缺血再灌注急性腎損傷大鼠的腎功能,改善非酒精性脂肪肝大鼠肝臟病理變化,但對ACLF的影響尚鮮有研究[8,9]。本研究將觀察附子理中湯對ACLF大鼠肝損傷的減輕作用,并從炎癥反應方面探究其作用機制。
1 材料與方法
1.1 材料
1.1.1 實驗動物 SD大鼠,體質量200-230 g,購于上海靈暢生物科技有限公司,生產許可證號:SCXK(滬)2018-0003。飼養條件:自由飲水、進食,溫度為22-26 ℃,相對濕度為40%-70%,12 h照明/12 h黑暗。
1.1.2 主要試劑 附子理中湯配制:人參9 g,白術9 g,干姜9 g,炙甘草6 g,炮附子9 g,加4倍的水煎煮60 min,過濾,濾渣加3倍的水煎煮40 min,過濾,濾渣加入2倍的水煎煮30 min,過濾,將3次濾液混合,低溫放置1 d,過濾,使用水浴將濾液濃縮成生藥含量1.5 g/ml的藥液,4 ℃存放備用。乳果糖(貨號:L77521)購自上海吉至生化科技有限公司;大鼠內毒素、白細胞介素(interleukin,IL)-6、IL-8、腫瘤壞死因子-α(tumor necrosis factor-alpha,TNF-α)酶聯免疫(enzyme-linked immunosorbent assay,ELISA)試劑盒(貨號:HL20392、HL20064、HL20700、HL20040)購自上海哈靈生物科技有限公司;HE染色試劑盒(貨號:RS3390-3)購自金克隆(北京)生物技術有限公司;TLR4抗體、NF-κB p-p65抗體、NF-κB p65抗體、GAPDH抗體、羊抗兔IgG(貨號:ab13867、ab239882、ab16502、ab186930、ab133470)購自美國Abcam公司。
1.1.3 主要儀器 AU5800型全自動生化分析儀購自美國Beckman公司;MK3型酶標儀購自美國Thermo公司;CKX41SF型顯微鏡購自日本Olympus公司;GS-800型凝膠掃描成像系統購自美國Bio-Rad公司。
1.2 方法
1.2.1 實驗造模及分組、給藥 大鼠適應性喂養1周,參照叢偉[10]造模方法,建立ACLF大鼠模型,共分為兩個階段。①構建大鼠膽汁淤積性肝硬化模型:大鼠禁食12 h后進行結扎膽總管手術,用4%水合氯醛對大鼠行腹腔注射麻醉(0.7 ml/100 g),腹部備皮,無菌消毒,打開腹腔,分離大鼠膽總管,用4-0絲線結扎,從結扎中間段將膽總管剪斷,用生理鹽水清洗腹腔后縫合,膽管結扎4周后存活的大鼠即已成功建立膽汁淤積性肝硬化模型。②建立大鼠ACLF模型:取已成功建立膽汁淤積性肝硬化模型的大鼠,禁食12 h,按0.2 g/kg給予大鼠0.2 g/ml D-氨基半乳糖溶液腹腔注射,24 h后即可在誘導肝硬化基礎上誘導急性肝損傷,建立大鼠ACLF模型。
將成功建立ACLF模型的40只大鼠分為ACLF組、陽性組和附子理中湯低、中、高劑量組,每組8只大鼠,另取8只不造模的大鼠為對照組。附子理中湯低、中、高劑量組大鼠分別灌胃7.5,15,30 g/kg附子理中湯[11],陽性組大鼠灌胃13.5 g/kg乳果糖[12],對照組、ACLF組大鼠灌胃等量生理鹽水,每日1次,連續給藥兩周。
1.2.2 大鼠肝功能測定 末次給藥24 h后,按0.7 ml/100 g給予大鼠4%水合氯醛腹腔注射麻醉,將大鼠以仰臥位在解剖臺上固定,開腹采集下腔靜脈血3-5 ml,血液樣品經室溫靜置30 min后3 000 r/min離心15 min,分離上清,分為兩份。一份血清用生化分析儀檢測血清門冬氨酸氨基轉移酶(aspartate aminotransferase,AST)、丙氨酸氨基轉移酶(alanine aminotransferase,ALT)、總膽紅素(total bilirubin,TBil)、前白蛋白(prealbumin,PA)水平。
1.2.3 ELISA法檢測大鼠血清內毒素及炎癥相關因子表達情況 剩余一份血清使用內毒素、IL-6、IL-8、TNF-α ELISA試劑盒,按照試劑盒說明書操作步驟,檢測血清內毒素及IL-6、IL-8、TNF-α水平。
1.2.4 大鼠肝組織病理形態學觀察 大鼠開腹采集下腔靜脈血后,均剪取同一葉肝組織,用生理鹽水清洗,分為兩份。一份用于Western blot檢測,另一份置于10%中性甲醛溶液中固定,常規石蠟包埋,切片,脫蠟,HE染色,顯微鏡觀察肝組織病理形態學。
1.2.5 蛋白印跡(Western blot)法檢測大鼠肝組織中TLR4/NF-κB通路相關蛋白的表達 剩余一份肝組織在冰上裂解提取總蛋白,BCA法測定蛋白濃度,蛋白樣品變性后行SDS-PAGE凝膠電泳,將蛋白轉至PVDF膜,脫脂奶粉封閉1 h,加入一抗(TLR4抗體、NF-κB p-p65抗體、NF-κB p65抗體、GAPDH抗體,1 ∶1 000)孵育過夜,用TBST洗滌,加羊抗兔IgG二抗(辣根過氧化物酶標記,1 ∶2 000)孵育1 h,ECL顯色曝光,凝膠掃描成像系統掃描圖像,分析條帶灰度。
1.3 統計學分析

2 結果
2.1 各組大鼠肝功能指標
與對照組相比,ACLF組大鼠血清AST、ALT、TBil水平顯著升高(P<0.05),PA水平顯著降低(P<0.05);與ACLF組相比,陽性組與附子理中湯低、中、高劑量組大鼠血清AST、ALT、TBil水平顯著降低(P<0.05),PA水平顯著升高(P<0.05);陽性組與附子理中湯低劑量組大鼠血清AST、ALT、TBil、PA水平差異無統計學意義(P>0.05);與陽性組相比,附子理中湯中、高劑量組大鼠血清AST、ALT、TBil水平顯著降低(P<0.05),PA水平顯著升高(P<0.05);隨著附子理中湯劑量的升高,大鼠血清AST、ALT、TBil水平顯著降低(P<0.05),PA水平顯著升高(P<0.05,見表1)。
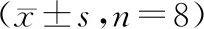
表1 各組大鼠血清AST、ALT、TBil、PA水平比較
2.2 各組大鼠血清內毒素及炎癥相關因子表達情況
與對照組相比,ACLF組大鼠血清內毒素、IL-6、IL-8、TNF-α水平顯著升高(P<0.05);與ACLF組相比,陽性組與附子理中湯低、中、高劑量組大鼠血清內毒素、IL-6、IL-8、TNF-α水平顯著降低(P<0.05);陽性組與附子理中湯低劑量組大鼠血清內毒素、IL-6、IL-8、TNF-α水平差異無統計學意義(P>0.05);與陽性組相比,附子理中湯中、高劑量組大鼠血清內毒素、IL-6、IL-8、TNF-α水平顯著降低(P<0.05);隨著附子理中湯劑量的升高,大鼠血清內毒素、IL-6、IL-8、TNF-α水平顯著降低(P<0.05,見表2)。

表2 各組大鼠血清內毒素、IL-6、IL-8、TNF-α水平比較
2.3 各組大鼠肝組織病理形態
對照組大鼠肝組織中細胞排列整齊,無變性、壞死,未見炎性細胞浸潤;ACLF組大鼠肝組織中肝細胞可見片狀壞死,可見炎細胞浸潤及纖維組織增生;陽性組及附子理中湯低、中、高劑量組肝組織病理損傷較ACLF組均有不同程度地減輕(見圖1)。

圖1 各組大鼠肝組織病理形態 (HE染色,×200)Figure 1 Pathological morphology of liver tissue of rats in each group (HE staining,×200)
2.4 各組大鼠肝組織中TLR4/NF-κB通路相關蛋白表達情況
與對照組相比,ACLF組大鼠肝組織中TLR4、NF-κB p-p65/NF-κB p65蛋白表達水平顯著升高(P<0.05);與ACLF組相比,陽性組和附子理中湯低、中、高劑量組大鼠肝組織中TLR4、NF-κB p-p65/NF-κB p65蛋白表達水平顯著降低(P<0.05);陽性組與附子理中湯低劑量組大鼠肝組織中TLR4、NF-κB p-p65/NF-κB p65蛋白表達水平差異無統計學意義(P>0.05);與陽性組相比,附子理中湯中、高劑量組大鼠肝組織中TLR4、NF-κB p-p65/NF-κB p65蛋白表達水平顯著降低(P<0.05);隨著附子理中湯劑量的升高,大鼠肝組織中TLR4、NF-κB p-p65/NF-κB p65蛋白表達水平顯著降低(P<0.05,見圖2、表3)。

表3 各組大鼠肝組織中TLR4、NF-κB p-p65、NF-κB p65蛋白表達水平比較

圖2 各組大鼠肝組織中TLR4、NF-κB p-p65、NF-κB p65蛋白表達情況Figure 2 Expression of TLR4,NF-κB p-p65,NF-κB p65 proteins in liver tissue of rats in each group
3 討論
ACLF是在慢性肝病基礎上短期內出現的急性或亞急性肝功能失代償的臨床癥候群,臨床主要表現為極度乏力、黃疸迅速加深、出血傾向、明顯的消化道癥狀、失代償性腹水等,疾病進展快,3個月病死率可高達50%[13]。由于肝源缺乏,肝移植治療具有明顯的限制,目前ACLF治療仍以內科藥物治療為主。因此,尋找高效的ACLF治療藥物備受人們重視。叢偉[10]建立ACLF模型方法較其他造模方法具有簡單、快速、有效、便于臨床藥物研究的特點,故本研究采用其造模方法建立ACLF模型。HE染色可見ACLF組大鼠肝組織中肝細胞存在片狀壞死,可見炎細胞浸潤及纖維組織增生,血清檢測可見肝功能指標AST、ALT、TBil、內毒素及炎癥因子IL-6、IL-8、TNF-α水平顯著升高,PA水平顯著降低,提示大鼠體內炎癥反應加劇,大鼠肝臟功能已明顯惡化,肝臟對內毒素的滅活能力明顯下降。
附子理中湯是傳統中藥湯劑,由白術、人參、炙甘草、干姜和炮附子配制而成,其中,人參的主要成分人參皂苷具有保肝、護肝作用;炙甘草的活性成分甘草素具有抗炎、抗氧化作用,能抑制肝纖維化[14,15]。譚瑋璐等[16]研究發現,附子理中湯可能通過調節腸道黏膜NALP-3炎性體,減少腸道炎性物質釋放,并降低過強的免疫應答,改善腹瀉型腸易激綜合征癥狀。張艷曉等[17]研究顯示,附子理中湯治療脾腎陽虛型潰瘍性結腸炎具有較好的療效,其作用機制可能與降低血清促炎因子及細胞間黏附因子表達水平有關。楊家耀等[9]研究表明,附子理中湯能減輕非酒精性脂肪肝大鼠肝臟損傷,降低炎癥因子釋放。本研究結果顯示,使用附子理中湯治療ACLF大鼠后,可見大鼠肝組織病理損傷減輕,同時大鼠血清AST、ALT、TBil、內毒素、IL-6、IL-8、TNF-α水平顯著降低,PA水平顯著升高,且隨著劑量的升高,其療效也在不斷提高,提示附子理中湯能降低ACLF大鼠體內炎癥水平,改善肝組織損傷,提高大鼠肝功能,加強肝臟對內毒素的滅活能力。研究發現,乳果糖、腸道微生態調節劑等能改善ACLF患者預后,其作用機制可能與降低炎癥反應及內毒素血癥有關[12]。乳果糖是一種人工合成雙糖,不被胃腸黏膜雙糖酶分解,能調節腸道菌群,減少腸道內毒素產生[18]。本研究采用乳果糖作為陽性藥物判斷附子理中湯對ACLF的療效,結果顯示,中、高劑量的附子理中湯療效均高于乳果糖,提示附子理中湯治療ACLF在減少腸道內毒素產生、減輕肝臟損傷、降低炎癥反應方面療效甚佳,具有一定臨床價值。
TLR4/NF-κB信號通路是誘發炎癥反應的重要通路,抑制其激活能抑制肝纖維化,進而改善肝功能[19]。Du等[20]研究發現,Kaempferol保護肝細胞免受Acetaminophen肝毒性的作用機制與抑制TLR4/NF-κB信號通路有關。馬威等[21]研究表明,附子理中湯能減輕非酒精性脂肪肝大鼠肝組織炎癥損傷,其作用機制可能與抑制TLR4/NF-κB p65信號通路激活有關。本研究顯示,ACLF組大鼠肝組織中TLR4、NF-κB p-p65/NF-κB p65蛋白表達水平較對照組顯著升高,提示TLR4/NF-κB信號通路參與ACLF大鼠肝組織的病理學改變過程。使用附子理中湯治療后,ACLF大鼠肝組織中TLR4、NF-κB p-p65/NF-κB p65蛋白表達水平顯著降低,提示附子理中湯改善ACLF肝損傷的機制可能涉及對TLR4/NF-κB信號通路的抑制。
綜上所述,附子理中湯能改善ACLF大鼠肝損傷,減輕炎癥反應,改善肝功能,其機制可能與抑制TLR4/NF-κB信號通路有關。

