上海市臨床實驗室13個常規化學檢測結果互認項目檢測質量分析
蔣玲麗,朱 俊,婁 嬌,楊 雪,王 青(上海市臨床檢驗中心質量管理部信息科,上海200126)
為進一步貫徹落實上海市醫藥衛生體制改革工作要求,減輕群眾就醫負擔,上海市衛生健康委員會推出《關于全面推進本市醫療機構間醫學影像檢查資料和醫學檢驗結果互聯互通互認工作的實施意見》(滬衛醫﹝2019﹞27)[1](簡稱意見)。2019年10月上海市衛生健康委員會提出首先試點在37 家市級公立醫療機構間實現部分項目互聯互通互認,其中常規化學檢測項目13 個。同時意見指出所有醫療機構均應納入質控范圍,通過實施室間質量評價(IQC)和室內質量控制(EQA)使檢驗結果達到互認的合格標準。上海市臨床檢驗中心(Shanghai Center for Clinical Laboratory,SCCL)負責實施上海市臨床實驗室IQC 和EQA。為了了解實驗室互認項目的檢測質量,本文統計實驗室上傳的2019年IQC 和EQA 數據,分析互認和非互認實驗室的差異,為進一步推進上海地區醫療機構檢驗結果互認工作提供科學依據。
1 材料和方法
1.1 研究對象 所有參加SCCL 組織的IQC 和EQA 的上海地區醫療機構實驗室。以2019年10月上海市衛生健康委員會提出的試點互聯互通互認的37 家市級公立醫療機構實驗室為互認組,其余實驗室為非互認組。
1.2 方法
1.2.1 IQC 數據收集與計算 :SCCL 組織IQC 計劃,實驗室可自愿參加并自由選擇相應濃度的質控品。每年年底SCCL 發放統一代購的室內質控品,包含低中高3 個濃度水平,分別用L1,L2 和L3 表示,實驗室將IQC 數據上傳至上海市臨床檢驗中心質控及預警信息系統。以各實驗室該項目全年的室內質控數據,剔除4 倍標準偏差(standard deviation,SD)后,分別計算13 個常規化學項目年度累計CV,用百分比表示。以WS/T 403-2012 臨床生物化學檢驗常規項目分析質量指標[2]中CV標準,所有濃度水平均小于該CV標準判定實驗室該項目CV合格,分別計算13 個項目2019年CV合格率。
1.2.2 EQA 數據收集與計算 :SCCL 每年組織兩次EQA,一次5 個批號樣本。EQA 評價采用的允許總誤差(allowable total error,Tea),按WS/T 403-2012 臨床生物化學檢驗常規項目分析質量指標推薦的Tea,每次EQA 有2 或2 個以上樣本結果錯誤判定實驗室該項目不合格;分別計算13 個項目2019兩次EQA 的合格率。
1.3 統計學分析 采用MedCalc 19.1 軟件進行分析,數據通過Shapiro-Wilk test 檢驗,呈偏態分布的數據采用中位數(四分位數)[M(P25~P75)]表示,組間比較采用Mann-Whitney 檢驗;兩個率之間的比較采用χ2檢驗,以P<0.05 為差異有統計學意義。對互認組和非互認組數據進行分析。
2 結果
2.1 IQC 分析結果 見表1 和表2。13 個項目中,互認組和非互認組TG,Fe,UA,URE,CRE 和Mg項目IQC年度CV在L1 濃度水平差異有統計學意義(U=2.014,2.136,2.747,2.987,3.094 和3.253,P=0.044 0,0.032 7,0.006 0,0.002 8,0.002 0 和0.001 1,均P﹤0.05)。
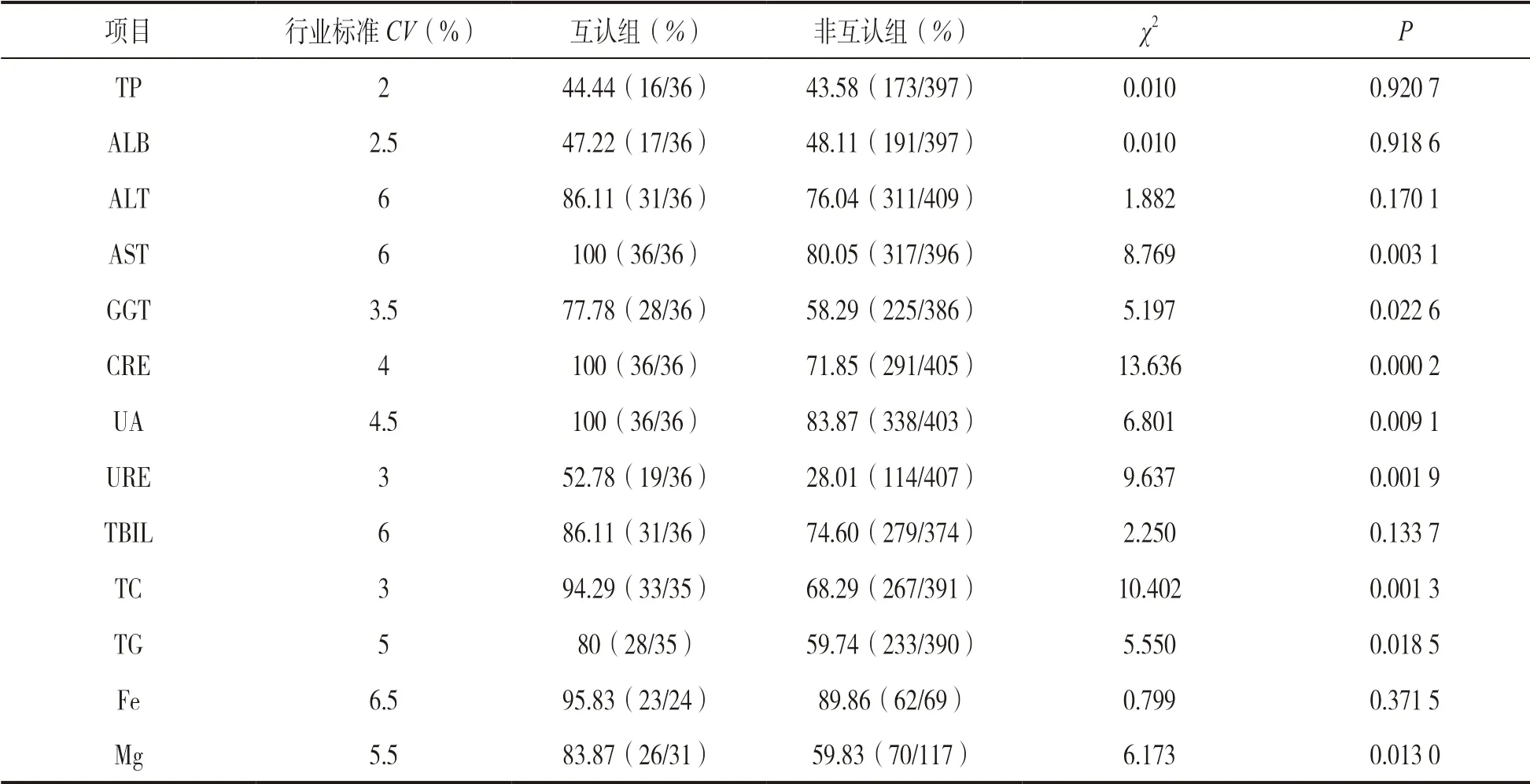
表2 13 個常規化學項目年度CV 結果分析
按WS/T 403-2012 標準規定的不精密度要求,互認組13 個項目合格率在44.44%~100%之間,其中TP,ALB,GGT 和URE 4 個項目合格率低于80%;非互認組13 個項目合格率在43.58%~89.86% 之間,其中TP,ALB,ALT,GGT,CRE,URE,TBIL,TC,TG 和Mg 合 格率低于80%。GGT, TG,Mg,UA,AST,URE,TC 和CRE 項目CV合格率在互認組和非互認組實驗室比較差異有統計學意義(χ2=5.197~13.636,均P<0.05)。
2.2 EQA 分析結果 見表3。13 個互認項目中,互認組合格率在97.22%~100%之間,僅URE 項目在第一次EQA 中有1 家實驗室出現了不合格,其余項目兩次合格率均為100%;非互認組合格率在96.62%~100%之間,除Fe 項目EQA 兩次合格率均為100%外,其余項目兩次合格率均未都達到100%。互認組和非互認組合格率比較差異無統計學意義(均P>0.05)。
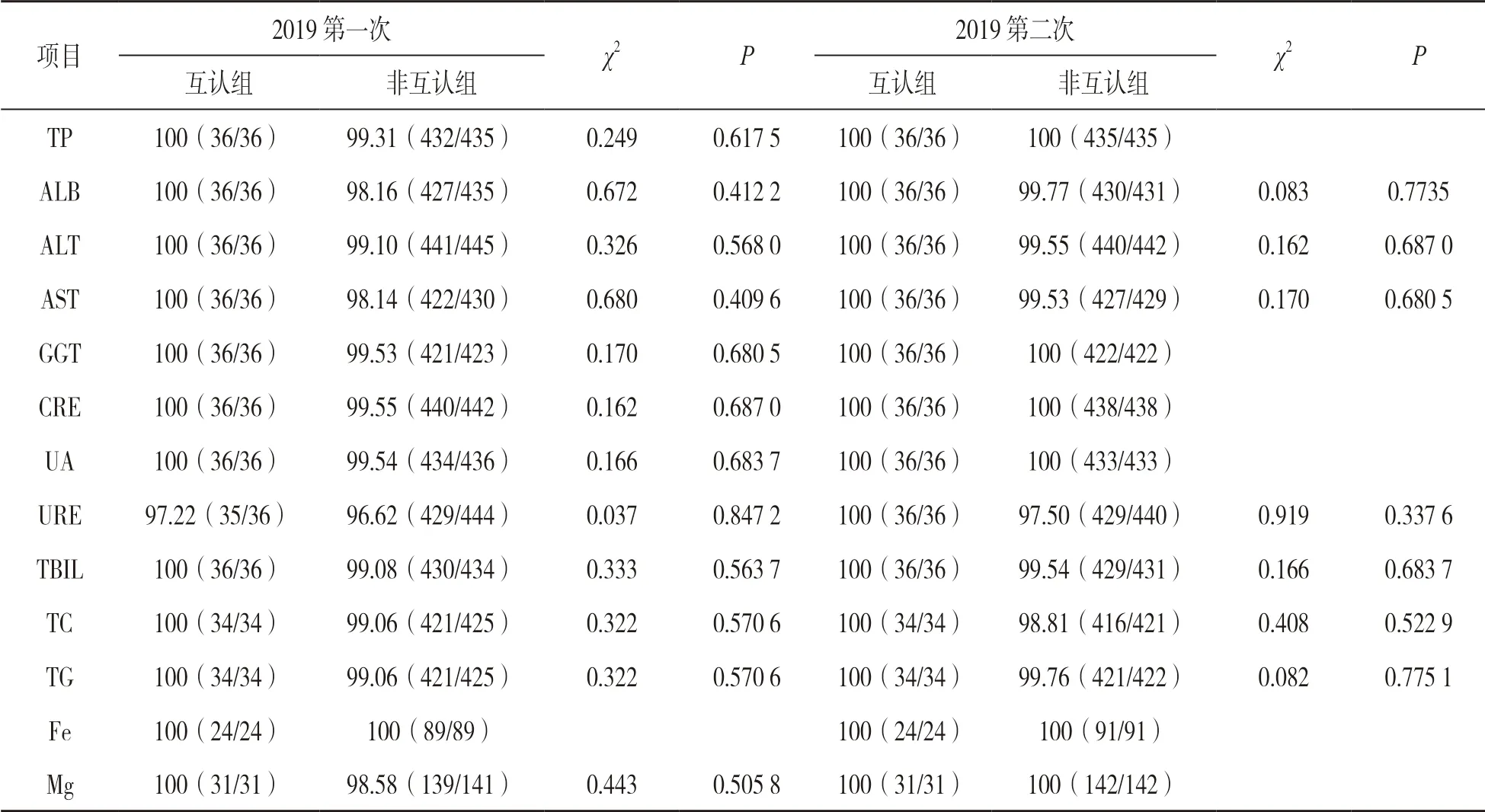
表3 13 個項目室間質評合格率[%(n)]
3 討論
醫學檢驗結果互認作為病人避免重復檢查、促進醫療服務共享機制、增強醫療機構之間協同性的重要舉措,得到了各部門的強力推行,并在歷次深化醫藥衛生體制改革方案中被一再強調。但是檢驗結果互認在具體實施過程中仍然困難重重,排除臨床疾病變化的影響,究其原因還是取決于各項目的檢驗結果在不同的檢測機構中是否一致,或者說不同醫療機構的檢驗結果是否具有相同的臨床意義。已有不少研究者通過飛行檢查[3]、新鮮血比對[4]、新鮮血校準[5]等方式分析不同實驗室之間檢測結果的一致性。
但是以上方式費時費力常用于在納入互認項目前了解檢測項目現狀,不能作為常態化的監控手段。《醫療機構臨床實驗室管理辦法》[6]規定開展臨床檢驗項目必須實施IQC 和EQA,故可作為互認項目長期監測的手段,李婷婷等[7]在對京津冀地區檢驗結果互認的建議中提出動態監測也包括IQC 和EQA 數據。SCCL 組織上海地區IQC 以及EQA 工作,可收集和了解實驗室IQC 和EQA 數據。分析上海地區醫療機構實驗室IQC 數據提示各項目互認組和非互認組年度CV沒有明顯差異,僅在CRE,UA,URE,TG,Fe 和Mg 項目低濃度水平差異有統計學意義,但這也提示參與互認的實驗室在選擇室內質控品濃度的時候,是否一定要選擇低濃度水平的質控品;進一步與行業標準規定的CV比較,互認組合格率明顯高于非互認組(表2),其中GGT, TG,Mg,UA,AST,URE,TC 和CRE 8 個項目合格率在互認組和非互認組比較差異有統計學意義。但是盡管如此,互認組還是有TP,ALB,GGT 和URE 4 個項目滿足要求的實驗室數低于80%,說明盡管37 家醫療機構試點互認,但是在實施過程中還有部分實驗室的CV不能滿足行業標準的要求;而非互認組AST,UA 和Fe 3 個項目滿足要求的實驗室數大于80%,說明部分項目可以擴大互認范圍。分析上海地區醫療機構實驗室EQA數據(表3)提示上海地區實驗室13 個項目EQA合格率在95%以上,互認組合格率優于非互認組。從數據分析看出互認組IQC 的CV和EQA 的合格率均優于非互認組,說明在結果互認實施初期,從檢驗質量較好的市級公立醫療機構試點結果互認應該是個很好的舉措;但是數據分析也提示兩組中均有滿足要求和非滿足要求的實驗室,因此實施動態監控,在互認工作實施后出現臨床檢驗質量不符合互認要求情形的醫療機構,可根據情況督促其進行整改或取消檢驗結果互認醫療機構資格,同時逐步將滿足要求的其他醫療機構實驗室納入結果互認。目前在實施動態監管過程中,SCCL 面臨著有些實驗室不上傳或者不實時上傳其IQC 數據的問題,可能需要衛健委出臺相關政策強制實驗室將數據上傳至SCCL。
需要指出的是由于儀器、試劑、校準品等種類繁多,各實驗室的檢測系統不完全一致[8],導致不同檢測系統結果存在差異,SCCL 組織的常規化學EQA 也是按檢測系統分組評價的;另外參考區間上下限不一致給不同醫療機構間檢測結果互認帶來很大障礙[9-10]。雖然通過監測IQC 和EQA 可以動態監控結果互認,但是系統本身的差異目前還不能解決,故建議在實施檢驗結果互認時應標注各實驗室的檢測系統,并允許相同檢測系統的檢測結果可以互認。
綜上所述,上海地市醫療機構實驗室檢測質量還不盡相同,要實現更大范圍內的檢驗結果互通互認還有很長的路要走,動態監測體現檢測質量的IQC 和EQA 數據支持結果互認能夠使互認之路行進地更為順暢。

