腫瘤壞死因子-α、腫瘤壞死因子受體與正常白蛋白尿2型糖尿病腎病患者腎功能的相關性
吳曉光
(鄭州陽城醫院 腎內科,河南 鄭州 452470)
微量白蛋白尿是糖尿病腎病(diabetic nephropathy,DN)的早期臨床體征,隨著病情發展可出現大量白蛋白尿,引起腎小球濾過率(estimated glomerular filtration rate,eGFR)降低,最終導致終末期腎臟病(end stage renal disease,ESRD)。有研究表明,在出現白蛋白尿前,10%~30%的1型和(或)2型糖尿病患者eGFR已低于60 mL·min-1·1.73 m-2,這使得糖尿病腎病的診斷需要重新定義[1]。研究發現,患有正常白蛋白尿的糖尿病腎病(diabetic nephropathy with normal proteinuria,NA-DKD)患者主要為老年女性,其視網膜病變發生率較低[2]。此外,慢性炎癥、動脈粥樣硬化以及腎小管間質或血管損傷已被證明在NA-DKD的病理生理發展過程中起關鍵作用。但是,關于NA-DKD診斷的特征性生物標志物尚少見報道。本研究選取了血清骨保護素(osteoprotegerin,OPG)、血漿腦鈉肽(brain natriuretic peptide,BNP)、心-踝血管指數(cardio-ankle vascular index,CAVI)等心血管疾病標志物,腎小管損傷和炎癥[血清腫瘤壞死因子α(tumor necrosis factor alpha,TNF-α)、血清腫瘤壞死因子受體1(tumor necrosis factor receptor1,TNFR1)]標志物,探討其與2型糖尿病白蛋白尿患者eGFR之間的關聯。
1 資料與方法
1.1 一般資料選取2017年2月至2020年5月鄭州陽城醫院收治的314例2型糖尿病患者作為研究對象,納入研究人群的平均年齡(64.5±13.7)歲,166例(52.9%)患者為男性,eGFR中位數為72(61~85)mL·min-1·1.73 m-2。本研究經鄭州陽城醫院醫學倫理委員會批準。
1.2 選取標準(1)納入標準:符合美國糖尿病學會(American Diabetes Association,ADA)制定的糖尿病醫學診療標準。(2)排除標準:① 1型糖尿病或其他類型的糖尿病;②微量白蛋白尿;③大量白蛋白尿;④未接受眼底鏡檢查;⑤血生化資料不完整。
1.3 資料收集記錄所有患者基線資料和臨床特征。采用戴維斯分類法將糖尿病性視網膜病變分為增生前、增生或未增生。既往心血管疾病定義為冠狀動脈或外周動脈血運重建史、既往心肌梗死或中風史。患者入院時采集血清樣品,-80 ℃保存備用。采用酶聯免疫吸附測定法測量TNF-α、血清TNFR1和血清腫瘤壞死因子受體2(tumor necrosis factor receptor 2,TNFR2)和OPG。常規實驗室方法測量BNP、尿液肝型脂肪酸結合蛋白(liver-type fatty acid-binding protein,L-FABP)。非高密度脂蛋白膽固醇(non-high-density lipoprotein cholesterol,non-HDL-C)定義為總膽固醇減去HDL-C的差。采用免疫比濁法和酶法定量檢測尿白蛋白和肌酐(creatinine,Cr),并計算尿白蛋白與肌酐的比值(ratio of urinary albumin to creatinine,ACR)。使用VaSeraVS-1500A血管篩查系統測量CAVI。
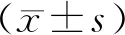
2 結果
2.1 基線資料比較根據eGFR分類的2型糖尿病研究患者的基線特征[eGFR <60(NA-DKD)比≥60(No-CKD)(mL·min-1·1.73 m-2)]。NA-DKD組年齡較大,糖尿病病史更長,既往CVD發生率更高,尿酸水平更高,且具有更低水平的DBP、HDL-C和血紅蛋白水平。此外,NA-DKD組的CAVI、BNP、OPG、TNF-α、TNFR1和TNFR2水平高于No-CKD組,差異有統計學意義(P<0.05)。見表1。
2.2 ACR、eGFR與生物標志物之間的相關性分析ACR與L-FABP(r=0.35,P<0.001)、BNP(r=0.15,P<0.01)、TNFR1(r=0.14,P<0.05)及CAVI(r=0.15,P<0.01)正相關。比較之下,eGFR與BNP(r=-0.39,P<0.001)、OPG(r=0.22,P<0.001)、TNF-α(r=0.25,P<0.001)、TNFR1(r=-0.47,P<0.001)、TNFR2(r=-0.48,P<0.001)及CAVI(r=0.32,P<0.001)呈負相關。另外,TNF-α和TNFR標志物之間呈正相關,兩個TNFR之間的相關系數為0.90(P<0.001),存在多重共線性,并且兩個TNFR與TNF-α呈正相關(TNFR1:r=0.45,P<0.001;TNFR2:r=0.49,P<0.001)。見表2。

表2 ACR、eGFR與生物標志物之間的Pearson相關性分析(r)
2.3 腎功能降低的多元logistic風險回歸模型分析多元logistic回歸分析的結果,以是否發生腎功能降低(賦值eGF<60 mL·min-1·1.73 m-2=1,eGFR≥60 mL·min-1·1.73 m-2=0)為因變量,將年齡、性別、尿酸、DBP和血紅蛋白作為協變量加入模型中評估了生物標志物對NA-DKD風險的影響。結果顯示,除TNF-α和TNFR外其他生物標記物均無統計學意義(P>0.05)。為了進一步評估TNF-α和TNFR評估NA-DKD的獨立作用,建立了模型2和模型3,結果顯示,在患有2型糖尿病白蛋白尿的患者中升高的TNFRs而不是TNF-α與腎功能降低密切相關(P<0.05)。見表3。

表3 多因素logistic比例風險回歸模型分析
3 討論
CAVI與2型糖尿病白蛋白尿患者腎功能的關聯。動脈硬化是心血管疾病發生的重要預測因子,并且與腎功能降低和蛋白尿的發生密切相關。本研究中使用CAVI來評估動脈硬度,與臂踝脈搏波速度等指標比較CAVI受血壓影響更小,因此準確性更高。此外,CAVI也是心血管疾病的有效預測因子,CAVI水平變化可以預測冠心病患者不良心血管事件。本研究結果顯示,NA-DKD組CAVI高于非CKD組,相關性分析顯示CAVI與ACR、EGFR兩種腎功能指標相關。即使對相關臨床協變量及生物標記物進行調整后,ACR仍然與CAVI存在相關性。這些結果表明,CAVI和ACR存在相關性,即使是正常白蛋白尿患者。但是,多因素分析中未發現CAVI與腎功能降低存在顯著性。
OPG與2型糖尿病白蛋白尿患者腎功能的關聯。OPG與TNFR1和TNFR2同屬于TNFR超家族成員,并被認為是動脈粥樣硬化的標志物[3]。既往研究采用脈搏波速度或CAVI評估發現OPG與周圍血管疾病存在聯系,并與ACR和eGFR相關,因此可以作為預測DN患者CVD及終末期腎臟疾病的潛在風險因素[4]。本研究發現OPG與CVD(即CAVI和BNP)和炎癥標志物(即TNF-α和TNFRs)相關。但是多因素logistic回歸模型分析顯示,OPG無法有效區分NA-DKD和No-CKD患者(P>0.05)。
L-FABP與2型糖尿病白蛋白尿患者腎功能的關聯。既往研究發現,腎小管間質纖維化與腎功能降低而不是蛋白尿有關,此外,Ekinci等[5]發現,與患有糖尿病合并白蛋白尿的患者比較,NA-DKD患者腎小管間質纖維化和血管病變發生率更高,提示腎小管間質病變可能參與NA-DKD的發生發展。動物實驗和臨床試驗均發現,尿L-FABP水平與腎小管間質纖維化相關,其可以預測DN患者的腎功能降低和心血管事件發生風險[6-7]。基于上述研究基礎,本研究選擇L-FABP作為評估腎小管間質損傷的標志物,結果顯示,NA-DKD組和No-CKD組之間L-FABP水平差異無統計學意義,且多因素logistic回歸模型分析亦顯示,L-FABP無法有效區分NA-DKD和No-CKD患者(P>0.05),可能與本研究納入對象腎功能損傷程度較輕有關,其腎小管間質纖維化程度較小,因此無法觀測到統計學差異。
M-TNF-α、TNFR與2型糖尿病白蛋白尿患者腎功能的關聯。慢性炎癥可能在DN的發生和發展中發揮著重要作用。腎組織中的巨噬細胞、T細胞和中性粒細胞產生促炎癥因子,進一步激活糖尿病腎內浸潤的炎癥細胞進而導致腎細胞的炎癥反應。腫瘤壞死因子α由腎細胞和巨噬細胞產生,通過幾種機制參與DN的發生和發展,包括腎小球內血流量減少、腎小球血管收縮增加和腎小球基膜通透性增加。TNFR可以預測糖尿病患者腎功能水平,并通過建立糖尿病小鼠模型證明了TNF-TNFR途徑也參與了DN的發病機制。但是,尚不清楚腫瘤壞死因子α和腫瘤壞死因子受體是否與NA-DKD患者腎功能降低有關。本研究結果表明,在對2型糖尿病白蛋白尿患者潛在的生物標志物和臨床協變量進行調整后,血清腫瘤壞死因子α和腫瘤壞死因子受體與腎功能降低有關,尚需進一步對其參與機制進行深入探討。
本研究存在一定局限性。首先,未進行腎活檢以診斷DKD,因此可能無法完全排除患有其他腎臟疾病的患者。其次,僅使用尿液中的L-FABP作為腎小管間質損傷的生物標志物,因此不能排除其他腎小管間質損傷生物標記物(如KIM-1和NGAL)的影響。最后,作為一項回顧性研究無法確定TNF-α、TNFR與腎功能之間的因果關系。
綜上所述,2型糖尿病白蛋白尿患者TNFRs水平而不是TNF-α水平與腎功能降低密切相關。

