唑來膦酸聯合化療治療惡性腫瘤椎體轉移伴病理性骨折高風險患者的臨床價值
李凡,張譽,湯雷
(1.安徽省第二人民醫院黃山路院區腫瘤科,安徽合肥 230000;2.安徽中醫藥大學第三附屬醫院老年病科,安徽合肥 230000)
椎體骨轉移癌是惡性腫瘤常見并發癥之一,也是其血行轉移的常見部位[1-2]。此類患者由于骨髓腔內腫瘤逐漸增大,并釋放腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)等大量炎癥因子,對骨膜造成侵犯,引發骨溶解、骨痛,對于老年骨質疏松患者極易引發病理性骨折、脊髓壓迫等嚴重并發癥,對患者生活造成嚴重影響[3]。臨床針對此類患者多采用化療或放療進行治療,可有效緩解骨痛,降低病理性骨折等不良事件發生風險,但療效持續時間有限[4]。唑來膦酸是新型雙磷酸鹽藥物,抗骨吸收能力較好,可對溶骨性病理變化發揮有效抑制作用,對病理性骨折、脊髓壓迫等不良事件具有一定的防治作用[5]。基于此,本研究通過對80例惡性腫瘤椎體轉移伴病理性骨折高風險患者進行分組治療,探討唑來膦酸聯合化療治療的臨床價值。現報道如下。
1 資料與方法
1.1 一般資料
選取2016年12月~2019年12月本院收治的惡性腫瘤椎體轉移伴病理性骨折高風險患者80例,采用隨機數表法分為對照組(40例)和研究組(40例)。對照組中,男23例,女17例;年齡52-72歲,平均(63.27±5.02)歲;肺癌13例,大腸癌12例,前列腺癌7例,乳腺癌8例。研究組中,男22例,女18例;年齡53-72歲,平均(64.03±5.14)歲;肺癌15例,大腸癌11例,前列腺癌6例,乳腺癌8例。兩組性別、年齡等一般資料對比,均衡性良好(P>0.05),可對比。
1.2 入選標準
(1)納入標準:原發病灶經組織學檢查確診,且經影像學證實至少存在1處椎體轉移;骨轉移灶未接受放化療治療者;預計生存期3個月以上;經骨密度測定確診為骨質疏松者(T值≤-2.5)。(2)排除標準:對研究藥物過敏者;無法耐受化療者;合并肝腎等重要器官嚴重疾病者;椎體后壁不完整,脊髓神經根壓迫風險較高者;椎體呈成骨性破壞;合并血液系統疾病或凝血功能障礙者。
1.3 治療方法
對照組僅接受化療治療,相應的癌種根據CSCO指南推薦的一線化療方案予以化療4個療程;研究組在對照組基礎上增用唑來膦酸,即靜脈滴注唑來膦酸注射液100mL,滴注時間不少于30min,4周1次,連續滴注治療3次。
1.4 觀察指標
(1)骨轉移灶療效:完全緩解(complete remission,CR):治療后原有病灶持續4周以上完全消失;部分緩解(partial remission,PR):原有病灶體積縮減,溶骨性病灶再鈣化,且持續4周以上;穩定(stable disease,SD):原有病灶未發生變化;進展(progressive disease,PD):有新病灶出現,或原有病灶面積增大。(2)疼痛緩解情況:參考世界衛生組織疼痛分級評估患者疼痛情況,分為0、Ⅰ、Ⅱ、Ⅲ級;根據患者疼痛分級變化對治療前后疼痛緩解情況進行評估,緩解2級及以上為顯效,降低1級為有效,未達到上述標準為無效。(3)實驗室指標:于治療前、治療6個月后采集患者晨起空腹靜脈血5mL,高速離心處理后取上層清液待測,采用酶聯免疫吸附法對血鈣(Ca2+)、堿性磷酸酶(alkaline phosphatase,AKP)、骨鈣素(osteocalcin,OC)、Ⅰ型膠原交聯氨基末端肽(N-telopeptide of typeⅠcollagen,NTX)、Ⅰ型膠原羧基端肽β特殊序列(Beta C-terminal crosslinked telopeptides of typeⅠcollagen,β-CTX)進行測定。于治療前、治療6個月后采用AKDX-09W-I雙能X線骨密度檢測儀對兩組患者髖部及腰椎骨密度(bone mineral density,BMD)進行測定。(4)不良事件:比較兩組治療后不良事件發生率,包括病理性骨折、脊髓壓迫、高血鈣癥等。
1.5 統計學方法

2 結果
2.1 骨轉移灶療效
研究組骨轉移灶治療總有效率略高于對照組(67.50% VS 57.50%),但差異無統計學意義(P>0.05),見表1。

表1 兩組骨轉移灶療效對比[n(%)]
2.2 疼痛緩解情況
研究組疼痛緩解總有效率顯著高于對照組(87.50% VS 67.50%),差異有統計學意義(P<0.05),見表2。
2.3 血清Ca2+及炎癥因子
治療前兩組血清Ca2+、髖部及腰椎BMD比較,差異無統計學意義(P>0.05);治療后研究組血清Ca2+顯著低于對照組,髖部及腰椎BMD顯著高于對照組,差異均有統計學意義(P<0.05),見表3。
2.4 骨代謝
治療前兩組血清OC、β-CTX、NTX、AKP水平比較,無明顯差異(P>0.05);治療后研究組血清OC、β-CTX、NTX、AKP水平均顯著低于對照組,差異有統計學意義(P<0.05),見表4。

表2 兩組疼痛緩解情況對比n(%)
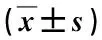
表3 兩組治療前后血清Ca2+及炎癥水平對比
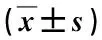
表4 兩組治療前后骨代謝水平對比
2.5 不良事件
研究組治療后不良事件發生率為15%(6/40),其中3例脊髓壓迫、高鈣血癥2例、病理性骨折1例。對照組治療后不良事件發生率為17.5%(7/40),其中2例脊髓壓迫、高鈣血癥4例、病理性骨折1例。兩組不良事件發生率相比,差異無統計學意義(x2=0.092,P=0.762)。
3 討論
惡性腫瘤晚期易發生遠處轉移,椎體骨轉移是其常見轉移部位,臨床治療主要以延長患者生存期、提高其生存質量為主[6]。化療是治療惡性腫瘤椎體轉移的主要治療方案之一,不僅可以對原發病灶產生抑制,還可對骨轉移病灶發揮一定療效,但對于降低患者病理性骨折的發生風險無明顯益處[7]。唑來膦酸是治療腫瘤患者骨疾病的基礎藥物之一,主要藥理作用是對骨吸收產生抑制,其具體作用機制尚未明確,可能與以下幾點有關:①唑來膦酸可對破骨細胞活性產生抑制,促使其凋亡;②通過與骨細胞結合,對破骨細胞吸收軟骨、礦化骨的過程產生抑制;③可對腫瘤產生的多種刺激因子產生抑制,進而減少骨鈣的釋放[8-9]。有研究指出,唑來膦酸聯合化療可發揮協同作用,緩解骨疼痛,并抑制骨轉移[10]。
在骨轉移過程中,IL-1β、TNF-α等大量炎癥因子被釋放,微炎癥環境對破骨細胞的形成產生了促進作用,進而增強促進溶骨因子的表達,對骨細胞產生破壞,造成骨溶解,并產生劇烈性疼痛[11]。本研究結果顯示,研究組疼痛緩解總有效率顯著高于對照組,提示唑來膦酸聯合化療治療惡性腫瘤椎體轉移伴病理性骨折高風險患者可有效緩解疼痛。究其原因在于:唑來膦酸可通過與骨細胞結合,對破骨細胞的活性發揮抑制作用,對IL-1β、TNF-α等炎癥因子的釋放產生抑制,并可通過減少骨質吸收處的破骨細胞聚集,加快破骨細胞凋亡,達到緩解骨疼痛,降低骨轉移風險的目的[12]。惡性腫瘤骨轉移患者骨溶解增強,BMD下降,骨強度下降,極易發生骨折,若合并骨質疏松癥,則病理性骨折風險進一步提高。本研究結果顯示,治療后研究組髖部、腰椎BMD顯著高于對照組,提示唑來膦酸聯合化療可在一定程度上提升骨密度水平。究其原因在于,唑來膦酸是二磷酸化合物,具有特異性,可對骨吸收產生抑制,且對骨形成過程造成的影響較小,進而提高患者BMD水平及骨強度,增加骨量,降低病理性骨折風險[13]。
惡性腫瘤椎體轉移可引發骨代謝紊亂,引發椎體壓縮、病理性骨折、骨痛等并發癥,嚴重者對脊髓產生壓迫,損傷神經功能,造成肢體癱瘓。有研究指出,椎體轉移病灶中骨代謝的特征主要是骨質的破壞和再生,即溶骨、成骨同時進行,而成骨、破骨細胞活性改變可引發血清中多種骨轉化標志分子水平變化[14-15]。β-CTX是Ⅰ型膠原纖維在骨吸收過程的降解產物;NTX是Ⅰ型膠原纖維分子間交聯物質,在骨吸收過程中,NTX的水平會升高;OC是非膠原蛋白的一種,由成骨細胞分泌,與細胞外骨基質的形成密切相關,可客觀反映骨形成程度[16]。AKP是成骨細胞的1種外酶,在人體骨骼組織中廣泛存在,在佝僂病、骨質疏松、骨軟化癥等疾病中均表現較高水平,因此,臨床常將AKP水平作為骨骼疾病的鑒別診斷指標之一[17]。本研究結果顯示,治療后研究組血清OC、β-CTX、NTX、AKP水平均顯著低于對照組,提示唑來膦酸聯合化療可改善骨代謝。究其原因在于,唑來膦酸可對破骨細胞直接作用,改變其細胞形態,對其活性、形成及分化產生抑制作用,并可結合磷灰石等骨基質,對骨吸收產生干擾;同時可對成骨細胞介導的炎癥因子釋放產生抑制,減少AKP外流,進而改善骨組織代謝水平[18]。另外,本研究結果顯示,研究組治療后血清Ca2+水平顯著低于對照組,提示唑來膦酸可抑制惡性腫瘤椎體轉移患者骨細胞產生骨溶解,降低高血鈣癥發生風險;但研究組高血鈣癥發生率僅略低于對照組,可能與本研究樣本數量過少、觀察時間過短等因素有關,仍需擴大樣本數量、延長觀察時間進一步對照研究。
綜上所述,唑來膦酸聯合化療治療惡性腫瘤椎體轉移伴病理性骨折高風險患者可有效緩解疼痛,提高臨床療效,且可改善骨代謝,提高骨密度,降低病理性骨折風險,值得臨床推廣。

