近紅外光譜技術對有血流動力學意義的動脈導管未閉早產兒腸道組織氧飽和度監測價值的前瞻性研究
黃循斌 鐘曉 劉婷 程國強 丘惠嫻
(1.深圳市龍崗中心醫院新生兒科,廣東深圳 518116;2.復旦大學附屬兒科醫院新生兒科,上海 201102)
動脈導管未閉(patent ductus arteriosus,PDA)是早產兒常見的心臟異常,胎齡(gestational age,GA)越小,出生體重(birth weight,BW)越低,其發生率越高[1]。PDA發生率在GA<32周的早產兒中約30%,在極低出生體重兒中約25%,在超低出生體重兒中高達40%~60%[2]。當動脈導管(ductus arteriosus,DA)左向右分流量增加,超過體循環的50%時,可出現肺血流增多,體循環血流減少,引起體循環各臟器灌注減少,出現顯著的血流動力學變化,稱為有血流動力學意義的PDA(hemodynamically significant patent ductus arteriosus,hsPDA)[3-5]。極低出生體重兒由于腸道功能發育不成熟,腸道血流自主調節功能差,血流動力學變化明顯時易導致潛在的腸道缺血缺氧[6-7]。超聲是目前檢測脈管血流灌注的常用技術,但不能連續監測,亦不能及時反映組織氧供應和消耗情況。近紅外光譜技術(near‐infrared spectroscopy,NIRS)是一種無創、實時性地監測局部組織氧飽和度(regional oxygen saturation,rSO2)的技術,可連續監測組織灌注及微循環功能,同時監測局部組織氧合情況[8]。目前,尚未有前瞻性研究hsPDA對早產兒腸道組織氧合的影響。本研究利用NIRS持續監測hsPDA早產兒腸道組織rSO2在診斷后及治療后隨時間的變化趨勢,初步探索NIRS技術行腸道組織rSO2監測在指導臨床治療hsPDA及預防腸道損傷中的作用。
1 資料與方法
1.1 研究對象
選擇2017年10月至2020年10月在深圳市龍崗中心醫院新生兒科住院的PDA早產兒為研究對象。納入標準:(1)GA<32周和/或BW<1 500 g;(2)日齡3~14 d;(3)研究對象父母知情同意加入本研究。排除標準:(1)喂養不耐受或壞死性小腸結腸炎者;(2)敗血癥者;(3)重度以上貧血(血紅蛋白<90 g/L)或48 h內有輸血史者;(4)宮內生長受限者和小于胎齡兒;(5)先天性疾病者(染色體異常、胃腸道先天性畸形、引起血流動力學不穩的心臟疾病、腹疝等)。
本研究通過深圳市龍崗中心醫院醫學倫理委員會批準(批準文號:2017ECYJ079),并獲得患兒監護人知情同意。
1.2 診斷標準
hsPDA的診斷標準是指符合以下6項臨床表現中的3項及3項超聲心動圖標準[9]。6項臨床表現:(1)胸骨左緣聞及收縮期或連續性雜音;(2)心前區搏動增強;(3)水沖脈;(4)安靜時心率>180次/min;(5)無法解釋的呼吸狀況惡化;(6)胸片顯示肺血管影增多及心臟擴大,或肺水腫征象。3項超聲心動圖診斷標準:(1)DA直徑≥1.5 mm;(2)左心房內徑/主動脈根部內徑(left atrial/aortic root diameter,LA/AO)≥1.5;(3)降主動脈舒張期血流倒置。
1.3 治療方案
hsPDA早產兒在腸道組織rSO2下降趨于穩定時給予口服布洛芬混懸滴劑(規格:15 mL∶0.6 g,批號:190413198,上海強生制藥有限公司)。劑量:首劑10 mg/kg,第2、3劑5 mg/kg,每次間隔24 h,療程3 d。
1.4 分組
根據hsPDA的診斷標準將PDA早產兒分為hsPDA組和無血流動力學意義的動脈導管未閉(non‐hemodynamically significantpatentductusarteriosus,nhsPDA)組。將hsPDA組早產兒根據布洛芬治療后動脈導管關閉情況分為hsPDA關閉亞組和hsPDA未閉亞組。
1.5 NIRS監測
采用蘇州愛琴生物醫療電子有限公司EGOS‐600A近紅外光譜監測儀,獲《中華人民共和國醫療器械注冊證》(注冊證編號:蘇械注準20142210631)。工作原理為利用波長700~900 nm的近紅外光對人體組織有良好的穿透性,而人體組織對該段光的吸收主要源于微細血管血液中還原血紅蛋白和氧合血紅蛋白兩種吸收體,利用兩者吸收譜的差異,通過修正的雙波長朗伯-比爾定律,可求出組織中血紅蛋白濃度隨時間的變化量,從而得到rSO2,反映局部組織氧合情況[10]。監測方法:患兒取仰臥位,腸道組織rSO2測量時將B型探頭(探測深度1~1.5 cm)放置在新生兒腹中線,臍下0.5~1 cm位置,用3M透明敷料固定避免漏光。NIRS監測儀每2 s采集1次腸道組織rSO2數據,數值相對穩定(波動不超過2%)保持5 min左右,取雙側平均值,重復上述過程3次,取3次的平均值作為測量當時患兒的腸道組織rSO2。
1.6 血流動力學指標測定
選用飛利浦IE33多功能超聲診斷儀,以及配套的心臟超聲探頭。對入組早產兒在出生后3~7 d,每間隔24 h進行床旁超聲心動圖檢查,若存在動脈導管開放,同時監測其血流動力學指標。對hsPDA組患兒口服布洛芬治療結束24 h后復查超聲心動圖,同時監測其血流動力學指標。血流動力學指標包括導管底部最窄處測量DA直徑、LA/AO、舒張期降主動脈血流量、左室射血分數(left ventricular ejection fraction,LVEF)、短軸縮短率(fractional shortening,FS),上述指標均進行5個心動周期的測量,并對測量結果取平均值。
1.7 統計學分析
采用SPSS22.0統計軟件進行數據分析。符合正態分布的計量資料以均數±標準差(±s)表示,組間比較采用兩樣本t檢驗;偏態分布的計量資料以中位數(范圍)表示,組間比較采用Mann‐WhitneyU秩和檢驗;計數資料以例數和百分率(%)表示,組間比較采用χ2檢驗。對重復測量的計量資料采用重復測量設計資料的方差分析,不符合球形分布假設時采用Greenhouse‐Geisser方法進行校正,對于存在交互效應的結果進行單獨效應檢驗,組間兩兩比較采用Bonferroni法,取校正后P值。P<0.05為差異有統計學意義。
2 結果
2.1 患兒基本信息
符合納入標準的病例共268例,其中18例患兒出生7 d內放棄治療,9例資料不全,被剔除出研究組,最終241例PDA早產兒納入研究組。241例PDA早產兒的GA和BW分布情況如下:GA<26周13例(5.4%),26~27+6周29例(12.0%),28~29+6周66例(27.4%),30~31+6周133例(55.2%);BW<750 g 18例 (7.5%),750~<1 000 g 31例(12.9%),1 000~<1 250 g 69例(28.6%),1 250~<1 500 g 123例(51.0%)。hsPDA組55例,nhsPDA組186例,2組患兒GA、BW、性別、機械通氣、1 min和5 min Agpar評分比較,差異均無統計學意義(P>0.05),見表1。
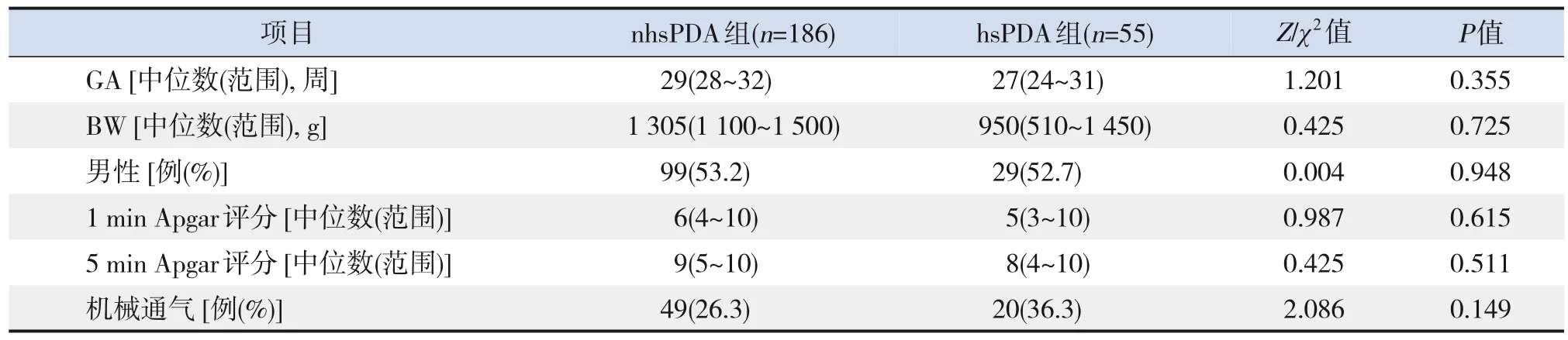
表1 hsPDA組與nhsPDA組早產兒的基本情況比較
2.2 hsPDA組與nhsPDA組早產兒血流動力學指標比較
hsPDA組LA/AO值和DA直徑均大于nhsPDA組(P<0.001),hsPDA組LVEF值和FS值均低于nhsPDA組(P<0.001),見表2。
表2 hsPDA組與nhsPDA組早產兒在診斷時血流動力學指標比較 (-±s)
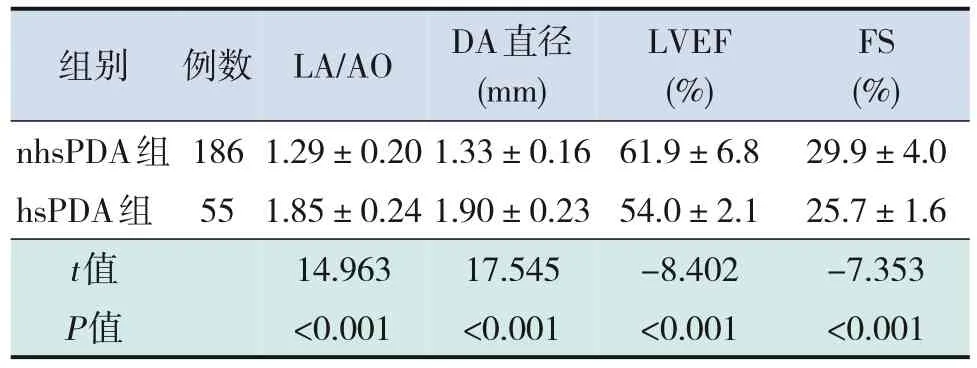
表2 hsPDA組與nhsPDA組早產兒在診斷時血流動力學指標比較 (-±s)
注:[hsPDA]有血流動力學意義的動脈導管未閉;[nhsPDA]無血流動力學意義的動脈導管未閉;[LA/AO]左心房內徑/主動脈根部內徑;[DA]動脈導管;[LVEF]左室射血分數;[FS]短軸縮短率。
組別 例數LA/AODA直徑LVEFFS(mm)(%)(%)nhsPDA組1861.29±0.201.33±0.1661.9±6.829.9±4.0 hsPDA組551.85±0.241.90±0.2354.0±2.125.7±1.6 t值14.96317.545-8.402-7.353 P值<0.001<0.001<0.001<0.001
2.3 hsPDA組與nhsPDA組早產兒腸道組織rSO2的動態變化
采用重復測量設計資料的方差分析比較兩組早產兒腸道組織rSO2隨時間的變化趨勢。數據不符合球形分布(P<0.001),采用Greenhouse‐Geisser方法進行校正。結果顯示,不同組間不同時點腸道組織rSO2差異有統計學意義(組間效應:F=324.345,P<0.001;時間效應:F=37.531,P<0.001),時間和組間存在交互作用(F=67.623,P<0.001)。
hsPDA組早產兒腸道組織rSO2在診斷后1、2、4、6 h均低于nhsPDA組,差異均有統計學意義(均P<0.001),見表3。
hsPDA組早產兒腸道組織rSO2隨時間呈下降趨勢,至6 h時達最低值,其隨時間變化差異有統計學意義(F=45.003,P<0.001)。兩兩比較結果顯示診斷后2、4、6 h的rSO2均低于診斷后1 h(P<0.001),其他時間點間比較差異無統計學意義(P>0.05)。見表3。
nhsPDA組早產兒腸道組織rSO2隨時間變化不明顯(F=0.599,P=0.616),見表3。
表3 兩組早產兒在診斷后不同時間腸道組織rSO的變化 (-±s)2
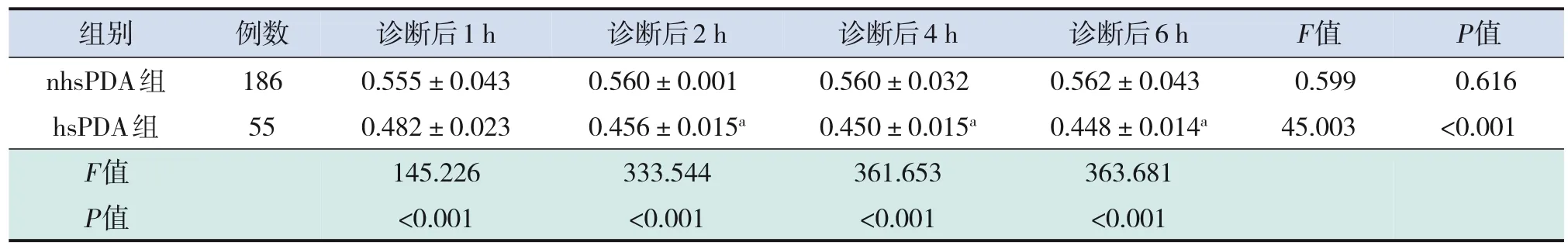
表3 兩組早產兒在診斷后不同時間腸道組織rSO的變化 (-±s)2
注:a示與診斷后1 h比較,P<0.05。[hsPDA]有血流動力學意義的動脈導管未閉;[nhsPDA]無血流動力學意義的動脈導管未閉。
組別 例數 診斷后1 h診斷后2 h診斷后4 h診斷后6 hF值P值nhsPDA組1860.555±0.0430.560±0.0010.560±0.0320.562±0.0430.5990.616 hsPDA組550.482±0.0230.456±0.015a0.450±0.015a0.448±0.014a45.003<0.001 F值145.226333.544361.653363.681 P值<0.001<0.001<0.001<0.001
2.4 hsPDA關閉亞組和hsPDA未閉亞組早產兒血流動力學指標比較
hsPDA關閉亞組LA/AO值、LVEF值和FS值均恢復正常,與hsPDA未閉亞組各指標比較差異均有統計學意義(P<0.001),見表4。
表4 hsPDA關閉亞組與hsPDA未閉亞組早產兒血流動力學指標比較 (-±s)
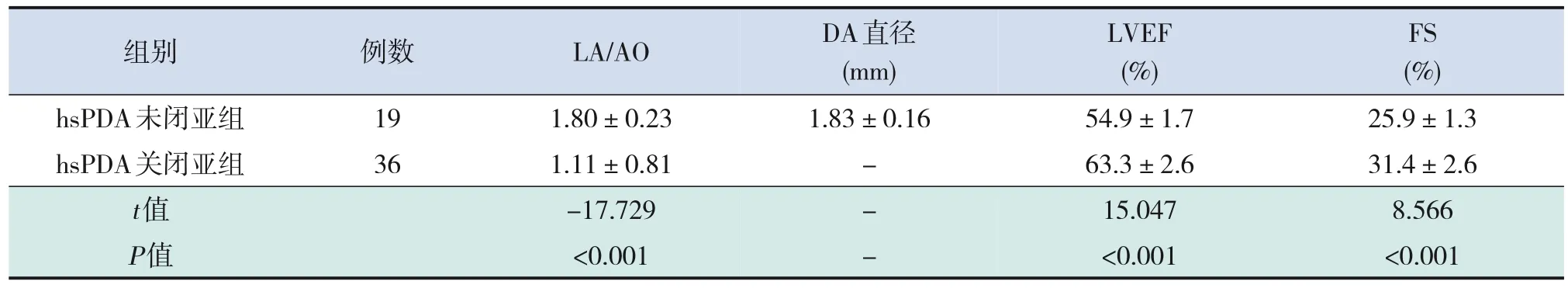
表4 hsPDA關閉亞組與hsPDA未閉亞組早產兒血流動力學指標比較 (-±s)
注:[hsPDA]有血流動力學意義的動脈導管未閉;[LA/AO]左心房內徑/主動脈根部內徑;[DA]動脈導管;[LVEF]左室射血分數;[FS]短軸縮短率。
組別 例數LA/AODA直徑LVEFFS(mm)(%)(%)hsPDA未閉亞組191.80±0.231.83±0.1654.9±1.725.9±1.3 hsPDA關閉亞組361.11±0.81-63.3±2.631.4±2.6 t值-17.729-15.0478.566 P值<0.001-<0.001<0.001
2.5 hsPDA關閉亞組和hsPDA未閉亞組早產兒腸道組織rSO2的動態變化
采用重復測量方差分析兩亞組早產兒腸道組織rSO2隨時間的變化趨勢。數據不符合球形分布(P<0.001),采用Greenhouse‐Geisser法進行校正。結果顯示,不同組間不同時點腸道組織rSO2差異有統計學意義(組間效應:F=118.095,P<0.001;時間效應:F=147.452,P<0.001);時間和組間存在交互作用(F=38.543,P<0.001)。
hsPDA關閉亞組早產兒腸道組織rSO2在治療后48、72、96 h均高于hsPDA未閉亞組,差異均有統計學意義(P<0.001);在治療時和治療后24 h,兩組間的腸道組織rSO2差異均無統計學意義(P>0.05)。見表5。
hsPDA關閉亞組早產兒腸道組織rSO2從治療24 h后隨時間呈上升趨勢,至96 h達最高值,其隨時間變化差異有統計學意義(P<0.001)。兩兩比較結果顯示,除了治療時和治療后24 h,治療后72 h和96 h間腸道組織rSO2差異無統計學意義(分別P=1.000、0.510)外,其他時間點兩兩間差異均存在統計學意義(P<0.001)。見表5。
hsPDA未閉亞組早產兒腸道組織rSO2不同時間點間差異具有統計學意義(F=19.865,P<0.001)。兩兩比較顯示,治療后72 h和96 h的腸道組織rSO2值高于其他時間點(P<0.001),其他時間點兩兩比較差異無統計學意義(P>0.05)。見表5。
表5 hsPDA關閉亞組和hsPDA未閉亞組早產兒腸道組織rSO的變化 (-±s)2
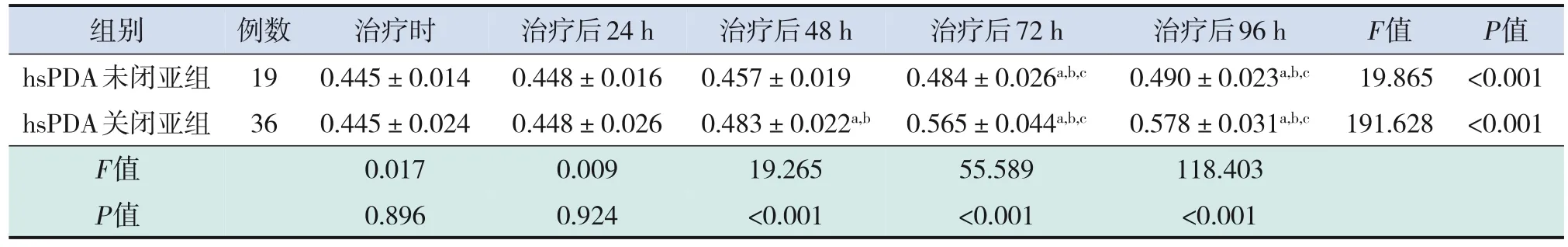
表5 hsPDA關閉亞組和hsPDA未閉亞組早產兒腸道組織rSO的變化 (-±s)2
注:a示與治療時比較,P<0.05;b示與治療后24 h組比較,P<0.05;c示與治療后48 h組比較,P<0.05。[hsPDA]有血流動力學意義的動脈導管未閉。
組別 例數 治療時 治療后24 h治療后48 h治療后72 h治療后96 hF值P值hsPDA未閉亞組190.445±0.0140.448±0.0160.457±0.0190.484±0.026a,b,c0.490±0.023a,b,c19.865<0.001 hsPDA關閉亞組360.445±0.0240.448±0.0260.483±0.022a,b0.565±0.044a,b,c0.578±0.031a,b,c191.628<0.001 F值0.0170.00919.26555.589118.403 P值0.8960.924<0.001<0.001<0.001
3 討論
hsPDA的左向右持續分流量較大,體循環血流量減少,引起各臟器灌注減少,早產兒重要器官(如顱腦、胃腸道、腎臟等)對低灌注敏感,常導致這些重要器官缺血缺氧性損傷[11]。Kim等[12]研究發現PDA早產兒的腸系膜上動脈(superior mesenteric artery,SMA)血流灌注量低于無PDA的早產兒。符俊娟等[13]通過超聲心動圖檢測hsPDA早產兒血流動力學指標,發現hsPDA組早產兒的DA直徑和LA/AO值均大于nhsPDA組,LVEF值低于nhsPDA組。本研究中,hsPDA組早產兒DA直徑和LA/AO值均大于nhsPDA組,LVEF值和FS值均低于nhsPDA組。其原因可能是早期早產兒、極低出生體重兒左心室心肌發育不成熟,心臟代償功能有限,左心容量負荷增加時,易發生充血性心力衰竭,出現心排出量減少時,體內血液出現重新分配,肺、腎、胃腸道等器官受損。
早產兒腸道黏膜代謝率高,接受約80%的腸道血流量,當hsPDA患兒出現心排出量減少時,腹主動脈血流減少,SMA血流灌注障礙,腸道黏膜因缺血損傷,嚴重者可導致新生兒壞死性小腸結腸炎(necrotizing enterocolitis,NEC)甚至穿孔[14]。早期早產兒、極低出生體重兒腸道血流自主調節能力差,圍生期體循環低灌注時,進一步削弱腸道組織攜氧能力,引起腸道組織可利用氧減少,導致潛在的腸道缺血,易促進NEC發生[15-16]。目前NEC發病隱匿,病情進展迅速,病死率高,早期診斷和干預尤為重要。NIRS能無創、實時地監測rSO2,反映局部灌注情況,可能是一種能用于評估NEC發生風險的技術[17]。Zabaneh等[18]應用NIRS分別測定NEC和無NEC雙胎早產兒的腸道組織rSO2,發現NEC早產兒腸道組織rSO2明顯低于無NEC早產兒。本研究利用NIRS持續監測hsPDA早產兒腸道組織rSO2在診斷后及經過布洛芬治療后隨時間的變化趨勢,初步評估了利用NIRS持續監測腸道組織rSO2對hsPDA早產兒腸道損傷及指導臨床治療的作用。
Gillam‐Krakauer等[19]應用NIRS連續3 d監測18例GA 25~31周早產兒的腹部rSO2,將喂養前10 min和喂養后60~120 min腹部rSO2值與多普勒顯示的SMA血流速度變化進行了比較,發現腹部rSO2的變化與SMA速度的變化顯著相關。Patel等[20]利用NIRS監測美國2家醫院2007年1月至2008年11月出生的100例GA<32周、BW<1 500 g的早產兒腸道組織rSO2發現:患有PDA的早產兒腸道組織rSO2顯著低于無PDA的早產兒;NEC組腸道組織rSO2明顯低于非NEC組。本研究利用NIRS持續監測PDA早產兒腸道組織rSO2的變化,發現hsPDA組早產兒腸道組織rSO2在診斷后6 h內各時間點(1、2、4、6 h)均低于nhsPDA組;hsPDA組早產兒腸道組織rSO2隨時間呈下降趨勢,至6 h時達最低值。這一結論與Patel等[20]研究結果相似,研究結果提示hsPDA早產兒在診斷后6 h內即存在腸道組織灌注不足及氧合障礙,建議利用NIRS持續監測hsPDA早產兒腸道組織rSO2,若發現腸道組織rSO2出現下降趨勢時應予以干預和治療,改善腸道缺血,避免進展為NEC。
目前國際上早產兒PDA的治療主要是針對hsPDA[21]。因為hsPDA的左向右持續分流量較大,可導致肺出血、充血性心力衰竭、顱內出血、NEC等并發癥,嚴重時危及生命[22]。姚芒等[23]研究表明,hsPDA早產兒口服布洛芬治療可以明顯降低其LA/AO值,提高LVEF值,促進DA閉合。本研究中,hsPDA組早產兒給予布洛芬口服治療24 h后腸道組織rSO2隨時間呈上升趨勢,hsPDA關閉亞組患兒腸道組織rSO2在治療后48~96 h內各時間點(48、72、96 h)均高hsPDA未閉亞組,至96 h時腸道組織rSO2處于最高值;hsPDA關閉亞組早產兒LA/AO值、LVEF值和FS值均恢復正常。本研究結果顯示,GA<32周和/或BW<1 500 g的hsPDA早產兒給予布洛芬口服治療3 d后,約65%患兒DA關閉,藥物起效時間在給藥24 h后,有效者腸道組織rSO2持續上升,至治療后96 h達最高值;效果差者腸道組織rSO2隨時間上升趨勢不明顯。因此,我們認為hsPDA早產兒經過布洛芬治療后行NIRS監測顯示持續的腸道組織rSO2上升,預示著DA閉合可能,可用于指導治療。
綜上所述,本研究表明利用NIRS持續監測hsPDA早產兒腸道組織rSO2,當出現持續下降趨勢時,提示存在腸道組織氧合障礙,此時需要積極干預和治療,促使DA關閉,以穩定腸道血流,減少腸道組織損傷。因此,可通過NIRS持續監測hsPDA早產兒腸道組織rSO2變化趨勢來指導臨床管理。本研究仍存在一些不足之處,作為單中心前瞻性隊列研究,樣本量不是很大,為獲得更具有說服力的結論,需進行多中心大樣本研究。

