縫隙連接阻斷劑對大鼠癲癇后海馬漣波振蕩能量變化的影響
易妍君 冉曉 向敬 李昕陽 蔣莉 陳恒勝 胡越
(1.重慶醫科大學兒童醫院神經內科/兒童發育疾病研究教育部重點實驗室/國家兒童健康與疾病臨床醫學研究中心/兒童發育重大疾病國家國際科技合作基地/兒科學重慶市重點實驗室,重慶 400136;2.美國辛辛那提兒童醫院腦磁圖中心,俄亥俄州辛辛那提 45229;3.北京師范大學-香港浸會大學聯合國際學院理工科技學部,廣東珠海 519087)
神經網絡中存在廣泛的高頻振蕩(high‐frequency oscillations,HFOs)。HFOs是指頻率在40~500 Hz的腦電活動,包括γ振蕩(40~80 Hz)、漣波(ripple)振蕩(80~200 Hz)、快速漣波(fast ripples,FRs)振蕩(250~500 Hz)。生理狀態下,HFOs與感官信息處理、海馬記憶功能有關[1];而病理性HFOs與癲癇密切相關[2]。
目前HFOs的產生機制還不完全清楚。ripple可能是由γ‐氨基丁酸受體介導的興奮性神經元產生的抑制性突觸后電位同步化形成[3]。FRs可能是由于具有病理性連接的興奮性神經元短暫、高度同步化、突發式放電形成的場電位[3]。我們之前的研究已經證實發作期FRs的平均能量和最大能量可以作為癲癇發作早期預警的定量指標[4-5]。但FRs對腦電圖儀器要求高,數據采集困難,臨床應用受限。那么ripple是否具有與FRs相似的敏感性和特異性,從而應用于癲癇的臨床研究?這為降低HFOs分析難度,使其未來作為癲癇診療的常規手段提供依據。
本研究選擇癲癇持續狀態(status epilepticus,SE)成年大鼠模型為研究對象,通過對比不同縫隙連接(gap junction,GJ)阻斷劑奎寧(quinine,QUIN)、甘珀酸(carbenoxolone,CBX)與一線抗癲癇藥物丙戊酸(valproate sodium,VPA)對癲癇活動及海馬ripple能量的動態影響,闡明ripple能量分析是否具有與FRs類似的對癲癇發作的預測價值,明確GJ是否對癲癇的發生發展起關鍵作用,從而為針對性選擇抗癲癇治療的新靶點提供理論依據。
1 材料與方法
1.1 癲癇模型的建立與腦電記錄
選用24只清潔級Sprague‐Dawley成年大鼠(購自重慶醫科大學動物中心),體重(200±20)g。術前腹腔注射青霉素1 mL(16萬單位/mL)預防感染,10%水合氯醛(3 mL/kg)鎮靜后,采用大鼠腦立體定位儀(深圳瑞沃德生命科技公司)定位插入顱內電極[6],記錄位置包括雙側海馬CA1區、CA3區、齒狀回,以雙側頂葉硬膜下作為參考電極,左側前額硬膜下作為地線。
術后第3天開始描記正常深部腦電信號,連續5 d(5~8 h/d),術后第9天建立氯化鋰-匹羅卡品(pilocarpine,PILO)SE模型[7]。建模成功后,每天記錄大鼠腦電信號5~8 h至SE后3 d。采樣頻率1 kHz,高通0.16 Hz,低通500 Hz。
24只大鼠隨機分為4組(n=6)。每只大鼠腹腔注射氯化鋰127 mg/kg,18~20 h后腹腔注射PILO。在癲癇發作1 h時腹腔注射水合氯醛。除模型組外,VPA組、QUIN組和CBX組需在注射PILO前3 d行預處理。VPA組:VPA 200 mg/kg,每天2次,連續灌胃3 d;QUIN組:QUIN 50 mg/kg,每天2次,連續腹腔注射3 d;CBX組:CBX 50 mg/kg,每天2次,連續腹腔注射3 d。實驗過程中如出現動物死亡則替補新的實驗大鼠入組。
1.2 腦電圖分析
采集建模前1 d,PILO注射后10、20、30、40、50、60、70、80 min,推注水合氯醛(止癇)前后及止癇后1、2、3 h,SE后1 d、SE后3 d,共16個時間點各10 min的原始腦電圖。
對以上各時間點采集的10 min腦電信號分別進行HFOs信號定量分析。本研究采用Morlet小波算法[8],提取ripple(80~200 Hz)腦電信號,包括平均能量分析和最大能量分析。
ripple振蕩平均能量是指整個觀察時間窗口的所有能量平均;ripple振蕩最大能量是指整個觀察時間窗口內某一時間點的能量,為該觀察時間窗口的最高能量[9]。
定義ripple振蕩能量波動最大的導聯為責任導聯[5]。
1.3 統計學分析
采用SPSS23.0統計軟件對實驗數據進行統計學分析。計量資料采用均數±標準差(±s)表示,多組或多時間點數據比較采用單因素方差分析,組間兩兩比較采用LSD‐t法。P<0.05為差異有統計學意義。
2 結果
2.1 ripple振蕩能量定量分析
24只大鼠成功建立模型。造模前,正常大鼠海馬CA1、CA3區及齒狀回均可見ripple振蕩表達。VPA組、QUIN組和CBX組,均以CA1和CA3區ripple振蕩能量波動最大(n=6),模型組中,4只以CA1和CA3區ripple振蕩能量波動最大,2只以齒狀回區ripple振蕩能量波動最大。進一步對ripple振蕩平均能量及最大能量進行統計分析,結果見表1~2和圖1~2。
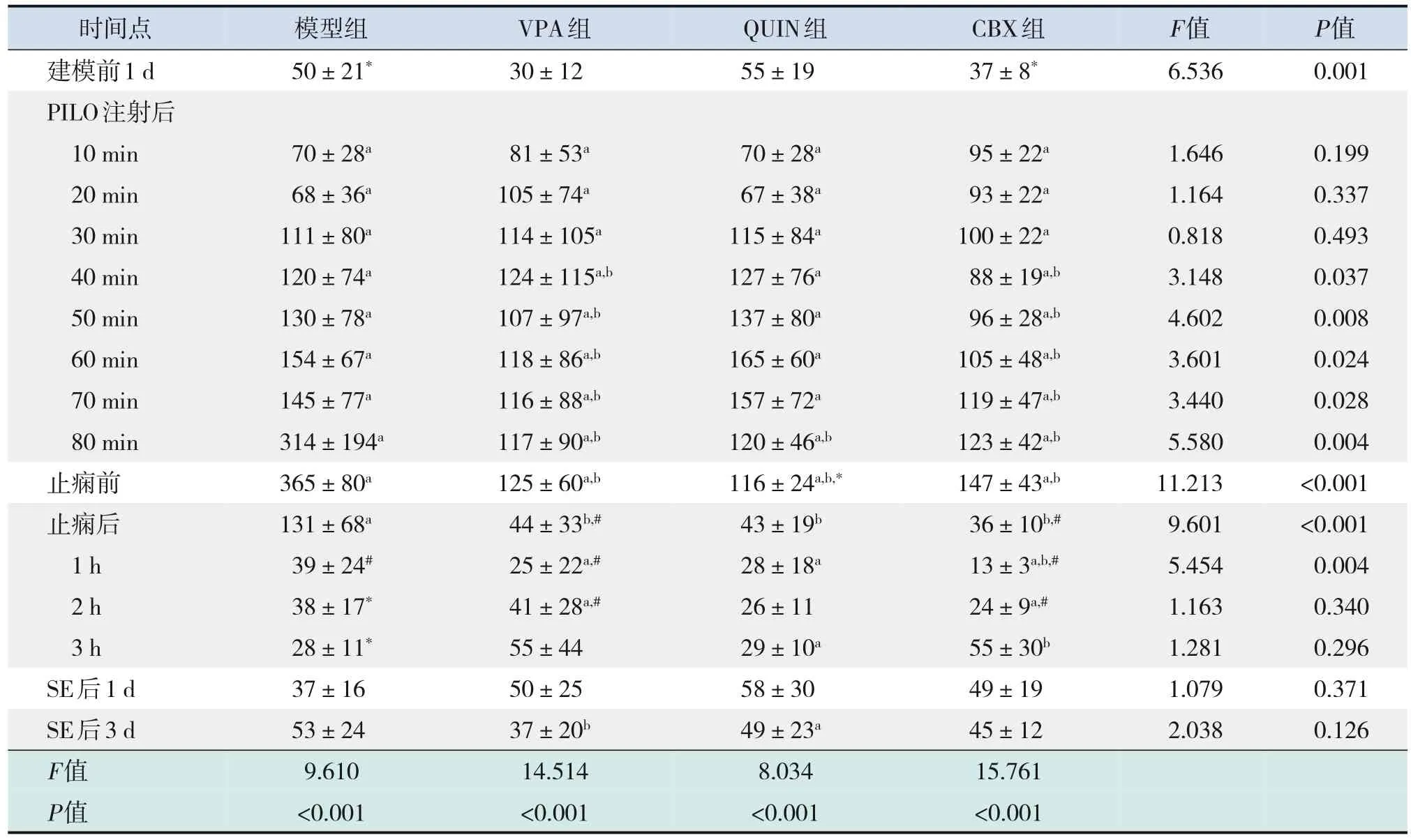
表1 癲癇發作前后各組ripple振蕩平均能量的動態變化 (n=6)
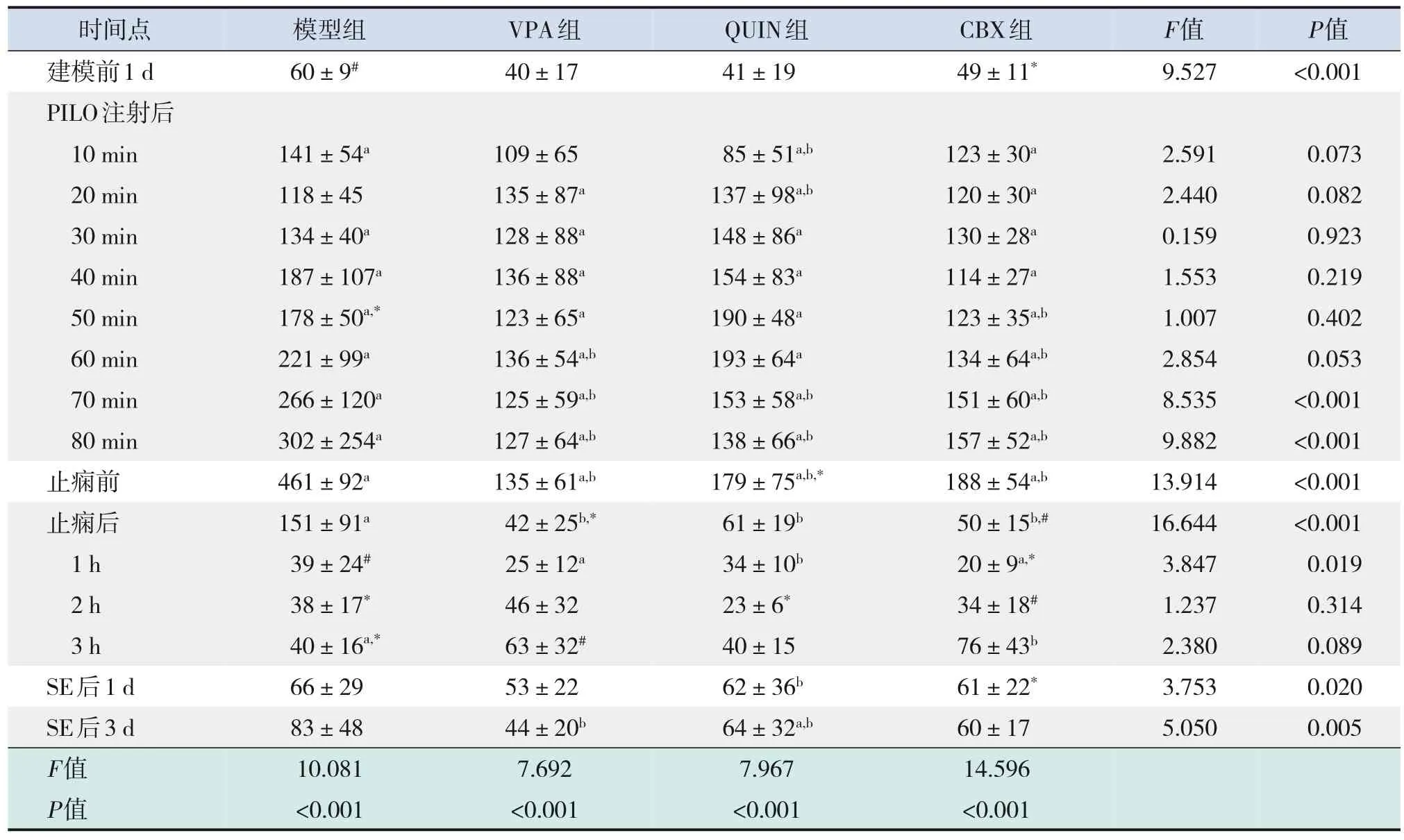
表2 癲癇發作前后各組ripple振蕩最大能量的動態變化 (n=6)
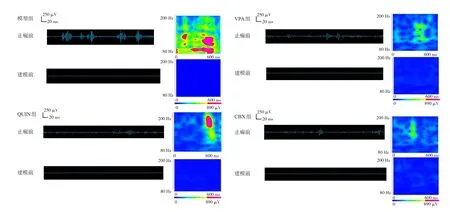
圖1 各組癲癇前后CA1區ripple振蕩能量和時間特性 左側波形圖采用80~200 Hz的帶通濾波器進行濾波。右側頻譜圖反映了相應波形的累積時頻。以上數據證明癲癇發作伴隨ripple振蕩能量的增加,而VPA、QUIN和CBX進行預處理可以降低ripple振蕩能量并減輕癲癇發作的程度。ripple振蕩的特征是節律性爆發,與系統偽跡(如電源噪聲及其諧波)不同。
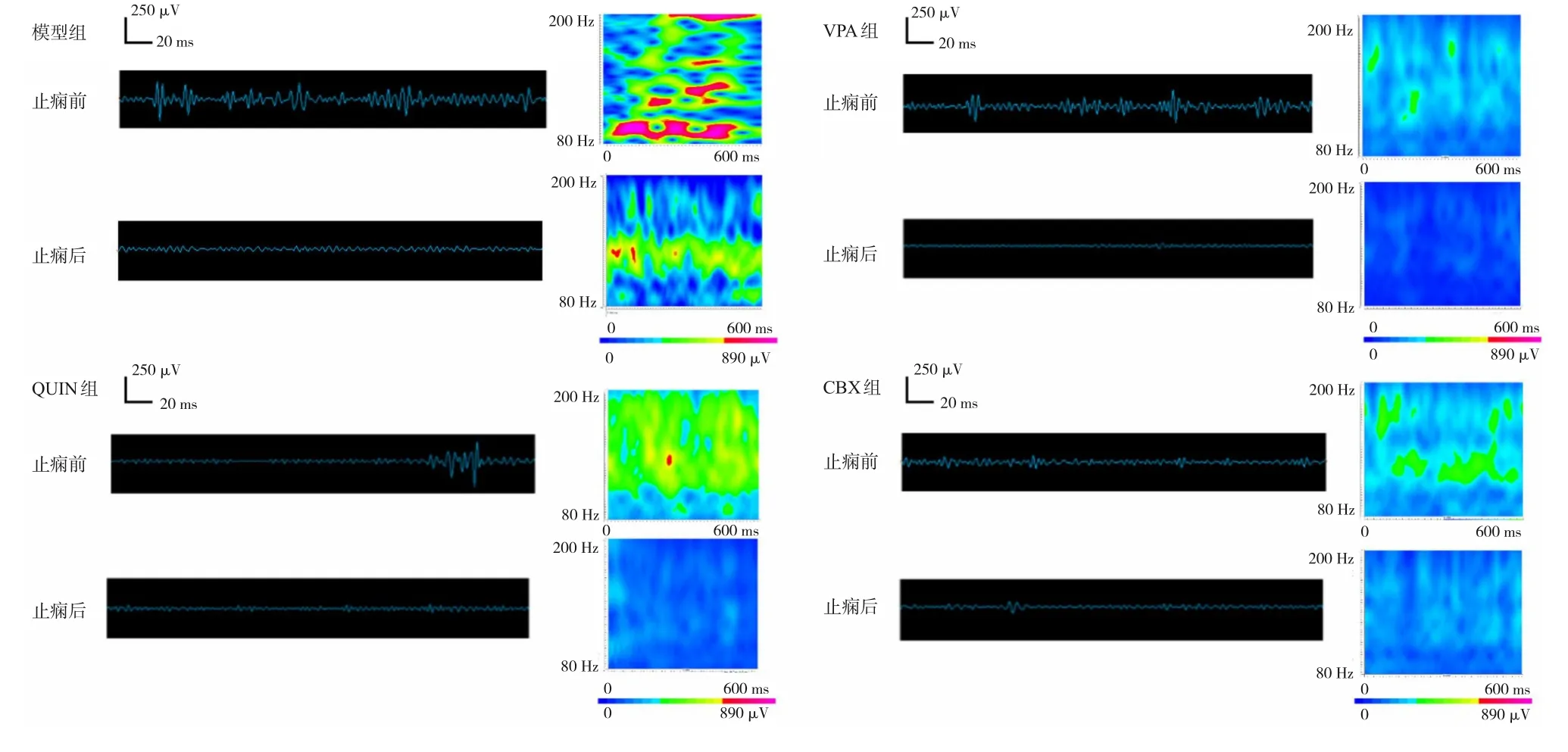
圖2 各組止癇前后CA1區ripple振蕩能量和時間特性 左側波形圖采用80~200 Hz的帶通濾波器進行濾波;右側頻譜圖反映了相應波形的累積時頻。結果表明,癲癇終止伴隨ripple振蕩能量的下降,而VPA、QUIN和CBX進行預處理可以降低ripple振蕩能量,并減輕癲癇發作的程度。ripple振蕩的特征是節律性爆發,與系統偽跡(如電源噪聲及其諧波)不同。
注射PILO后,各實驗組ripple振蕩平均能量逐漸增強,模型組、VPA組和CBX組在止癇前達到最高峰,QUIN組在PILO注射后60 min達到最高峰,與建模前1 d相比,差異均有統計學意義(P<0.05)。止癇后,VPA組、QUIN組、CBX組ripple振蕩平均能量恢復至建模前1 d水平(P>0.05);模型組在止癇后1 h ripple振蕩平均能量降至建模前1 d水平(P>0.05);且各組均持續正常水平至SE后3 d。CBX組與VPA組在注射PILO后40 min,QUIN組在注射PILO后80 min開始,ripple振蕩平均能量明顯低于模型組(P<0.05),并持續至止癇后1 h。
ripple振蕩最大能量的變化趨勢與ripple振蕩平均能量的變化趨勢類似。
3 討論
相對常頻腦電信號,HFOs信號更為微弱,波幅低且持續時間短[10],傳統時域分析或頻域分析均不能準確表達HFOs的特征。隨著對HFOs研究的深入,HFOs的采集技術、自動檢測技術及新的分析與量化算法正得到快速的發展[11]。時頻分析法中的小波變換是近20年來新發展起來的信號分析理論[12],其在信號奇異性檢測、時變濾波、模式識別等信號分析和處理方面具有廣泛的應用。小波變換中的Morlet小波具有良好的時間分辨率,可實現HFOs在癲癇腦組織中的定量分析[8]。
既往有報道顯示[13],海馬區生理性HFOs多為ripple。本研究顯示,ripple和FRs可以同時出現在正常或癲癇海馬組織中,兩種狀態下的主要區別在于ripple表達能量不同。因此,我們認為HFOs的頻率并非區分生理和病理狀態的必要條件。PILO注射后10 min,即使此時各組均未誘導出Ⅳ級癇性發作,ripple振蕩平均能量仍較發作前相比明顯增加,止癇后,ripple振蕩平均能量迅速下降。對ripple最大能量進行分析,得出類似的結果。這說明ripple能量變化與癲癇發作的狀態吻合[14]。顳葉癲癇患者中,HFOs產生區與器質性腦損害區一致[15],多發生在CA1、CA3、齒狀回區[16]。本研究顯示:ripple平均/最大能量變化在雙側海馬呈非對稱性,同側海馬不同區域其平均/最大能量變化也并非完全一致。癲癇大鼠責任導聯集中在CA1、CA3、齒狀回區。因此,責任導聯所在區域可能與致癇灶密切相關。ripple平均/最大能量變化可較好地反映腦功能狀態的變化,二者適用于癲癇預測或腦功能狀態的檢測。
增強的細胞間GJ通訊可能參與癲癇產生[17]。CBX是廣譜GJ阻斷劑,通過改變GJ通道蛋白構象,從而關閉GJ通道[18]。體內和體外實驗均證實了CBX具有抗癲癇作用[19],但由于類鹽皮質激素的不良反應而使其應用受限。QUIN選擇性阻斷CX36和CX50介導的細胞間GJ,具有劑量依賴性,低劑量有抗癲癇作用,而高劑量具有神經毒性[20]。VPA可誘導CX43及CX26的表達[21]。本研究發現,GJ阻斷劑包括CBX和QUIN,均可阻斷ripple振蕩,減輕癲癇發作程度,與一線抗癲癇藥物VPA具有類似的抗癲癇作用。止癇后10 min,3個干預組ripple振蕩平均及最大能量均恢復至正常水平,并持續至SE后3 d,提示GJ阻斷劑及VPA,對發作間期HFOs無明顯影響。盡管近20年有多種新型抗癲癇藥物應用于臨床,卻并未改變癲癇治療原則,降低難治性癲癇發生率。因此,進一步探索抗癲癇藥物的不同類型作用靶點,針對性阻斷GJ的作用靶點,減少病理性HFOs形成,具有重要的臨床意義。

