原發性腎病綜合征患兒脂肪因子的表達及與高脂血癥相關性研究
張如心 張瑄 張碧麗 劉竹楓 林書祥
(1.天津市兒童醫院腎內科,天津 300074;2.天津醫科大學研究生院,天津 300070;3.天津市兒科研究所/天津市兒童出生缺陷防治重點實驗室,天津 300074)
原發性腎病綜合征(primary nephrotic syndrome,PNS)是兒童最常見的腎小球疾病之一,兒童的患病率約為(2~7)/10萬[1]。腎病綜合征以大量蛋白尿、低白蛋白血癥、水腫、高脂血癥為主要表現,腎病綜合征的高脂血癥主要以三酰甘油 (triglyceride,TG)、總膽固醇 (total cholesterol,TC)、 低 密 度 脂 蛋 白 (low‐density lipoprotein,LDL)、極低密度脂蛋白(very low‐density lipoprotein,VLDL)、脂蛋白A、載脂蛋白A(apolipoprotein A,apoA)、載脂蛋白B(apolipo‐protein B,apoB)升高為主,激素治療尿蛋白轉陰后,血脂水平會恢復正常。腎病綜合征患者持續的血脂異常與蛋白尿的嚴重程度直接相關,腎病綜合征患者高脂血癥若長期未能得到緩解,可能會引發慢性進行性腎小球或腎小管間質的損害,甚至進展為腎小球纖維化及慢性腎臟病,也會增加未來心血管疾病的發病風險[2-4]。目前臨床指南針對腎病綜合征患兒高脂血癥的治療主要是治療原發病和生活方式管理,缺乏對高脂血癥長期監測及干預的相關指導。隊列研究發現兒童期不良的心血管健康橫斷面測量結果(包括體重指數、TC、血糖、血壓)將導致兒童期及成年期頸動脈內 膜 中 層 厚 度 (carotid intima‐media thickness,cIMT)增高、冠心病發病率增加[5]。研究發現:PNS患兒cIMT及成年后早發冠心病風險均高于同齡健康兒童[6]。美國心臟協會的兒科共識指南已將腎病綜合征視為加速動脈粥樣硬化的特殊危險因素[4],因此早期血脂的控制及監測至關重要[7]。脂肪因子是近年來備受關注的一種生物活性多肽,不僅在能量代謝平衡、炎癥、氧化應激、免疫應答等病理過程中起作用,還與心血管疾病、糖尿病、代謝綜合征、肥胖等疾病有關[8-9]。本文旨在研究PNS患兒治療前后脂肪因子的表達變化及其與血脂的相關性,以探討脂肪因子在PNS患兒高脂血癥中的作用。
1 資料與方法
1.1 研究對象
前瞻性選取2015年3月至2018年3月在天津市兒童醫院腎臟內科住院并確診為PNS初發或激素停藥6個月以上復發的PNS患兒為研究對象,另選取同期在我院門診行健康體檢的兒童為對照組。PNS患兒納入標準:(1)符合2016年中華醫學會兒科學分會腎臟學組制定的《兒童激素敏感、復發/依賴腎病綜合征診治循證指南(2016)》[10]中關于PNS患兒的診斷標準;(2)年齡小于18歲;(3)PNS患兒在經過4周臨床正規應用激素治療后,蛋白尿達到完全緩解;(4)近期無感染、慢性腎臟疾病及風濕免疫相關疾病病史;(5)排除由全身系統性疾病、遺傳及藥物引起的繼發性腎病綜合征患兒。納入PNS患兒90例,其中男63例,女27例,男女比例為2.3∶1;年齡1~15歲,平均年齡(4.3±2.9)歲。納入對照組兒童30例,其中男20例,女10例,男女比例為2.0∶1;年齡2~12歲,平均年齡(5.5±2.0)歲。PNS組與對照組比較年齡及性別差異均無統計學意義(均P>0.05)。
根據激素治療進程將時間點分為激素治療前(活動期)及4周激素治療尿蛋白轉陰后(緩解期),比較活動期、緩解期PNS患兒與對照組兒童脂肪因子及血脂的表達差異;分析PNS患兒脂肪因子與血脂的治療前后比值的相關性。按PNS患兒活動期血網膜素(omentin‐1)的中位數值(159.2 ng/mL)將其分為兩組,即高網膜素組(omentin‐1>159.2 ng/mL,n=45) 和 低 網 膜 素 組(omentin‐1≤159.2 ng/mL,n=45),比較高、低網膜素組脂肪因子與血脂的差異。本研究已獲得醫院醫學倫理委員會同意(L2021‐06)。
1.2 脂肪因子及血脂的測定
所有入選患兒分別在活動期和緩解期采集清晨空腹靜脈血2 mL,對照組同樣采集清晨空腹靜脈血2 mL,離心后分裝血清,將血清于-80℃冰箱儲存待檢測。采用酶聯免疫吸附試驗(ELISA)法測定血清omentin‐1及趨化素(chemerin)水平,試劑盒購自上海雙贏生物(SY‐H1198和SY‐H3267)。自動生化分析儀(瑞士羅氏c701)測定血清TG、TC、LDL、高密度脂蛋白(high‐density lipoprotein,HDL)、apoa、apob水平。非高密度脂蛋白(non‐HDL)=TC-HDL[11]; 血 漿 致 動 脈 硬 化 指 數(atherogenic index of plasma,AIP)=log(TG/HDL)[12];castelli危險指數‐1(castelli risk index‐1,CRI‐1)=TC/HDL[13];castelli危險指數‐2(castelli risk index‐2,CRI‐2)=LDL/HDL[13];致動脈粥樣硬化 系 數 (atherogenic coefficient,AC)=(TCHDL)/HDL[13]。留取PNS患兒活動期及緩解期24 h尿樣行24 h尿蛋白定量測定。
1.3 統計學分析
采用SPSS17.0統計學軟件對數據進行統計學分析。符合正態分布計量資料以均數±標準差(±s)表示,兩獨立樣本的組間比較采用兩樣本t檢驗;配對樣本之間的比較采用配對t檢驗。不符合正態分布計量資料以中位數(四分位數間距)[M(P25,P75)]表示,兩獨立樣本的組間比較采用Wilcoxon秩和檢驗,配對樣本的組間比較采用Wilcoxon符號秩和檢驗。采用Spearman秩相關分析法對脂肪因子治療前后比值與各指標治療前后比值的相關性進行分析。P<0.05為差異有統計學意義。
2 結果
2.1 不同時期PNS患兒及對照組兒童脂肪因子水平變化
PNS患兒活動期、緩解期血omentin‐1水平均低于對照組,PNS患兒活動期血omentin‐1水平低于緩解期(均P<0.001)。PNS患兒活動期血chemerin水平高于緩解期及對照組(均P<0.001);PNS患兒緩解期血chemerin水平與對照組比較差異無統計學意義(P>0.05)。見表1~3。
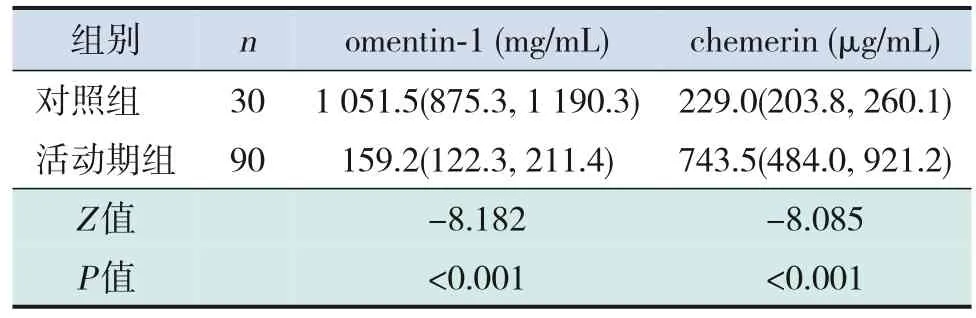
表1 活動期PNS患兒與對照組兒童脂肪因子水平比較[M(P25,P75)]
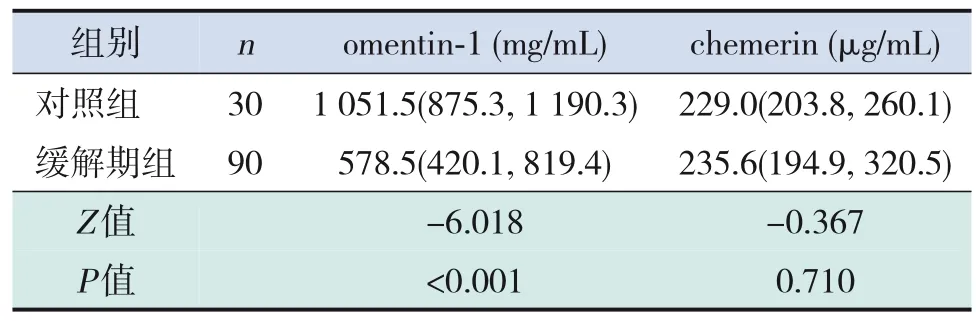
表2 緩解期PNS患兒與對照組兒童脂肪因子水平比較[M(P25,P75)]
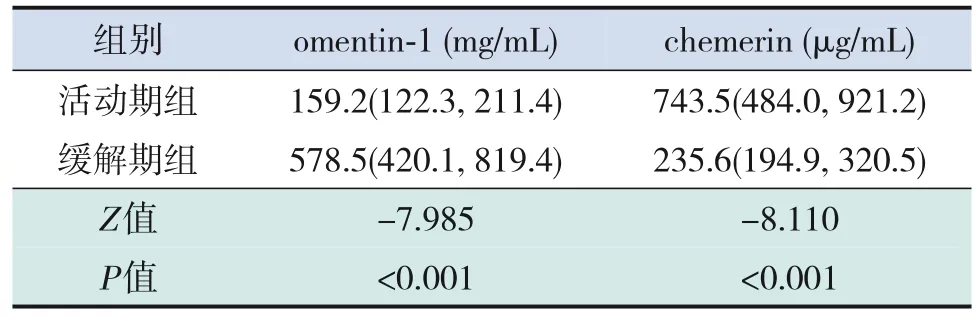
表3 90例PNS患兒活動期與緩解期脂肪因子水平比較[M(P25,P75)]
2.2 不同時期PNS患兒及對照組兒童血脂比值變化
PNS患 兒 活 動 期AIP、AC、CRI‐1、CRI‐2、non‐HDL均高于緩解期及對照組(均P<0.001)。PNS患兒緩解期AIP、AC、CRI‐1、non‐HDL均高于對照組(均P<0.001);PNS患兒緩解期CRI‐2水平與對照組比較差異無統計學意義(P>0.05)。見表4~6。
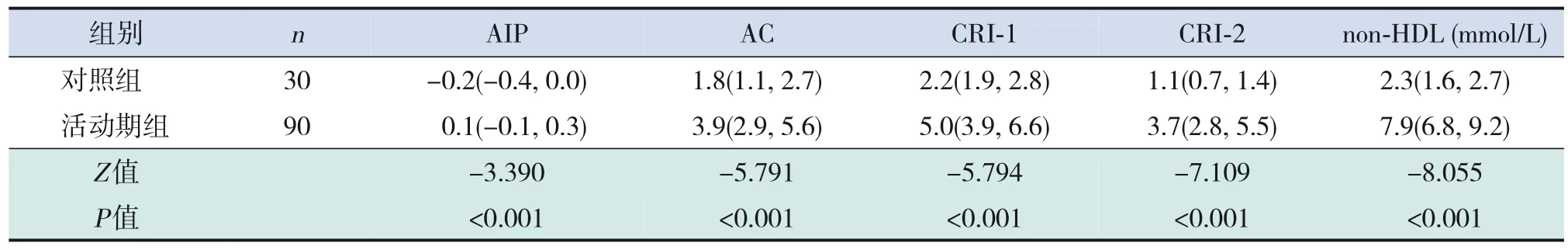
表4 活動期PNS患兒與對照組兒童血脂比值的比較 [M(P25,P75)]
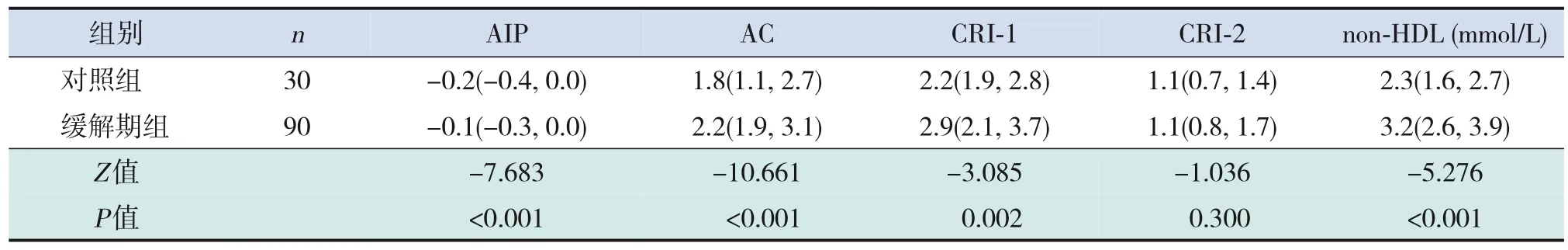
表5 緩解期PNS患兒與對照組兒童血脂比值的比較 [M(P25,P75)]
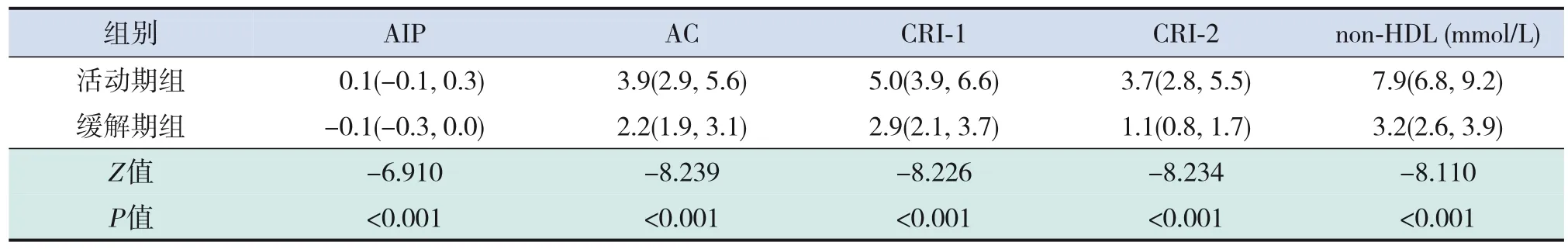
表6 90例PNS患兒活動期與緩解期血脂比值的比較 [M(P25,P75)]
2.3 緩解期PNS患兒及對照組兒童血脂水平變化
PNS患兒緩解期血清TC、TG、HDL、LDL、apoA、apoB水平均高于對照組(均P<0.001),見表7。
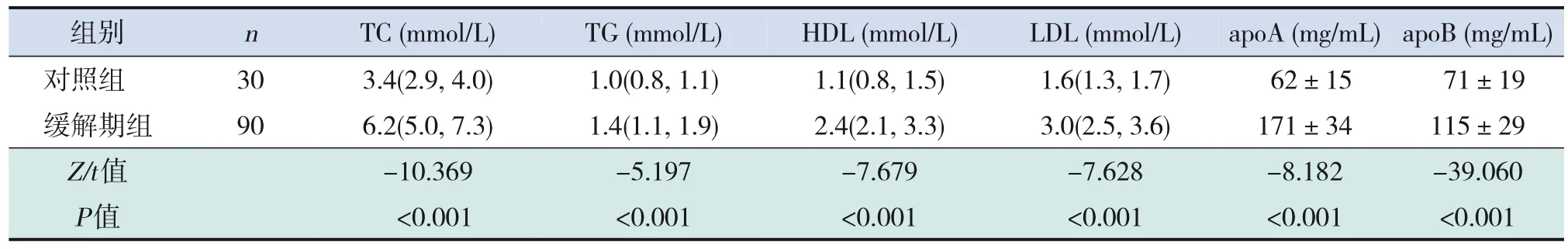
表7 緩解期PNS患兒與對照組兒童血脂水平比較 [M(P25,P75)]
2.4 PNS患兒omentin‐1與各測量指標的治療前后比值的相關性
PNS患兒血omentin‐1治療前后比值分別與HDL治療前后比值(rs=0.322,P=0.002)、24 h尿蛋白定量治療前后比值(rs=0.211,P=0.037)、HDL/apoA治療前后比值(rs=0.254,P=0.016)均呈正相關,與AC治療前后比值(rs=-0.276,P=0.008)、CRI‐1治 療 前 后 比 值 (rs=-0.273,P=0.009)均呈負相關,見表8。
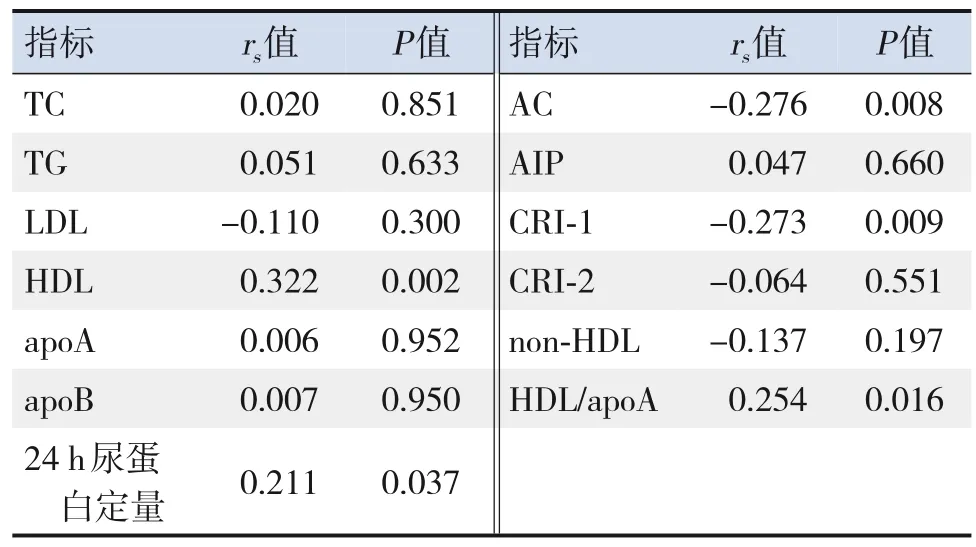
表8 PNS患兒omentin‐1與各測量指標的治療前后比值的相關性分析 (n=90)
2.5 高、低網膜素組血脂水平及比值的變化
高、低網膜素組年齡、性別比較差異無統計學意義(P>0.05)。低網膜素組PNS患兒活動期CRI‐1、CRI‐2、AC、apoB/apoA水平高于高網膜素組,HDL、apoA水平低于高網膜素組(P<0.05);而TC、TG、LDL、apoB、AIP、non‐HDL、chemerin水平在兩組間比較差異無統計學意義(P>0.05)。見表9。
表9 高、低網膜素組血脂水平及比值的比較 (±s,n=45)
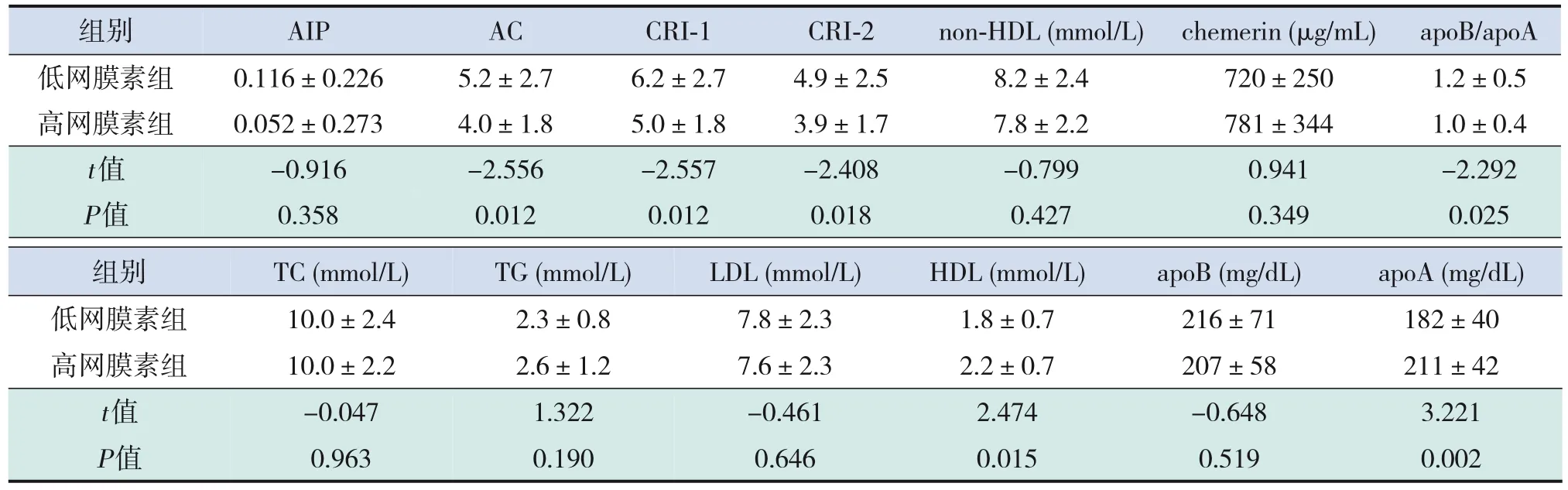
表9 高、低網膜素組血脂水平及比值的比較 (±s,n=45)
注:[AIP] 血漿致動脈粥樣硬化指數;[AC] 致動脈粥樣硬化系數;[CRI‐1]castelli危險指數‐1;[CRI‐2]castelli危險指數‐2;[non‐HDL]非高密度脂蛋白;[TC]總膽固醇;[TG]三酰甘油;[HDL]高密度脂蛋白;[LDL]低密度脂蛋白;[apoA]載脂蛋白A;[apoB]載脂蛋白B。
組別AIPACCRI‐1CRI‐2non‐HDL(mmol/L)chemerin(μg/mL)apoB/apoA低網膜素組0.116±0.2265.2±2.76.2±2.74.9±2.58.2±2.4720±2501.2±0.5高網膜素組0.052±0.2734.0±1.85.0±1.83.9±1.77.8±2.2781±3441.0±0.4 t值-0.916-2.556-2.557-2.408-0.7990.941-2.292 P值0.3580.0120.0120.0180.4270.3490.025組別TC(mmol/L)TG(mmol/L)LDL(mmol/L)HDL(mmol/L)apoB(mg/dL)apoA(mg/dL)低網膜素組10.0±2.42.3±0.87.8±2.31.8±0.7216±71182±40高網膜素組10.0±2.22.6±1.27.6±2.32.2±0.7207±58211±42 t值-0.0471.322-0.4612.474-0.6483.221 P值0.9630.1900.6460.0150.5190.002
3 討論
omentin‐1是2003年在人內臟網膜脂肪cDNA庫組織中發現的一種脂肪因子,主要表達于內臟脂肪組織,其他部位如心外膜脂肪等也有表達。omentin‐1可作為內皮功能障礙及亞臨床冠心病的預測指標,也具有抗動脈粥樣硬化作用[14-15]。血清omentin‐1水平與血流介導的血管擴張率呈正比,可作為內皮細胞功能障礙的預測指標[16]。研究發現:PNS患兒存在內皮功能障礙,尤其是活動期[17]。數據顯示:隨著血脂、血脂比值、蛋白尿的改善,PNS患兒omentin‐1水平升高,提示omentin‐1可與疾病活動、血脂紊亂有關,且PNS患兒omentin‐1治療前后比值與24 h尿蛋白定量治療前后比值呈正相關,提示omentin‐1可作為評估病情活動的預測指標。
omentin‐1可上調巨噬細胞中ATP結合盒轉運蛋 白A1(ATP‐binding cassette transporter A1,ABCA1)的表達,促進胞內膽固醇外流,降低胞內總膽固醇、游離膽固醇、膽固醇酯,增加血漿HDL,降低血漿LDL。血管緊張素Ⅱ可通過誘導大鼠足細胞中omentin‐1表達下降而導致足細胞內膽固醇蓄積和足細胞骨架重構。在糖尿病小鼠模型中,炎性因子表達升高,omentin‐1與ABCA1表達下降,足細胞內膽固醇蓄積、腎小球濾過屏障受損,omentin‐1可上調足細胞ABCA1表達減輕胞內膽固醇沉積而改善糖尿病小鼠模型足細胞功能[18-19]。實驗數據顯示:經激素治療后PNS患兒血脂及蛋白尿明顯改善,同時血omentin‐1水平升高,提示omentin‐1與PNS患兒蛋白尿及血脂紊亂有關。且omentin‐1治療前后比值與CRI‐1、AC、HDL治療前后比值相關,提示omentin‐1與PNS患兒膽固醇逆向轉運機制有關,omentin‐1‐ABCA1介導的膽固醇代謝可作為PNS患兒靶向治療高脂血癥及蛋白尿的一種新理念。
研究發現:omentin‐1與Syntax評分及cIMT呈負相關,可作為日后冠心病診斷及評估預后的新型生物指標[20-21]。相對于傳統血脂測量指標,血脂-脂蛋白比值更有利于早期心血管疾病的預測及監 測[22]。 其 中AIP>0.1、CRI‐1>5.0、CRI‐2>3.3、AC≥4.0均提示心血管疾病風險增高[12-13]。血脂比值對于兒童及青少年成年后冠心病發病風險的管理也具有指導意義;研究發現:高血non‐HDL的兒童幼年期糾正non‐HDL后,成年期發生高頸動脈內膜中層厚度的風險與正常兒童無異[22]。CRI‐1也可作為兒童及青少年代謝性心血管疾病的監測指標[22]。數據顯示:高網膜素組患兒活動期CRI‐1、CRI‐2、AC、apoB/apoA高于低網膜素組,而TC、TG、LDL、apoB無差異,PNS患兒高冠心病風險組血脂-脂蛋白比值更高,提示血脂-脂蛋白比值與omentin‐1變化相一致,可能在監測早期心血管風險方面比傳統血脂指標更有效。
Helfer等[23]首次確認一種具有趨化作用的脂肪因子,將其命名為chemerin,又稱維甲酸受體應答劑,chemerin是由脂肪組織與肝臟合成的蛋白質,可促進脂肪細胞的成熟與分化。chemerin可作為免疫細胞的趨化劑,調節先天性和獲得性炎癥反應,還可影響糖類或脂類代謝。目前已有大量實驗證明chemerin與肥胖兒童的血糖、TG、TC、LDL、HDL等代謝綜合征參數有關[24-25]。chemerin在代謝綜合征中可作為一項炎癥預測指標[26]。本研究中PNS患兒血脂的降低伴隨著chemerin水平的降低,提示經激素治療后PNS患兒血脂的改善伴隨炎癥反應的減少,有利于預后。

