阿魏酸對人肝癌HepG2細胞增殖、侵襲和凋亡的影響
音金萍 卓少元
中圖分類號 R965 文獻標志碼 A 文章編號 1001-0408(2021)13-1565-07
DOI 10.6039/j.issn.1001-0408.2021.13.05
摘 要 目的:研究阿魏酸對人肝癌HepG2細胞增殖、侵襲和凋亡的影響。方法:采用CCK-8法篩選阿魏酸的給藥濃度;采用Western blot法篩選白細胞介素6(IL-6)誘導磷酸化信號轉導蛋白及轉錄激活子3(p-STAT3)蛋白高表達的HepG2細胞模型的最佳造模濃度。將HepG2細胞分為空白對照組、模型組、阿魏酸組(0.5 mmol/L)和陽性對照組(p-STAT3抑制劑C188-9,10 μmol/L),除空白對照組外,模型組加入IL-6、各給藥組加入IL-6和相應藥物分別進行培養。采用CCK-8法、 Transwell法和Annexin V-FITC/PI雙染色法分別檢測各組細胞存活率、侵襲數和早期、晚期凋亡率;采用Western blot法檢測各組細胞中p-STAT3、胱天蛋白酶3(caspase-3)、鋅指蛋白(ZBP-89)和波形蛋白(vimentin)的表達水平。基于PDB蛋白數據庫,以STAT3高度相似晶體結構1BG1為對接模板,以Tyr705周圍的區域為假定的結合口袋,進行阿魏酸與STAT3蛋白的分子對接分析。結果:選擇以0.5 mmol/L 阿魏酸干預HepG2細胞48 h作為后續實驗條件,以50 ng/mL IL-6為造模條件。與空白對照組比較,模型組細胞侵襲數和p-STAT3/STAT3比值、vimentin蛋白表達水平均顯著增加或升高(P<0.05或P<0.01),細胞晚期凋亡率和caspase-3蛋白表達水平均顯著降低(P<0.05或P<0.01)。與模型組比較,阿魏酸組和陽性對照組細胞存活率、侵襲數、p-STAT3/STAT3比值和vimentin蛋白表達水平均顯著減少或降低(P<0.05或P<0.01),細胞早期凋亡率(阿魏酸組除外)、晚期凋亡率和caspase-3、ZBP-89(陽性對照組除外)蛋白表達水平均顯著升高(P<0.05或P<0.01)。分子對接結果表明,阿魏酸的羧酸基團與Asn581、Lys591分別存在1.9?、2.0?的氫鍵作用,結合能為-4.4 kcal/mol。結論:阿魏酸可能通過與STAT3磷酸化位點直接結合來抑制p-STAT3的活性;并可通過STAT3依賴性途徑上調caspase-3蛋白表達,或可通過STAT3非依賴性途徑上調ZBP-89蛋白表達,進而下調vimentin蛋白表達,從而抑制HepG2細胞的增殖、侵襲與凋亡。
關鍵詞 阿魏酸;人肝癌HepG2細胞;信號轉導蛋白及轉錄激活子3;胱天蛋白酶3;波形蛋白
Effects of Ferulic Acid on the Proliferation, Invasion and Apoptosis of HepG2 Hepatocellular Carcinoma Cells
YIN Jinping,ZHUO Shaoyuan(School of Basic Medical Science, Guangxi University of TCM, Nanning 530200, China)
ABSTRACT? ?OBJECTIVE: To study the effects of ferulic acid on the proliferation, invasion and apoptosis of HepG2 hepatocelluar carcinoma cells. METHODS: CCK-8 assay was used to screen the concentration of ferulic acid. Western blot assay was adopted to screen the optimal concentration of interleukin 6 (IL-6) to induce HepG2 cell model with high expression of phosphorylated signal transduction protein and activator 3 (p-STAT3) protein.? HepG2 cell were divided into blank control group, model group, ferulic acid group (0.5 mmol/L) and positive control group (p-STAT3 inhibitor C188-9, 10 μmol/L). Except for blank control group, model group treated with IL-6, while administration groups were treated with IL-6 and relevant drugs. Cell survival rate, invasion and apoptosis rate in early and late stage were detected by CCK-8 assay, Transwell assay and Annexin V-FITC/PI double staining, respectively. Western blot assay was used to detect the expression of p-STAT3, caspase-3, ZBP-89 and vimentin proteins in each group. On the basis of the PDB protein database, using 1BG1, a highly similar crystal structure of STAT3, as docking template, using the region around Tyr705 as the putative binding pocket, the docking analysis of ferulic acid with STAT3 protein was carried out. RESULTS: It is selected to use 0.5 mmol/L ferulic acid intervention for 48 h as the follow-up experimental condition; 50 ng/mL IL-6 was selected as the modeling condition. Compared with blank control group, the number of cell invasion, p-STAT3/STAT3 ratio and protein expression of vimentin were increased significantly in model group (P<0.05 or P<0.01), while late apoptosis rate and protein expression of caspase-3 were decreased significantly (P<0.05 or P<0.01). Compared with model group, cell survival rate, the number of cell invasion, p-STAT3/STAT3 ratio and protein expression of vimentin were decreased significantly in ferulic acid group and positive control group (P<0.05 or P<0.01); early apoptotic rate (except for ferulic acid group), late? apoptotic rate, the protein expression of caspase-3 and ZBP-89 (except for positive control group) were increased significantly (P<0.05 or P<0.01). The results of molecular docking showed that the carboxylic groups of ferulic acid could interact with 1.9 ? hydrogen bond of Asn581 and 2.0 ? hydrogen bond of Lys591, with binding energy of -4.4 kcal/mol. CONCLUSIONS: Ferulic acid may inhibit the activity of p-STAT3 by directly binding to the phosphorylation site of STAT3; it may up-regulate the protein expression of caspase-3 via STAT3 dependent pathway, or up-regulate the protein expression of ZBP-89 via STAT3 independent pathway and then down-regulate the protein expression of vimentin, so as to inhibit the proliferation, invasion and apoptosis of HepG2 cells.
KEYWORDS? ?Ferulic acid; HepG2 hepatocellular carcinoma cell; STAT3; Caspase-3; Vimentin
原發性肝癌是全球第六大常見癌癥,2020年其新發病例約90.6萬,病死病例約83萬;其中最常見的是肝細胞癌,約占原發性肝癌的75%~85%[1]。
阿魏酸是來源于阿魏和當歸等中藥的一種酚酸類成分,其性質穩定、毒性低,具有解毒、保肝等作用,且可有效抑制肝癌細胞的生長、促進肝癌細胞的凋亡[2-3],但其抗肝癌的分子機制及作用靶點尚未完全明確。研究表明,信號轉導蛋白及轉錄激活子3(STAT3)和波形蛋白(vimentin)均在肝癌組織或肝癌細胞株中過度表達,并作為一種重要的信號分子和轉錄因子,參與肝癌細胞的快速增殖、侵襲和轉移[4-6]。當肝癌細胞受到刺激后,促進白細胞介素6(IL-6)等炎癥因子激活STAT3的磷酸化[7-8],然后磷酸化STAT3(p-STAT3)以二聚體的形式轉入細胞核,調控細胞凋亡關鍵分子胱天蛋白酶3(caspase-3)或抑癌因子鋅指蛋白(ZBP-89),進而增強vimentin表達,從而促進肝癌細胞增殖、侵襲并抑制其凋亡[9-12]。但阿魏酸是否可通過STAT3-vimentin信號通路發揮抗肝癌作用尚不明確。
基于此,本研究利用人重組因子IL-6誘導p-STAT3高表達的人肝癌HepG2細胞模型,以p-STAT3抑制劑C188-9為陽性對照[13],基于STAT3-vimentin信號通路探討阿魏酸對HepG2細胞增殖、侵襲和凋亡的影響,并結合分子對接技術預測阿魏酸與STAT3的結合位點,探討阿魏酸抗肝癌作用的靶點與分子機制,以期為其臨床應用提供實驗基礎。
1 材料
1.1 主要儀器
本研究所用主要儀器有MCO-18AIC型 CO2細胞培養箱(日本Sanyo公司),Epoch 型全波長酶標儀(美國 BioTek公司),LSRFortessa型流式細胞儀(美國BD公司),PowerPac TM Universal Power Supply型電泳儀、全能型成像分析系統(美國 Bio-Rad公司),垂直式電泳槽和轉膜儀(北京六一生物技術有限公司),MDF-U7386S型超低溫冰箱、ST 16R型高速離心機(美國Thermo Fisher Scientific公司)等。
1.2 主要藥品與試劑
本研究所用主要藥品與試劑有高糖DMEM培養基、Annexin V-FITC/PI凋亡檢測試劑盒(美國 Wisent 公司,批號分別為319006023、A211-01),0.25%胰蛋白酶、胎牛血清(美國Gibco公司,批號分別為2120917、2148169CP),p-STAT3抑制劑C188-9(美國Mce公司,批號31595),CCK-8細胞增殖檢測試劑盒(南京諾唯贊生物科技有限公司,批號7E271E8),Matrigel基質膠(美國BD公司,批號354234),十二烷基硫酸鈉-聚丙烯酰胺(SDS-PAGE)凝膠快速配制試劑盒(上海碧云天生物技術有限公司,批號120319191206),Transwell小室(美國Corning公司,批號09420061),阿魏酸(成都曼斯特生物科技有限公司,批號MUST-20060511,純度≥98%),人重組因子IL-6(美國Peprotech公司,批號0215102c2793),BCA 蛋白定量試劑盒(武漢博士德生物工程有限公司,批號14G08A46),ECL 發光試劑盒(北京中杉金橋生物技術有限公司,批號7E34E9),RIRA裂解液(北京索萊寶生物技術有限公司,批號20190922),蛋白磷酸酶抑制劑(杭州弗德生物科技有限公司,批號20200114),兔源caspase-3多克隆抗體、兔源p-STAT3單克隆抗體(美國CST公司,批號分別為34、18),兔源GAPDH多克隆抗體、兔源STAT3多克隆抗體、兔源vimentin多克隆抗體、山羊抗兔免疫球蛋白G(IgG)二抗(武漢三鷹生物技術有限公司,批號分別為00078427、00081195、00086320、20000217),兔源ZBP-89多克隆抗體(北京博奧森生物技術有限公司,批號AC07172366);其余試劑為實驗室常用規格,水為純凈水。
1.3 細胞
本研究所用人肝癌細胞株HepG2由廣西中藥藥效研究重點實驗室提供。
2 方法
2.1 細胞培養
采用含10%胎牛血清的高糖DMEM培養基(以下簡稱培養基)于37 ℃、5%CO2的培養箱中常規培養HepG2細胞。當細胞生長至80%時,向培養瓶中加入0.25%胰酶消化,經培養基中和后,制成細胞懸液,以進行傳代和后續研究。
2.2 阿魏酸的干預時間和給藥濃度的篩選
采用CCK-8法進行篩選。取對數生長期的HepG2細胞,加入0.25%胰酶消化,制成密度為5×104 mL-1的細胞懸液;取100 μL細胞懸液接種于96孔板中,然后分為空白對照組和阿魏酸不同濃度組(0.125、0.25、0.5、1、2、4 mmol/L,濃度參考文獻[14]設置),每組設3個復孔;并設置調零孔(只加培養基不加細胞,下同)。將細胞于37 ℃、5% CO2的培養箱中培養24 h后,給藥組加入100 μL含相應濃度阿魏酸的無血清培養基,空白對照組加入100 μL無血清培養基。分別于作用12、24、48 h時,根據CCK-8細胞增殖檢測試劑盒說明書操作,采用酶標儀于450 nm波長處測定各組的光密度(OD)值,并計算細胞存活率[細胞存活率=(OD給藥組-OD調零孔)/(OD空白對照組-OD調零孔)×100%],以篩選阿魏酸的干預時間和給藥濃度。
2.3 IL-6造模濃度的篩選
參考文獻[15-16]方法進行篩選。取對數生長期的HepG2細胞,加入0.25%胰酶消化,制成2.5×105 mL-1的細胞懸液;取2 mL細胞懸液接種于6孔板中,然后分為空白對照組和IL-6不同造模濃度組(12.5、25、50、100、200 ng/mL,濃度參考文獻[15-16]設置),每組設3個復孔。待HepG2細胞生長至80%時,IL-6不同造模濃度組加入含相應質量濃度IL-6的無血清培養基2 mL,空白對照組加入不含IL-6的無血清培養基2 mL,于37 ℃、5% CO2的培養箱中培養48 h后,用細胞刮刮取細胞,并以? 1 000 r/min離心5 min獲得細胞沉淀。取細胞沉淀,加入RIPA裂解液、PMSF和蛋白磷酸酶抑制劑(體積比為100 ∶ 1 ∶ 1)適量,于冰上裂解30 min;于4 ℃條件下以12 000 r/min離心5 min,取上清液,采用BCA 蛋白定量試劑盒檢測蛋白濃度。蛋白經變性處理后進行SDS- PAGE電泳,轉膜,于封閉液中封閉30 min;以TBST洗膜30 min,分別加入GAPDH一抗(稀釋度為1 ∶ 5 000)、p-STAT3一抗(稀釋度為1 ∶ 2 000)、STAT3一抗(稀釋度為1 ∶ 2 000),孵育過夜;以TBST洗膜30 min,加入二抗(稀釋度為1 ∶ 5 000),孵育1 h;以TBST洗膜30 min,加入顯影液,經凝膠成像系統成像。采用Image J v1.8.0軟件進行分析,以p-STAT3蛋白灰度值與STAT3蛋白灰度值的比值表示STAT3的磷酸化程度,該比值越大,則表示STAT3磷酸化程度越高(下同)。
2.4 分組、造模與給藥
取對數生長期的HepG2細胞,分為空白對照組、模型組、阿魏酸組(0.5 mmol/L)和陽性對照組(C188-9,10 μmol/L,濃度根據文獻[17]設置)。待細胞生長至80%時,空白對照組加入無血清培養基(6孔板加入培養基2 mL,96孔板加入培養基100 μL,下同),模型組加入含50 ng/mL IL-6的無血清培養基,阿魏酸組加入含50? ? ?ng/mL IL-6和0.5 mmol/L阿魏酸的無血清培養基,陽性對照組加入含50 ng/mL IL-6和10 μmol/L C188-9的無血清培養基,再繼續培養48 h后進行后續檢測。
2.5 細胞存活率的檢測
采用CCK-8法進行檢測。取對數生長期的HepG2細胞,加入0.25%胰酶消化,制成5×104 mL-1的細胞懸液;取100 μL細胞懸液接種于96孔板中,于37 ℃、5% CO2的培養箱中培養48 h后,按“2.4”項下方法分組、造模與給藥,每組設3個復孔,并設置調零孔。然后根據CCK-8細胞增殖檢測試劑盒說明書操作,采用酶標儀于450 nm波長處測定各孔的OD值,并計算細胞存活率。
2.6 細胞侵襲能力的檢測
采用Transwell小室法進行檢測。取對數生長期的HepG2細胞,按“2.4”項下方法分組、造模與給藥;培養過程中另取培養基稀釋Matrigel基質膠(體積比為1 ∶ 8),兩者混勻后,以50 μL/孔加入Transwell小室上層,并于培養箱中過夜風干;取上述各組細胞制成2.5×105 mL-1的細胞懸液,然后分別取細胞懸液100 μL加入至Transwell小室上層中,小室下層中加入700 μL含10%胎牛血清的培養基,于37 ℃、5%CO2的培養箱中培養24 h;取出小室,經甲醛固定、結晶紫染色、棉簽拭去未侵襲細胞后,于顯微鏡下隨機選取3個視野觀察被染成藍紫色的細胞,即為侵襲細胞,并統計各組的侵襲細胞數。
2.7 細胞凋亡率檢測
采用Annexin V-FITC/PI雙染色法進行檢測。取對數生長期的HepG2細胞,加入0.25%胰酶消化,制成2.5×105 mL-1的細胞懸液;取2 mL細胞懸液接種于6孔板中,于37 ℃、5%CO2的培養箱中培養24 h后,按“2.4”項下方法分組、造模與給藥,每組設3個復孔。然后根據Annexin V-FITC/PI凋亡檢測試劑盒說明書方法操作,采用流式細胞儀進行細胞凋亡率檢測。
2.8 細胞中p-STAT3、STAT3、ZBP-89、caspase-3、vimentin蛋白表達水平檢測
采用Western blot法進行檢測。取對數生長期的HepG2細胞,加入0.25%胰酶消化,制成2.5×105 mL-1的細胞懸液;取2 mL細胞懸液接種于6孔板中,按“2.4”項下方法分組、造模與給藥,每組設3個復孔。培養結束后,刮取各組細胞,按“2.3”項下“于4 ℃條件下以12 000 r/min離心5 min獲得細胞沉淀……于封閉液中封閉30 min”步驟操作,然后以TBST洗膜30 min,分別加入GAPDH一抗(稀釋度為1 ∶ 5 000)、p-STAT3一抗(稀釋度為1 ∶ 2 000)、STAT3一抗(稀釋度為1 ∶ 2 000)、ZBP-89一抗(稀釋度為1 ∶ 1 000)、vimentin一抗(稀釋度為1 ∶? ?1 000)、caspase-3一抗(稀釋度為1 ∶ 1 000),孵育過夜;以TBST洗膜30 min,加入二抗(稀釋度為1 ∶ 5 000),孵育1 h;以TBST洗膜30 min,加入顯影液,經凝膠成像系統成像。采用Image J v1.8.0軟件進行分析,以p-STAT3蛋白灰度值與STAT3蛋白灰度值的比值表示STAT3的磷酸化程度,以ZBP-89、vimentin 、caspase-3蛋白灰度值與內參蛋白GAPDH的灰度值的比值表示其表達水平。
2.9 阿魏酸與STAT3蛋白的分子對接分析
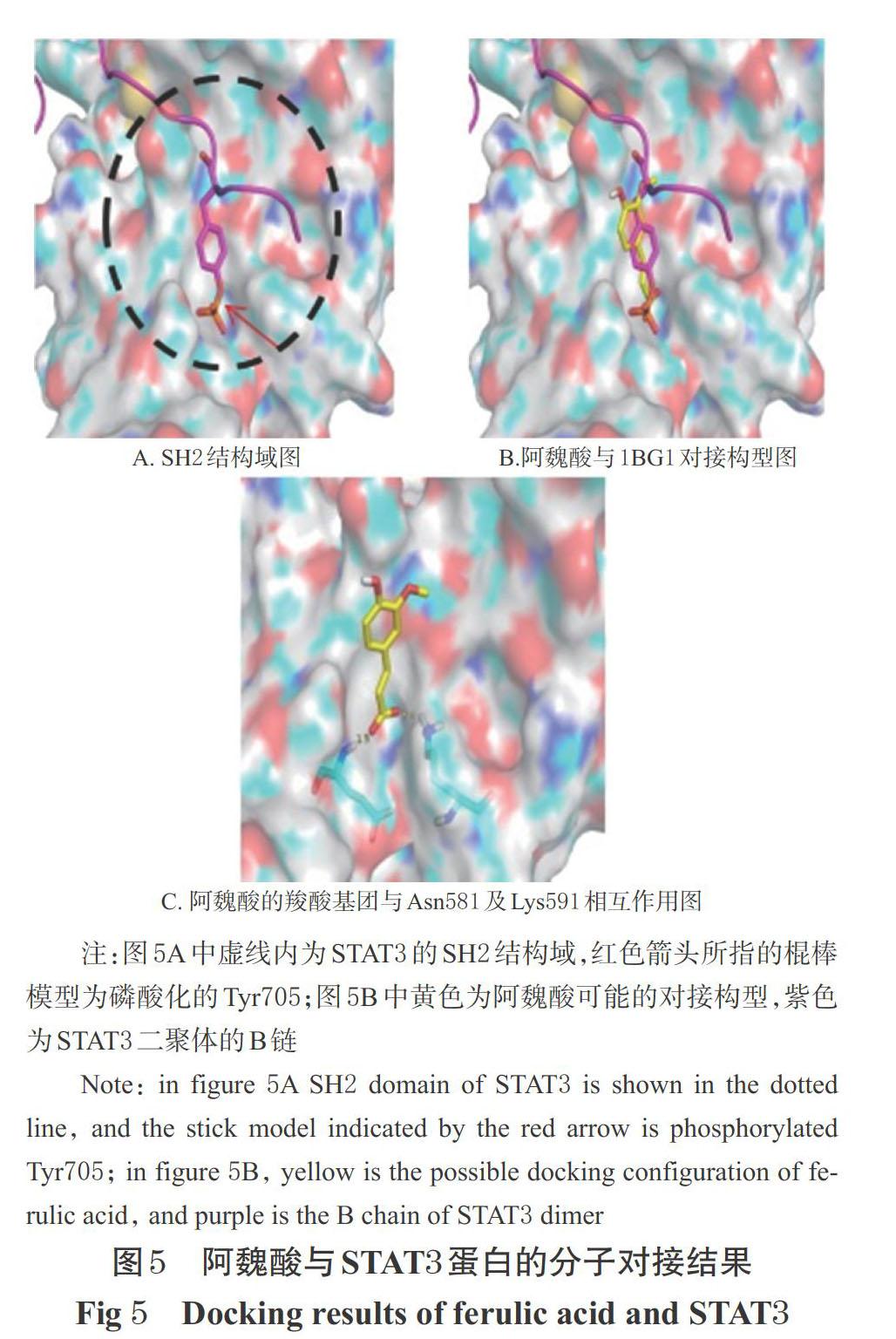
通過PDB蛋白數據庫(https://www.rcsb.org/)獲得STAT3蛋白分子4個高度相似的晶體結構(PDB條目分別為4E68、1BG1、6QHD、3CWG)。通過查閱文獻發現,抑制劑C188-9主要通過作用于STAT3蛋白的SH2結構域,抑制Tyr705位點的磷酸化[13]。因此,筆者假定該結構域為阿魏酸與STAT3蛋白的結合位點,以1BG1為對接模板、以Tyr705周圍的區域為假定的結合口袋(包括氨基酸Lys591、Arg609、Phe610、Ser611、Ser613、Thr620、Ser636、Val637、Pro639),進行分子對接分析。
2.10 統計學分析
采用 SPSS 17.0 軟件進行統計分析。將符合正態分布的數據以x±s表示,采用單因素方差分析;不符合正態分布的數據采用秩和檢驗。P<0.05表示差異有統計學意義。
3 結果
3.1 阿魏酸干預時間和給藥濃度的篩選結果
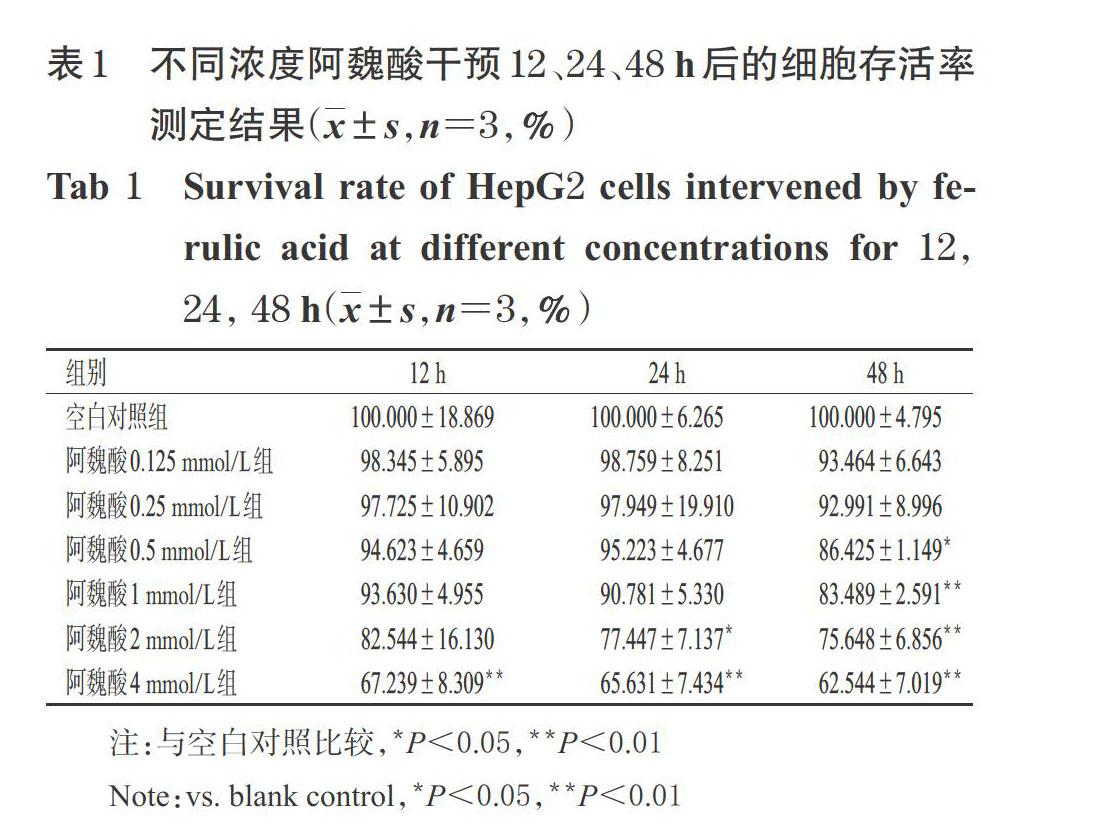
阿魏酸干預12 h后,與空白對照組比較,阿魏酸4 mmol/L組細胞存活率顯著降低(P<0.01),阿魏酸其余濃度組細胞存活率差異無統計學意義;阿魏酸干預24 h后,與空白對照組比較,阿魏酸2、4 mmol/L組細胞存活率顯著降低(P<0.05或P<0.01);阿魏酸干預48 h后,與空白對照組比較,阿魏酸0.5、1、2、4 mmol/L組細胞存活率均顯著降低(P<0.05或P<0.01),詳見表1。基于此,本研究采用以0.5 mmol/L 阿魏酸干預48 h的條件進行后續試驗。
3.2 IL-6造模濃度的篩選結果
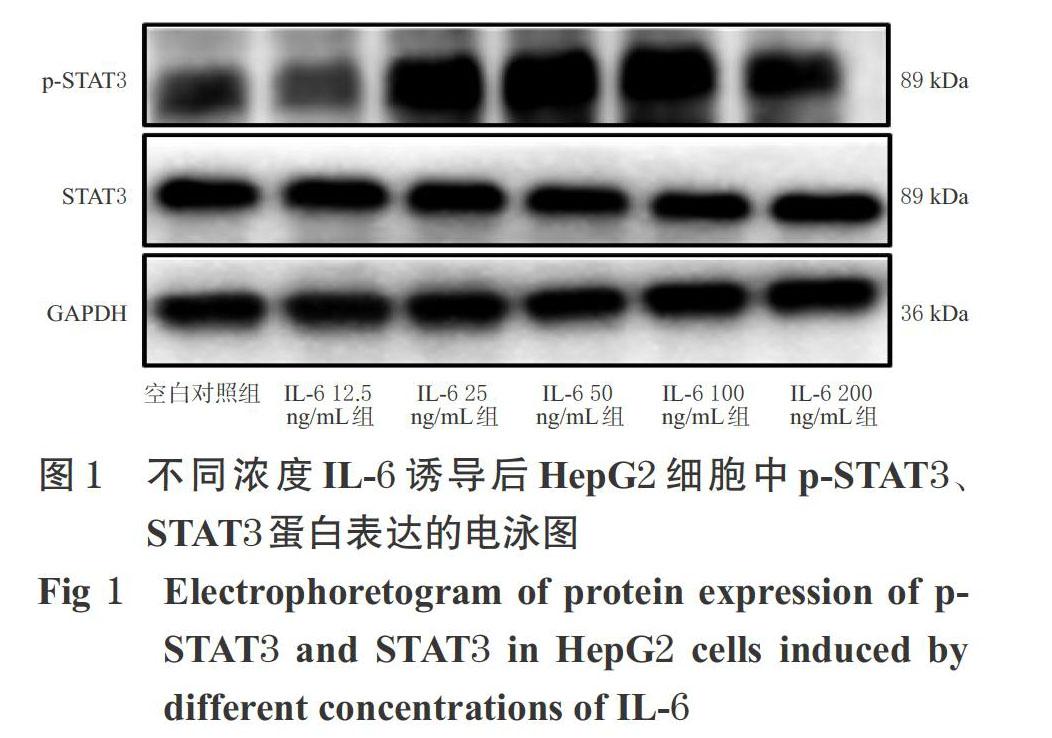
與空白對照組比較,IL-6 25、50、100、200 ng/mL組細胞中p-STAT3/STAT3比值均顯著升高(P<0.05或P<0.01);與IL-6 50、100 ng/mL組比較,IL-6其余濃度組細胞中p-STAT3/STAT3比值均顯著降低(P<0.05或P<0.01),但IL-6 50、100 ng/mL兩組間比較差異無統計學意義(P>0.05)。基于此,后續試驗采用50 ng/mL IL-6來誘導建立p-STAT3蛋白高表達的HepG2細胞模型,詳見圖1、表2。
3.3 阿魏酸對HepG2細胞存活率的影響
與空白對照組比較,模型組細胞存活率差異無統計學意義(P>0.05);與模型組比較,阿魏酸組和陽性對照組細胞存活率均顯著降低(P<0.05或P<0.01);與陽性對照組比較,阿魏酸組細胞存活率顯著升高(P<0.01),詳見表3。
3.4 阿魏酸對HepG2細胞侵襲能力的影響
與空白對照組比較,模型組HepG2細胞侵襲數顯著增加(P<0.01);與模型組比較,阿魏酸組和陽性對照組細胞侵襲數顯著減少(P<0.01);與陽性對照組比較,阿魏酸組細胞侵襲數顯著增加(P<0.05),詳見圖2、表3。
3.5 阿魏酸對HepG2細胞凋亡的影響
與空白對照組比較,模型組HepG2細胞的早期凋亡率差異無統計學意義(P>0.05),晚期凋亡率顯著降低(P<0.05);與模型組比較,阿魏酸組細胞的晚期凋亡率和陽性對照組細胞的早期、晚期凋亡率均顯著升高(P<0.05或P<0.01);與陽性對照組比較,阿魏酸組細胞的早期、晚期凋亡率均顯著降低(P<0.01),詳見圖3、表4。
3.6 阿魏酸對HepG2細胞中p-STAT3、STAT3、ZBP- 89、caspase-3和vimentin蛋白表達的影響
與空白對照組比較,模型組細胞中p-STAT3/STAT3比值、vimentin蛋白表達水平均顯著升高(P<0.05或P<0.01),caspase-3蛋白表達水平顯著降低(P<0.01);與模型組比較,阿魏酸組和陽性對照組細胞中p-STAT3/STAT3比值、vimentin蛋白表達水平均顯著降低(P<0.05或P<0.01),caspase-3、ZBP-89(陽性對照組除外)蛋白表達水平均顯著升高(P<0.05或P<0.01);與陽性對照組比較,阿魏酸組細胞中p-STAT3/STAT3比值、vimentin和ZBP-89蛋白表達水平均顯著升高(P<0.05或P<0.01),詳見圖4、表5。
3.7 阿魏酸與STAT3蛋白分子對接結果
選取1BG1為對接模板,以Tyr705周圍的區域為假定的結合口袋進行分子對接。結果表明,阿魏酸的羧酸基團與Asn581、Lys591分別存在1.9?、2.0?的氫鍵作用,結合能為-4.4 kcal/mol,詳見圖5。
4 討論
臨床研究表明,STAT3及其激活型p-STAT3在大多數肝細胞癌患者的肝癌組織中高表達[18],且STAT3信號通路的激活在肝細胞癌進展與轉移中發揮著重要作用[19]。STAT3通常以非活化形式存在于細胞質中,當細胞受到刺激時,IL-6等炎性因子可通過與細胞膜受體結合,作用于gp130蛋白,激活非受體酪氨酸激酶(JAK),進而磷酸化修飾STAT3蛋白分子;p-STAT3以二聚體形式轉入細胞核,調控癌基因表達[4,20]。研究表明,p- STAT3可通過結合ZBP-89或抑制caspase-3表達,從而促進vimentin蛋白的表達及其在癌細胞中的作用[9-12]。ZBP-89是vim基因啟動子區域的負調控因子,其與p-STAT3直接相互作用后,不僅可促進vim基因抗沉默子元件的作用來增強vimentin的表達,還可減弱自身募集組蛋白去乙酰化酶1(HDAC1)到vim啟動子區域的能力,從而使vimentin乙酰化增強,進而促進癌細胞的遷移[9-10];凋亡關鍵分子caspase-3可裂解vimentin蛋白,而p-STAT3可通過抑制caspase-3的表達,降低后者對vimentin蛋白的裂解能力進而上調vimentin表達[11-12]。
本研究確定以0.5 mmol/L 阿魏酸干預HepG2細胞48 h的條件進行研究,且以50 ng/mL IL-6誘導的p- STAT3高表達HepG2細胞模型最佳。然后基于此進行后續研究發現,與空白對照組比較,模型組細胞侵襲數顯著增加,p-STAT3/STAT3比值、vimentin蛋白表達水平均顯著升高,細胞晚期凋亡率和caspase-3蛋白表達水平均顯著降低,表明STAT3蛋白磷酸化水平的升高可抑制caspase-3(而不是ZBP-89)蛋白表達,進而上調肝癌細胞中vimentin的蛋白表達。經阿魏酸和陽性對照干預后,阿魏酸組和陽性對照組細胞存活率、細胞侵襲數、p-STAT3/STAT3比值、vimentin蛋白表達水平均顯著降低,細胞早期凋亡率(阿魏酸組除外)、晚期凋亡率、caspase-3和ZBP-89(陽性對照組除外)蛋白表達水平均顯著升高,表明阿魏酸可能通過下調STAT3蛋白磷酸化水平,上調caspase-3蛋白表達,進而促使vimentin蛋白下調。另外分子對接的分析結果也進一步證實了阿魏酸可作用于STAT3的SH2結構域,從而影響STAT3蛋白的磷酸化。盡管本研究結果也證實阿魏酸可明顯上調ZBP-89蛋白的表達,但與陽性對照結果不一致,提示阿魏酸對ZBP-89蛋白的上調可能與STAT3無關。
綜上所述,阿魏酸可能通過與STAT3蛋白磷酸化位點直接結合來抑制p-STAT3活性;并可通過STAT3依賴性途徑上調caspase-3蛋白表達,或可通過STAT3非依賴性途徑上調ZBP-89蛋白表達,進而下調vimentin蛋白表達,從而抑制HepG2細胞的增殖、侵襲與凋亡。
參考文獻
[ 1 ] SUNG H,FERLAY J,SIEGEL R L,et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2021,70(4):313.
[ 2 ] DAS U,MANNA K,ADHIKARY A,et al. Ferulic acid enhances the radiation sensitivity of lung and liver carcinoma cells by collapsing redox homeostasis:mechanistic involvement of Akt/p38 MAPK signalling pathway[J]. Free radical research,2019,53(9/10):944-967.
[ 3 ] EZHUTHUPURAKKAL P B,ARIRAMAN S,ARUMUGAM S,et al. Anticancer potential of ZnO nanoparticle-ferulic acid conjugate on Huh-7 and HepG2 cells and diethyl? ? ?nitrosamine induced hepatocellular cancer on Wistar albino rat[J]. Nanomedicine,2018,14(2):415-428.
[ 4 ] 音金萍,岳紫晨,卓少元. STAT3:慢性炎癥介導肝癌進程的關鍵分子[J].臨床肝膽病雜志,2020,36(4):948- 952.
[ 5 ] 謝金玲,卓少元. Vimentin在原發性肝癌發生發展及凋亡過程中的作用[J].中國腫瘤,2017,26(2):130-134.
[ 6 ] 孫志欣,張瑩.桔皮素對人肝癌HepG2細胞體外增殖和侵襲的影響及機制研究[J].中國藥房,2016,27(34):4800-4803.
[ 7 ] HENDRAYANI S F,AL-HARBI B,AL-ANSARI M M,et al. The inflammatory/cancer-related IL-6/STAT3/NF-κB positive feedback loop includes AUF1 and maintains the active state of breast myofibroblasts[J]. Oncotarget,2016,7(27):41974.
[ 8 ] CAMPANA L,LEWIS P J S,PELLICORO A,et al. The STAT3-IL-10-IL-6 pathway is a novel regulator of macrophage efferocytosis and phenotypic conversion in sterile liver injury[J]. J Immunol,2018,200(3):1169-1187.
[ 9 ] WU Y,DIAB I,ZHANG X,et al. STAT3 enhances vimentin gene expression by binding to the antisilencer element and interacting with the repressor protein,ZBP-89[J]. Oncogene,2004,23(1):168-178.
[10] WU Y,ZHANG X,SALMON M,et al. The zinc finger repressor,ZBP-89,recruits histone deacetylase 1 to repress vimentin gene expression[J]. Genes Cells,2007,12(8):905-918.
[11] SHIN S,SUNG B J,CHO Y S,et al. An anti-apoptotic protein human survivin is a direct inhibitor of caspase-3 and -7[J]. Biochemistry,2001,40(4):1117-1123.
[12] 卓少元,謝金玲.健脾益氣方含藥血清通過Caspase-3/Vimentin促進人肝癌MHCC-97H 細胞凋亡[J].中國實驗方劑學雜志,2016,22(24):161-166.
[13] SILVA K A,DONG J,DONG Y,et al. Inhibition of STAT3 activation suppresses caspase-3 and the ubiquitin-proteasome system,leading to preservation of muscle mass in cancer cachexia[J]. J Biol Chem,2015,290(17):11177- 11187.
[14] 湯浩,高慶劍,陸鋮,等.阿魏酸和異阿魏酸對HepG2細胞增殖及其細胞色素P450酶的影響[J].中草藥,2014,45(12):1726-1730.
[15] 朱全杰,段曉明,何蜜,等. HA轉hGM-CSF HepG2疫苗對IL-6誘導HepG2細胞EMT的影響及機制[J].湖南師范大學學報(醫學版),2016,13(6):4-7.
[16] KIM B,PARK B. Saffron carotenoids inhibit STAT3 activation and promote apoptotic progression in IL-6-stimula- ted liver cancer cells[J]. Oncol Rep,2018,39(4):1883- 1891.
[17] REDELL M S,RUIZ M J,ALONZO T A,et al. STAT3 signaling in acute myeloid leukemia:ligand-dependent and-independent activation and induction of apoptosis by a novel small-molecule STAT3 inhibitor[J]. Blood,2011,117(21):5701-5709.
[18] GOU Z,WANG D,ZHOU L. STAT3 protein expression profile and its clinical significance in hepatocellular carcinoma[J]. J Clin Hepatol,2013,29(7):520-524.
[19] ZHANG X P,JIANG Y B,ZHONG C Q,et al. PRMT1 promoted HCC growth and metastasis in vitro and in vivo via activating the STAT3 signalling pathway [J]. Cell Physiol Biochem,2018,47(4):1643-1654.
[20] XIONG S,WANG R,CHEN Q,et al. Cancer-associated fibroblasts promote stem cell-like properties of hepatocellular carcinoma cells through IL-6/STAT3/Notch signaling
[J]. Am J Cancer Res,2018,8(2):302-316.
(收稿日期:2021-03-01 修回日期:2021-05-19)
(編輯:唐曉蓮)

