多囊卵巢綜合征患者肥胖指標對胰島素抵抗的預測價值
董夢姣,張杉杉,李程,邱陽
多囊卵巢綜合征(polycystic ovary syndrome,PCOS)是育齡女性常見的生殖內分泌疾病,除引起持續排卵障礙,高雄激素血癥(hyperandrogenemia,HA)或高雄激素表現及超聲下卵巢多囊樣改變外,肥胖亦是PCOS常見臨床表現,PCOS患者肥胖發病率可達非PCOS人群的3倍[1],而且多為中心性肥胖,表現為內臟脂肪增加。目前臨床上衡量肥胖的常用指標有體質量指數(BMI)、腰臀比(WHR),但BMI與體脂百分比沒有線性關系,無法區分內臟與皮下脂肪,而WHR是準確反映內臟脂肪蓄積的最簡易指標[2-3]。此外,近年提出了與心血管疾病風險相關的反映內臟脂肪和脂肪組織功能障礙的性別特異性指標——內臟脂肪指數(visceral adiposity index,VAI),已被用于預測胰島素抵抗(IR)及代謝綜合征,而且在發展為明顯的代謝綜合征之前可檢測心臟代謝風險狀況[4-7]。IR是PCOS的重要病理生理基礎,研究認為內臟脂肪含量的增加可降低胰島素敏感性導致IR[8],而PCOS是否存在內臟肥胖僅通過簡單測量即可得知,所以采用簡單的肥胖指標是否可預測IR及其預測IR的能力上是否有差別有待研究。現比較WHR、VAI及BMI對IR的影響程度及預測價值,為臨床衡量內臟肥胖和預測IR提供簡易方法,報道如下。
1 資料與方法
1.1 一般資料 收集2018年11月—2021年3月中國醫科大學附屬盛京醫院診治的PCOS患者301例,以是否存在胰島素抵抗(HOMA-IR≥2.69)分為胰島素抵抗PCOS組(IR-PCOS組)251例和非胰島素抵抗PCOS組(NIR-PCOS組)50例。本研究經醫院倫理委員會批準,患者及家屬知情同意并簽署知情同意書。
1.2 病例選擇標準 (1)納入標準:確診的PCOS育齡期女性,診斷依據2018年PCOS診治專家共識[9]:月經稀發或閉經或不規則子宮出血是診斷的必須條件[月經稀發,月經周期35 d~6個月;閉經:繼發性閉經(停經時間≥6個月)常見,原發性閉經(16歲尚無月經初潮)少見;不規則子宮出血,月經周期或經量無規律性];同時符合下列2項中的1項:高雄激素表現或高雄激素血癥(痤瘡,多毛;高雄激素血癥依據總睪酮的測定);超聲表現為多囊卵巢(一側或雙側卵巢內直徑2~9 mm的卵泡數≥12個/卵巢,和/或卵巢體積≥10 ml)。(2)排除標準:垂體催乳素瘤、卵巢早衰、中樞性閉經、甲狀腺功能異常、非典型腎上腺皮質增生、皮質醇增多癥、分泌雄激素的卵巢腫瘤等引起高雄激素或排卵異常的疾病;存在嚴重肝腎功能不全、心腦血管疾病、腫瘤等疾病;長期應用激素類及影響糖脂代謝藥物。
1.3 觀測指標與方法
1.3.1 臨床資料收集:詳細詢問患者病史,收集病程、月經類型等一般情況,并由專人測量身高、體質量、腰圍、臀圍,并計算BMI=體質量(kg)/身高(m)2,WHR=腰圍/臀圍。實驗室檢查空腹血糖(FPG)、空腹胰島素(FINS)及三酰甘油(TG)、膽固醇(TC)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)。
1.3.2 PCOS相關激素指標測定:患者于月經來潮第3~5 d,禁食12 h采取肘靜脈血2 ml,分離血清,采用化學發光免疫檢測法測定睪酮(T)、游離雄激素指數(FAI)、性激素結合球蛋白(SHBG)、黃體生成素/卵泡刺激素(LH/FSH)。
1.3.3 VAI、HOMA-IR指標測定:通過公式計算VAI=[腰圍(cm)/36.58+(1.89×BMI)]×[TG(mmol/L)/0.81]×[1.52/HDL-C(mmol/L)][10]。IR采用穩態模型評估胰島素抵抗指數(HOMA-IR)=(FPG×FINS)/22.5,HOMA-IR≥2.69定義為IR[11]。
2 結 果
2.1 2組臨床資料比較 2組年齡、病程比較差異無統計學意義(P>0.05),IR-PCOS組的FPG、FINS、HOMA-IR、TC、TG、LDL-C顯著高于NIR-PCOS組,HDL-C低于NIR-PCOS組(P均<0.05),見表1。
2.2 2組PCOS性激素相關指標比較 2組間睪酮水平、LH/FSH比值比較差異均無統計學意義(P均>0.05),IR-PCOS組的FAI顯著高于NIR-PCOS組,而SHBG水平顯著低于NIR-PCOS組(P均<0.01),見表2。
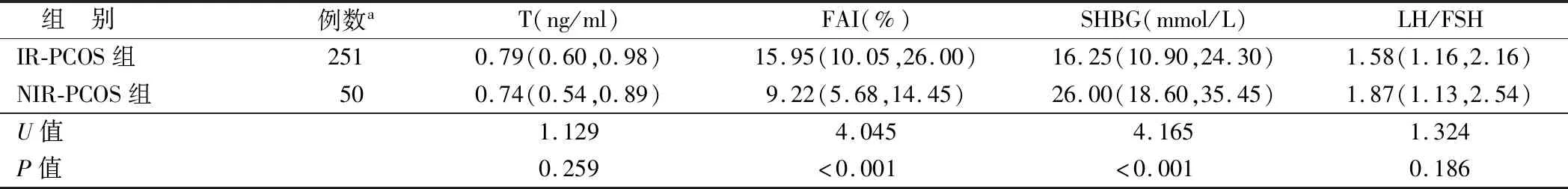
表2 2組PCOS患者性激素相關指標比較 [M(Q1,Q3)]
2.3 2組肥胖指標比較 IR-PCOS組的WHR、VAI、BMI均顯著高于NIR-PCOS組(P均<0.01),見表3。
2.4 PCOS患者胰島素抵抗影響因素分析 以是否存在胰島素抵抗為因變量,以2組間具有統計學差異的指標作為自變量均納入多因素Logistic回歸分析。結果得出WHR、BMI、VAI、FAI升高均為PCOS患者發生IR的危險因素,而HDL-C升高為IR的保護因素,見表4。
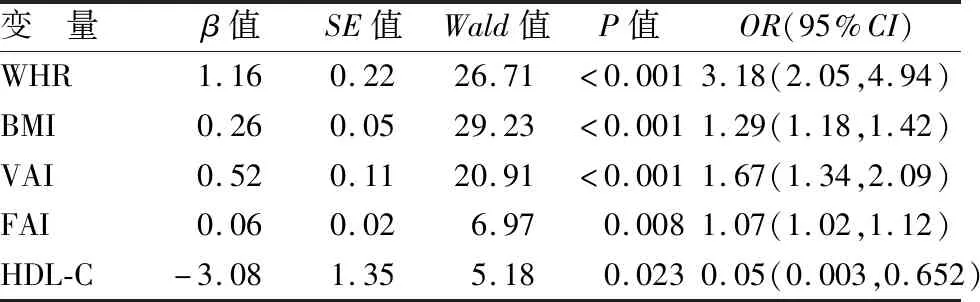
表4 多因素Logistic回歸分析PCOS患者胰島素抵抗的影響因素
2.5 肥胖指標預測PCOS患者胰島素抵抗的價值 繪制WHR、VAI及BMI預測胰島素抵抗的ROC曲線。以是否存在胰島素抵抗為因變量,將WHR、VAI及BMI納入ROC曲線分析,WHR、VAI、BMI預測IR的曲線下面積(AUC)分別為0.76(95%CI0.70~0.82)、0.79(95%CI0.71~0.86)、0.76(95%CI0.69~0.84),見表5、圖1。

表5 PCOS患者肥胖指標預測胰島素抵抗的價值
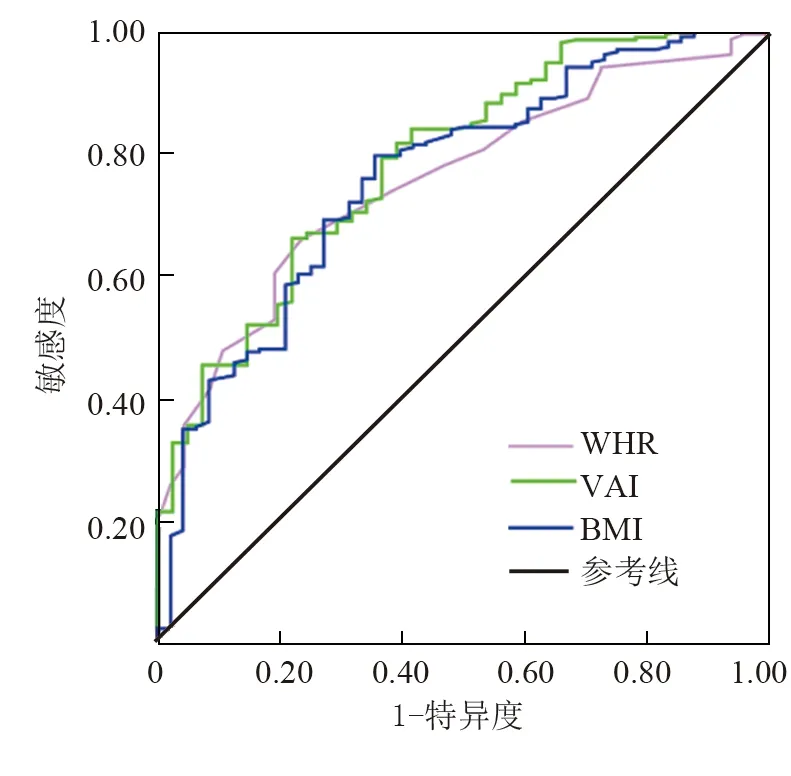
注:PCOS.多囊卵巢綜合征;IR.胰島素抵抗;WHR.腰臀比;VAI.內臟脂肪指數;BMI.體質量指數圖1 肥胖指標預測PCOS患者IR的ROC曲線
3 討 論
多囊卵巢綜合征(PCOS)是育齡期婦女最常見的生殖內分泌疾病,不僅影響排卵導致不孕,還對其長期健康產生負面影響,增加高胰島素血癥、2型糖尿病、高脂血癥及心血管疾病風險。IR是PCOS病理生理改變之一,雖不在PCOS診斷標準內,但在PCOS發病過程中起著至關重要作用。研究認為IR是PCOS患者發生代謝紊亂最初表現,因為IR可引起雄激素升高、血糖升高、脂代謝紊亂,大大增加了糖尿病和心血管疾病的患病風險[12]。IR與血脂異常關系密切[13],通過影響脂肪動員限速酶活性使TG水平升高,此外還加速HDL-C向非HDL-C轉化,導致LDL-C升高及HDL-C降低。PCOS患者血脂往往呈現典型致動脈粥樣硬化模式,即TC、TG 和LDL-C水平升高,而HDL-C 水平下降[14]。本研究在IR-PCOS組中呈現同樣的血脂變化,即TC、TG、LDL-C水平顯著高于NIR-PCOS組,HDL-C水平低于NIR-PCOS組,與既往研究結果相符[15]。HA是PCOS重要病理特征,體內過高的雄激素干擾卵泡正常發育,還可引起多毛、痤瘡等表現。IR是引起HA的重要原因,通過增強LH—卵巢軸,導致雄激素分泌增多,同時還可通過抑制肝臟合成SHBG而升高血清中游離T水平[16]。本研究結果發現,IR-PCOS組SHBG水平低于NIR-PCOS組,FAI水平顯著高于NIR-PCOS組,Logistic回歸分析表明,FAI影響惡化IR,均符合既往結論。但2組間LH/FSH、T水平差異無統計學意義,考慮與樣本量偏少有關,有待進一步擴大樣本研究。
內臟肥胖是PCOS重要特征之一,削弱胰島素敏感性導致IR,在PCOS的病理生理中起關鍵作用。內臟脂肪水解生成過多的游離脂肪酸也可促進胰島素分泌導致高胰島素血癥,進而引起IR[17]。內臟脂肪是分泌脂肪因子的重要場所,可誘導促炎性反應損傷,增加了PCOS炎性反應負荷,降低胰島素敏感性。因此,準確區分、衡量內臟脂肪對臨床預防IR引起的代謝紊亂有重要意義。WHR、VAI及BMI均是衡量肥胖的簡易指標,而WHR、VAI是衡量內臟肥胖的常用指標,均與胰島素抵抗關系密切。研究表明,腹型肥胖(WHR≥0.8)具有更高的FINS水平及HOMA-IR[18];VAI與FINS、HOMA-IR水平呈正相關[19]。本研究結果表明,IR-PCOS組WHR、VAI及BMI顯著高于NIR-PCOS組,與上述結論相符,且行Logistic回歸分析表明,WHR、VAI、BMI升高均為導致IR的危險因素。進一步行ROC曲線分析得出,WHR預測PCOS出現IR的截斷值為0.86,敏感度和特異度分別為0.660和0.776;VAI≥3.52預測PCOS患者出現IR的敏感度和特異度分別為0.662和0.781,提示VAI≥3.52時就應該注意PCOS患者的代謝管理;BMI預測PCOS出現IR的截斷值為26.25 kg/m2,敏感度和特異度分別為0.798和0.646。由此,可以看出三者對IR均有一定預測價值且預測能力相當,但Logistic回歸分析提示WHR對IR的影響程度更大(ORWHR>ORVAI>ORBMI),且WHR更容易獲得。因此,WHR更適合作為臨床上衡量內臟脂肪蓄積、預測IR的簡便方法。
本研究存在一些局限性:本研究為回顧性研究,部分患者數據資料不完整;此外,由于PCOS本身病理生理特點,就診的PCOS患者大多存在IR,導致分組后NIR-PCOS組數據偏少。期待更大樣本量,尤其是適量增加NIR-PCOS組樣本量進一步研究。
利益沖突:所有作者聲明無利益沖突
作者貢獻聲明
董夢姣:設計研究方案、實施研究過程及論文撰寫;張杉杉:實施研究過程,資料搜集整理;李程:實施研究過程,進行統計學分析;邱陽:提出研究思路,論文修改及審核

