右美托咪定基于CD38/cADPR通路對羅哌卡因致驚厥大鼠大腦氧化應激的保護作用
朱榮譽,向俊,李傳進,朱賢林,吳述軒
局麻藥物屬于一類多用于臨床麻醉和疼痛治療的常用藥物,研究顯示,即便局麻藥物在常用劑量范圍內使用,也會出現(xiàn)不同程度的不良反應,其中最為常見的為中樞神經毒性驚厥[1]。羅哌卡因屬于一種廣泛應用于臨床麻醉和疼痛治療的常用藥物,因其具有對神經系統(tǒng)、心臟毒性低等優(yōu)點在臨床上應用日益增多,但其所致的驚厥不良反應仍難以避免[2]。右美托咪定屬于一種新型的高選擇性α2-腎上腺素受體激動劑,其具有較好的鎮(zhèn)痛、鎮(zhèn)靜效果,且對呼吸無顯著影響。翟明珠等[3]研究證實,右美托咪啶可改善羅哌卡因致驚厥后小鼠負性情緒。基于此,現(xiàn)采用右美托咪定進行干預,以降低羅哌卡因所致驚厥大鼠腦損傷,為臨床預防和減輕羅哌卡因致驚厥毒性的研究提供參考,報道如下。
1 材料與方法
1.1 材料 (1)動物:SPF級雄性幼齡大鼠60只,購自國科賽賦(深圳)新藥研發(fā)科技有限公司,動物許可證號:SYXK(粵)2020-0231。體質量(42.63±2.68)g,在相對濕度30%~35%、溫度(23.8±1.5)℃下飼養(yǎng)1周,每日光照12 h。(2)試藥試劑:羅哌卡因(江蘇恒瑞醫(yī)藥股份有限公司生產),右美托咪定(江蘇恒瑞醫(yī)藥股份有限公司生產)。(3)儀器設備:光學顯微鏡(上海普赫生物科技有限公司生產,型號 79797979),熒光鏡(上海奔銀信息技術有限公司生產,型號 a73453434),穿梭箱(上海然哲儀器設備有限公司,型號RZ-shuttle)。
1.2 實驗方法 實驗經醫(yī)院倫理委員會審批同意,操作均嚴格參照動物實驗倫理要求相關規(guī)定進行。2020年1月—2021年1月于湖北省恩施土家族苗族自治州中心醫(yī)院麻醉科進行實驗。大鼠驚厥模型構建:隨機數字表法選取大鼠20只作為空白對照組,余40只參照王玲玲等[4]研究制備羅哌卡因所致的驚厥模型構建。建模前大鼠均禁水禁食,腹腔注射0.5%羅哌卡因33.8 mg/kg,給藥后20 min內行Racine驚厥分類為Ⅴ級,均表現(xiàn)為自由活動減少,逐漸轉變?yōu)闊o目的奔跑、躁動、肢體痙攣,直至全身強直;驚厥結束后抽搐停止,恢復自由活動為驚厥模型建立成功。最終37只大鼠成功建立羅哌卡因所致的驚厥模型,隨機數字表法分為模型組19只和右美托咪定組18只。右美托咪定組大鼠參照張金金等[5]研究中右美托咪定減少羅哌卡因所致神經毒性的最佳劑量,100 μmol/L右美托咪定2 ml腹腔注射,空白對照組、模型組均腹腔注射等劑量的生理鹽水。
1.3 觀察指標與方法
1.3.1 學習記憶能力測定:給藥結束后使用穿梭箱實驗測定大鼠學習記憶能力。將大鼠放置于打開的穿梭箱中預適應5 min,穿梭20次,每次間隙為10 s,光照、蜂鳴10 s,電擊10 s,電刺激電流為0.8 mA,重復3次,記錄大鼠對刺激條件的回避次數,回避次數越多說明大鼠學習記憶能力越強。
1.3.2 腦組織各項指標檢測:大鼠學習記憶能力測定完成后,常規(guī)麻醉大鼠后迅速取腦組織,分為3等份,其中2份做組織切片,1份在液氮中保存用于后續(xù)指標檢測。
1.3.2.1 病理組織學觀察 取大鼠腦組織切片1份,使用二甲苯脫蠟、梯度酒精脫水后行Nissl染色,使用中性樹脂封片,在光學顯微鏡下觀察各組大鼠腦組織病理變化。
1.3.2.2 腦細胞凋亡檢測 取大鼠腦組織切片1份,采用TUNEL法測定腦細胞凋亡情況。常規(guī)脫蠟脫水后使用蛋白酶K在室溫下孵育處理,孵育15~30 min后在溫度為37℃下繼續(xù)孵育15 min,使用PBS反復沖洗2次,滴加TUNEL反應混合溶液50 μl,在濕盒中37℃下孵育60 min,PBS反復沖洗3次,之后在熒光鏡下觀察大鼠腦細胞凋亡情況。
1.3.2.3 腦氧化應激程度測定 取液氮中保存的腦組織,制備為組織勻漿后采用酶聯(lián)免疫吸附試驗法(ELISA)測定大鼠腦超氧化物歧化酶(SOD)、丙二醛(MDA)含量,以評價大鼠腦氧化應激程度。
1.3.2.4 腦組織CD38/cADPR通路蛋白表達量測定 采用Western-blot法測定大鼠腦組織CD38/cADPR通路蛋白表達量。取液氮中保存的腦組織,提取組織總蛋白,取蛋白質樣本20 μg,電泳1.5 h后轉移至PVDF膜,在室溫下做封閉處理,之后分別加入1∶1 000 TBST給予稀釋的CD38/cADPR通路蛋白CD38、cADPR、Bax、iNOS、Bcl-2、Caspase-3一抗,使用1∶2 500的辣根過氧化氫酶標記的二抗在室溫下孵育處理,ECL顯色,使用Labwork凝膠圖像掃描所獲得膠片,以GAPDH為內參,計算淋巴細胞分化抗原CD 38(CD38)、環(huán)腺苷二磷酸核糖(cADPR)、BCL2-Associated X的蛋白質(Bax)、誘生型一氧化氮合酶(iNOS)、B淋巴細胞瘤-2基因(Bcl-2)、半胱氨酸蛋白酶-3(Caspase-3)蛋白表達量。
2 結 果
2.1 各組大鼠學習記憶能力比較 與空白對照組[條件刺激回避次數(9.56±2.16)次]比較,模型組[(2.65±0.10)次]學習記憶能力顯著降低,差異有統(tǒng)計學意義(P<0.05);與模型組比較,右美托咪定組[(5.98±0.86)次]學習記憶能力升高,差異有統(tǒng)計學意義(t/P=12.160/<0.001)。
2.2 各組大鼠腦組織病理學觀察 空白對照組大鼠腦組織中神經細胞排列較為整齊,內含豐富的尼氏小體,染色均勻,神經細胞合成蛋白質功能較強。模型組大鼠腦組織神經細胞損傷較為嚴重,排列紊亂,尼氏小體著色較淺。右美托咪定組大鼠腦組織神經細胞形態(tài)較為完整,與模型組比較,尼氏小體數量增加,染色均勻,腦損傷程度減輕,見圖1。
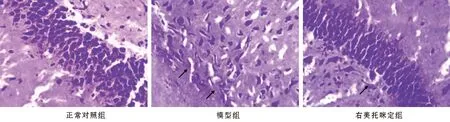
圖1 各組大鼠腦組織病理學觀察(Nissl染色,×400)
2.3 各組大鼠腦細胞凋亡率比較 與空白對照組比較,模型組腦細胞凋亡率升高,差異有統(tǒng)計學意義[(3.68±1.02)% vs.(28.63±4.69)%,t/P=23.235/<0.001];與模型組比較,右美托咪定組腦細胞凋亡率降低,差異具有統(tǒng)計學意義[(19.24±1.35)% vs.(28.63±4.69)%,t/P=6.084/<0.001],見圖2。
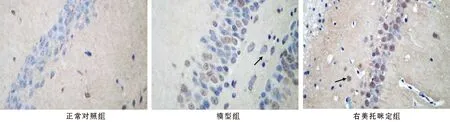
圖2 各組大鼠腦細胞凋亡率比較(TUNEL染色,×400)
2.4 各組大鼠腦組織氧化應激指標比較 與空白對照組比較,模型組腦組織SOD含量減少,MDA含量增加,差異均有統(tǒng)計學意義(P<0.01);與模型組比較,右美托咪定組腦組織SOD含量增加,MDA含量減少,差異均有統(tǒng)計學意義(P<0.01),見表1。
表1 3組大鼠腦組織SOD、MDA水平比較
2.5 各組大鼠腦組織CD38/cADPR通路蛋白表達量比較 與空白對照組比較,模型組腦組織CD38、cADPR、Bax、iNOS表達升高,Bcl-2、Caspase-3表達降低,差異均有統(tǒng)計學意義(P<0.01);與模型組比較,右美托咪定組腦組織CD38、cADPR、Bax、iNOS表達降低,Bcl-2、Caspase-3表達升高,差異均有統(tǒng)計學意義(P<0.01),見表2、圖3。
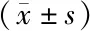
表2 3組大鼠腦組織CD38/cADPR通路蛋白表達量比較
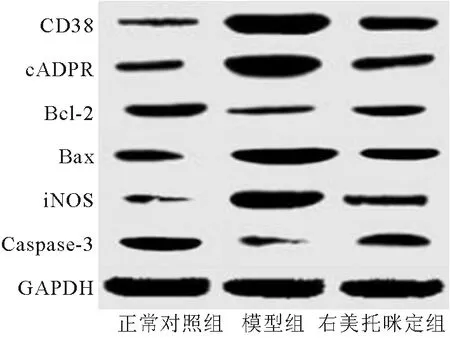
注:CD38.淋巴細胞分化抗原38;cADPR.環(huán)腺苷二磷酸核糖;Bcl-2.B淋巴細胞瘤-2基因;Bax.BCL2-Associated X的蛋白質;iNOS.誘生型一氧化氮合酶;Caspase-3.半胱氨酸蛋白酶-3;GAPDH.內參基因圖3 各組大鼠腦組織CD38/cADPR通路蛋白表達電泳圖
3 討 論
臨床麻醉中,羅哌卡因應用較為廣泛,但隨著其廣泛應用發(fā)現(xiàn),其所致的中樞神經系統(tǒng)、心血管系統(tǒng)毒性報道越來越多,其中以驚厥最為常見,引起驚厥的因素主要包括藥物使用過量或意外血管內注射,嚴重威脅患者的健康[6-7]。因此尋找有效修復羅哌卡因所致驚厥后腦損傷的有效干預措施尤為重要,基于此,本研究將右美托咪定應用于羅哌卡因所致驚厥模型大鼠的干預中,分析其是否具有羅哌卡因所致驚厥后保護腦組織的作用,為臨床上羅哌卡因所致驚厥的治療提供參考。
目前臨床上已有研究報道,羅哌卡因所致的神經毒性機制與細胞凋亡和氧化應激反應密切相關,研究顯示,羅哌卡因可致脊髓細胞凋亡,且呈劑量依賴性誘導神經毒性,在反應鞘內給藥后可導致脊髓細胞凋亡,且可改變脊髓中氧化應激相關因子SOD、MDA含量[8-9]。孫志華等[10]研究認為,羅哌卡因致大鼠脊髓神經毒性時Akt表達明顯上調,進而誘導脊髓細胞凋亡。羅昭等[11]研究認為,羅哌卡因應用后可導致神經細胞株PC12細胞凋亡。另外Yin等[12]研究認為,羅哌卡因與機體氧化應激密切相關。右美托咪定屬于一種選擇性α2-腎上腺受體激動劑,其可激動位于腦和脊髓的α2腎上腺素能受體,進而產生抑制交感神經、鎮(zhèn)痛、鎮(zhèn)靜的作用,并將其應用于臨床治療中[13-15]。目前臨床上已有多數研究將右美托咪定用于修復多種損傷中,認為右美托咪定具有腦保護作用[16-17]。本研究結果顯示,經右美托咪定干預后,學習記憶能力提高,驚厥大鼠腦細胞凋亡、氧化應激明顯被抑制,腦損傷被修復,此結果提示右美托咪定具有較強的腦保護作用,與上述研究保持一致。另外齊鵬等[18]研究認為,右美托咪定具有提高癲癇大鼠學習記憶能力和抑制神經細胞凋亡的作用,與上述研究結果一致。
研究顯示,CD38/cADPR通路在中樞神經系統(tǒng)的多種生理、病理條件下均發(fā)揮著重要作用,其中CD38屬于一種催產素釋放的重要調節(jié)因子,其具有調節(jié)認知行為的作用,在生長發(fā)育過程中其在大腦中高度表達,是星形膠質細胞發(fā)育和少突膠質細胞分化的積極調節(jié)因子[19]。而cADPR具有抑制紋狀體多巴胺受體下游mTOR信號通路的作用[20]。有學者在其研究中認為抑制CD38/cADPR可預防器官損傷;CD38/cADPR通路可介導氧化應激反應促進膿毒性腦損傷的發(fā)生,抑制此信號通路活性可明顯抑制氧化應激所產生的膿毒性腦損傷[21]。Zou等[22]研究顯示,CD38/cADPR通路參與羅哌卡因所致的驚厥毒性,其可引起腦氧化應激損傷,其結果表明CD38/cADPR通路能夠減輕羅哌卡因誘導的驚厥,減輕腦組織氧化應激損傷,起到腦保護作用。本研究結果顯示,驚厥大鼠此信號通路被激活,而經右美托咪定干預后此信號通路活性明顯被抑制,右美托咪定可能作用于CD38/cADPR通路,抑制通路活性發(fā)揮其抗羅哌卡因致驚厥的作用。但目前臨床上并無研究分析右美托咪定抗羅哌卡因致驚厥作用的相關機制,因此上述結果還需后續(xù)研究進一步分析驗證,以期望為臨床上右美托咪定在抗羅哌卡因致驚厥的應用提供參考。
綜上所述,右美托咪定具有抗羅哌卡因致驚厥的作用,其作用機制可能與抑制CD38/cADPR通路活性,抑制大腦氧化應激反應、腦細胞凋亡相關。
利益沖突:所有作者聲明無利益沖突
作者貢獻聲明
朱榮譽、向俊:設計研究方案,實施研究過程,論文撰寫及統(tǒng)計學分析;李傳進:實施研究過程,資料搜集整理,論文修改;朱賢林、吳述軒:提出研究思路,分析試驗數據,論文審核。

