兩種入肝血流阻斷法對原發性肝細胞癌效果及肝功能指標的影響
林福臻
(廣東省肇慶市第一人民醫院普外科二區 肇慶526040)
原發性肝細胞癌是我國常見的惡性腫瘤之一,嚴重威脅患者的生命安全[1]。手術切除原發病灶是治療原發性肝細胞癌常用的方式,但肝臟血液供應系統極其豐富,自身脈管結構極其復雜,術后容易復發,導致生存率降低[2]。因此,臨床上手術時多采用阻斷入肝血流的方式,目前普遍使用的是全入肝血流阻斷的Pringle阻斷法,但對術中操作要求較高,若操作不當會引起術后出現多種不良結果,不利于預后。隨著肝切除手術技術水平的提高,區域性血流阻斷技術因能夠精準阻斷患側肝門血供,減少術中出血及圍術期并發癥,在臨床應用明顯增多[3]。本研究重在探討兩種入肝血流阻斷法對原發性肝細胞癌治療效果及肝功能指標的影響。現報道如下:
1 資料與方法
1.1 一般資料 選取2017年12月~2019年1月收治的76例原發性肝細胞癌患者,根據隨機數字表法分為對照組和觀察組,每組38例。對照組男20例,女18例;年齡45~63歲,平均年齡(55.51±6.82)歲;腫瘤直徑2~14 cm,平均腫瘤直徑(9.21±3.06)cm。觀察組男19例,女19例;年齡44~63歲,平均年齡(55.50±6.81)歲;腫瘤直徑3~14 cm,平均腫瘤直徑(9.24±3.07)cm。兩組患者一般資料比較無明顯差異,P>0.05。納入標準:符合《原發性肝癌規范化診治的專家共識》[4]中的原發性肝細胞癌診斷標準,術后病理證實;術前經影像學檢查明確腫瘤位置均位于一側肝葉;術前評估臟器功能及身體狀況可耐受。排除標準:已出現鄰近器官或遠處轉移者;患有精神疾病者;合并其他惡性腫瘤者。
1.2 手術方法 患者取仰臥位,常規建立氣腹,臍下約1 cm處置入10 mm穿刺器作為觀察孔,主操作孔盡可能與肝斷面方向一致,雙側肋緣下建立2~3個輔助操作孔。進行腹腔及肝臟探查,明確有無肝外轉移、病灶位置及可切除范圍,切肝過程中運用電凝噴灑功率80 W,聯合超聲刀予以離斷肝組織,較大管道予以縫合、結扎處理。對照組在腹腔鏡下以棉繩繞過肝十二指腸韌帶,棉繩兩端經過一細長硬質塑料管,從5 mm穿刺器引出體外,通過在體外收緊棉繩完成阻斷,阻斷血流15 min后松開5 min,重復直到手術結束。觀察組于患側肝門橫溝上緣緊貼Glisson鞘外用血管鉗向下分離肝門板,直角彎鉗由Glisson鞘后方穿出并帶入修剪后的8號輸液管,拉緊用以阻斷患側半肝入肝血流,阻斷從肝切開始至切肝完畢后松解。術后定期復查,觀察至術后1年。
1.3 觀察指標及評價標準 觀察并比較兩組患者肝功能、腫瘤標志物、半年復發率及1年生存率。肝功能:于術前、術后1個月采取患者空腹靜脈血5 ml,采用酶聯免疫吸附法(ELISA)檢測患者的丙氨酸氨基轉移酶(ALT)、天冬氨酸氨基轉移酶(AST)及總膽紅素(TBil)水平。腫瘤標志物:于術前、術后1個月采用英國朗道實驗診斷有限公司出品的Evidenceinvestigator生物芯片檢測儀對患者甲胎蛋白(AFP)、癌胚抗原(CEA)及磷脂酰肌醇蛋白聚糖(GPC)水平進行評價。復發:病理、影像學檢查提示腫瘤再次復發;腫瘤標志物水平明顯高于正常值。術后1年電話隨訪了解患者生存情況。
1.4 統計學方法 本研究采取SPSS22.0統計學軟件進行分析處理數據,計數資料以%表示,組間比較用χ2檢驗;計量資料以(±s)表示,兩獨立樣本間的比較用t檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 兩組肝功能比較 術前,兩組ALT、AST及TBil水平比較均無明顯差異,P>0.05;術后1個月,觀察組ALT、AST及TBil水平均較對照組下降明 顯,P<0.05。見表1。
表1 兩組肝功能比較( ±s)
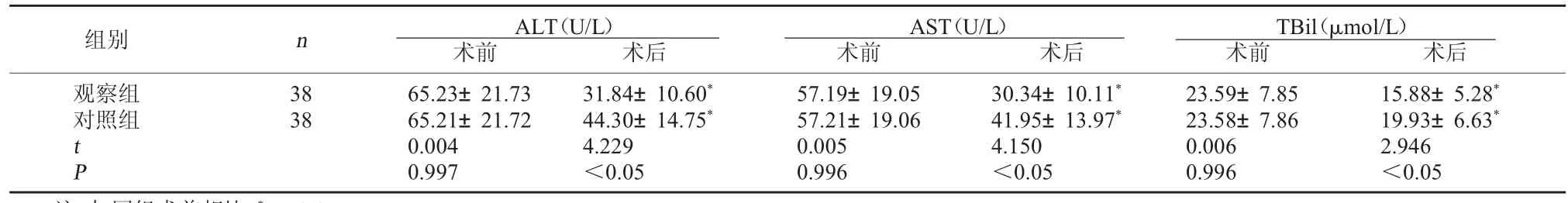
表1 兩組肝功能比較( ±s)
注:與同組術前相比,*P<0.05。
TBil(μmol/L)術前 術后觀察組對照組組別 n ALT(U/L)術前 術后AST(U/L)術前 術后38 38 t P 65.23±21.73 65.21±21.72 0.004 0.997 31.84±10.60*44.30±14.75*4.229<0.05 57.19±19.05 57.21±19.06 0.005 0.996 30.34±10.11*41.95±13.97*4.150<0.05 23.59±7.85 23.58±7.86 0.006 0.996 15.88±5.28*19.93±6.63*2.946<0.05
2.2 兩組腫瘤標志物比較 術前,兩組AFP、CEA及GPC水平比較均無明顯差異,P>0.05;術后1個月,觀察組AFP、CEA及GPC水平均較對照組下降明顯,P<0.05。見表2。
表2 兩組腫瘤標志物比較( ±s)
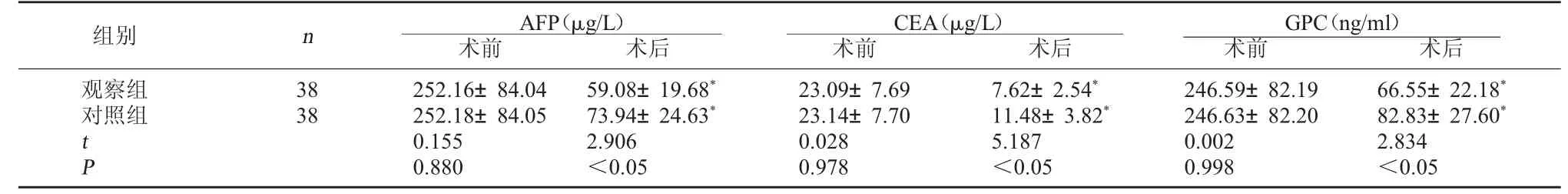
表2 兩組腫瘤標志物比較( ±s)
注:與同組術前相比,*P<0.05。
GPC(ng/ml)術前 術后觀察組對照組組別 n AFP(μg/L)術前 術后CEA(μg/L)術前 術后38 38 t P 252.16±84.04 252.18±84.05 0.155 0.880 59.08±19.68*73.94±24.63*2.906<0.05 23.09±7.69 23.14±7.70 0.028 0.978 7.62±2.54*11.48±3.82*5.187<0.05 246.59±82.19 246.63±82.20 0.002 0.998 66.55±22.18*82.83±27.60*2.834<0.05
2.3 兩組復發及生存情況比較 觀察組半年復發率明顯比對照組低,1年生存率明顯比對照組高,P<0.05。見表3。
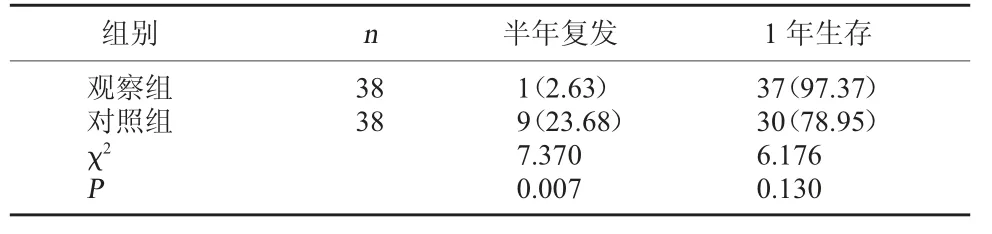
表3 兩組復發及生存情況比較[例(%)]
3 討論
肝臟是人體血流很豐富的器官[5],臨床上肝葉切除手術常需阻斷入肝血流,以防止難以控制的肝斷面出血,增加術中實施的難度,增加出血量、輸血量,而術中輸血是導致腫瘤復發的關鍵因素。因此,對于行原發性肝細胞癌切除術的患者,選擇更好的血流阻斷技術尤為重要。
全入肝血流阻斷肝切除術是在術中將門靜脈和肝動脈的入肝血流進行阻斷,在阻斷時間上有嚴格限制[6],長時間的阻斷肝臟缺乏血流會導致肝功能損害。隨著對肝臟解剖的深入了解及現代精準肝切除理念的不斷深入[7],區域性血流阻斷技術進入外科醫生的視野。此技術使切除范圍界限清晰的同時平穩術中血流動力學,并保留健側肝血流正常灌注,使得門靜脈血液回流通暢,不會引起門靜脈淤血,減少腸道細菌和毒素移位的發生,降低患者感染概率,減輕對其余肝臟的損害,并且使癌細胞的擴散減少,術后復發率較低[8]。區域性血流阻斷肝切除術能夠允許術者有更多時間對斷面進行精細處理,有利于減輕肝功能損害,促進術后肝功能的恢復。
ALT、AST及TBil水平是肝細胞損傷的敏感指標,可有效反映患者的病情進展,術后ALT、AST及TBil水平越低表明患者肝功能恢復越快。本研究結果顯示,治療后,觀察組ALT、AST及TBil水平均較對照組下降明顯,說明區域性血流阻斷技術較全入肝血流阻斷,能夠更好地促進肝功能的恢復。這與區域性血流阻斷技術在減少術中出血量及再灌注損傷的同時,還保證了健側肝功能的正常運行有關,能夠允許術者有更多的時間對斷面進行精細處理,有利于減輕肝功能損害,促進術后肝功能的恢復有關。
AFP、CEA及GPC等腫瘤標志物水平是評估原發性肝細胞癌手術效果及預后的重要指標。數值越高表明手術效果不良,預后不佳。本研究結果顯示,治療后,觀察組AFP、CEA及GPC水平均較對照組下降明顯,說明區域性血流阻斷技術可有效降低原發性肝細胞癌患者的腫瘤標志物水平。原因為:區域性血流阻斷技術不會引起門靜脈淤血,可減少腸道細菌和毒素移位的發生,會大大降低患者感染率,也可減少其余癌細胞的擴散,降低腫瘤標志物水平。本研究觀察兩種入肝血流阻斷法對肝癌患者半年復發率和生存率的影響,結果顯示觀察組半年復發率明顯比對照組低,1年生存率明顯比對照組高,說明區域性血流阻斷技術可有效降低肝癌復發率,提高患者生存率。綜上所述,區域性血流阻斷技術較全入肝血流阻斷技術對原發性肝細胞癌患者有更好的臨床效果,能夠促進肝功能的恢復,降低腫瘤標志物水平,減少復發,值得臨床推廣。

