例談表格模型在高中化學計算中的應用
遲宇前
(云南師范大學附屬中學呈貢校區 650500)
一、建立表格模型
若有AaBb和CcDd兩種物質(A、B、C、D為原子種類,a、b、c、d為原子個數),其中A、B、C、D原子的相對原子質量分別為為MA、MB、MC、MD.即可求出兩種物質中A、D原子個數比為a∶d;A、D元素質量比為aMA∶dMD;具體過程見表1.

表1 建立表格模型
本文中m代表質量,Mr代表相對分子質量,M代表摩爾質量,n為物質的量,N為微粒個數,NA為阿伏加德羅常量約為6.02×1023,V為體積,Vm為氣體摩爾體積,標況下氣體的摩爾體積約為22.4L·mol-1,p為壓強,T為溫度,ρ為密度,c為摩爾濃度.
二、表格模型的應用
1.利用n、N、NA、m、M、V、Vm之間的關系,求比值
高中化學教學中,利用n=m/M;n=N/NA;n=V/Vm之間的計算是高中化學計算中的重點和難點,由于公式間轉化錯綜復雜,學生計算過程中綜合性比較強,利用表格模型,可以幫助學生輕松、快速的理清思路,解決問題.
例1質量比為3∶2的O2和O3,下列說法正確的是( ).
A.分子數之比3∶2
B.原子數之比1∶1
C.同溫同壓下氣體的體積之比9∶4
D.物質的量之比4∶9
分析A中n=m/M,即物質的量之比為9∶4,因為分子個數與物質的量成正比,故分子個數比為9∶4,故A錯誤;B中一個O2分子中有2個氧原子,一個O3分子中有3個氧原子,故氧原子個數比為9×2∶4×3=3∶2,B錯誤;C中同溫同壓下氣體的體積與物質的量成正比,故體積比為9∶4,故C正確;D錯誤.故選C.建立表格模型,具體過程見表2.

表2 利用n、N、NA、m、M、V、Vm之間的關系,求比值
2.與阿伏加德羅定律及其推論有關的求比值問題
阿伏加德羅定律說的是同溫同壓氣體的體積與物質的量成正比.結合玻意耳定律和蓋·呂薩克定律可得出理想氣體狀態方程pV=nRT(R=8.314J·mol-1·K-1).利用理想氣體狀態方程決阿伏加德羅定律及其推論的相關計算是高中化學學習的重點.
(1)利用pV=nRT,求比值.
例2標準狀況下,關于22.4 L CO和17 g NH3的說法錯誤的是( ).
A.物質的量之比21
B.原子數之比1∶2
C.體積之比1∶1
D.分子數之比1∶1
分析A中,標況下22.4 L CO氣體的n=22.4L/22.4L·mol-1=1 mol;17g NH3的n=17g/17g·mol-1=1mol,物質的量之比等于1∶1,故A錯誤;B中一個CO分子中有2個原子,一個NH3分子中有4個原子,故原子個數比為1×2∶1×4=1∶2,B正確;C同溫同壓下氣體的體積與物質的量成正比,故體積比為1∶1,故C正確;D中分子個數與物質的量成正比,分子個數比為1∶1,D正確.故選A.建立表格模型,具體過程見表3.

表3 利用pV=nRT,求比值
(2)利用pM=ρRT,求比值.
例3在標準狀況下空氣的平均式量為29,相同條件下下列四種氣體中密度比空氣大的有____.
①H2②CO2③HCl ④Cl2
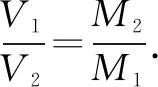
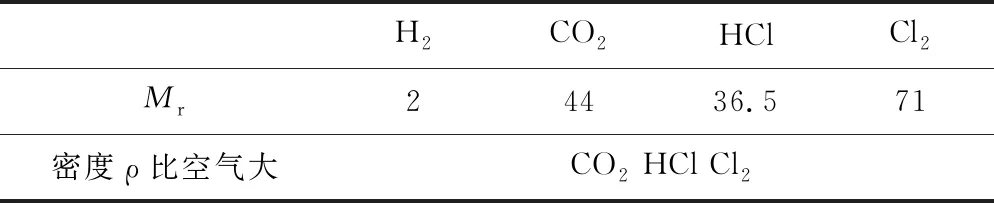
表4 利用pM=ρRT,求比值
3.利用c、n、V之間的關系,求比值
例4等體積的Na2SO4、KAl(SO4)2、Al2(SO4)33種溶液分別與等體積、濃度的BaCl2溶液完全反應,則3種溶液的摩爾濃度之比為:____.
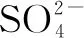

表5 利用c、n、V之間的關系,求比值
通過構建思維模型,把相關的問題合并為一類問題,實現“多題一解”.此方法還可用于化學反應速率,平衡移動,電化學等問題,同時也為其他復雜計算中尋找“多題一解”,提供了思路.

