妙用守恒思想巧解化學試題
馬英旭
(寧夏賀蘭縣回民高級中學 750200)
高中化學反應過程復雜、運算量大,學生常常束手無策,陷入題海戰術中不能自拔.新課程背景下,教師要引導學生注重化學思想的應用,從化學的本質規律出發,找準問題的切入點,巧妙的通過守恒思想解決復雜的化學問題,增強學生的學習信心,培養學生的化學思想意識,提高學生的綜合化學水平.
一、巧用原子守恒,解決化學試題
在一些化學試題的分析過程中,通過對反應物與生成物之間守恒關系的構建,能夠簡化運算過程,通過原子數量反應前后不變的原理巧妙的解決問題.將化學的守恒思想滲透到學生日常的學習和探究中,幫助學生有意識的強化化學知識結構,提升學生的化學思想意思,促進學生科學品質的發展.
例1在密閉的容器中有Na2O2和NaHCO3兩種物質,則二者的混合物加熱后消耗稀鹽酸的量與加熱前消耗稀鹽酸的量相比( ).
A.加熱后多 B.一樣多 C.加熱后多
D.等量的Na2O2和NaHCO3混合才會消耗一樣多
分析由于Na2O2和NaHCO3混合物加熱分解,因此容易給學生造成困惑,本題的解題關鍵是容器中鈉離子物質的量,不論Na2O2和NaHCO3混合物比例如何,其加熱前后鈉離子數量不變,與稀鹽酸反應最后會生成氯化鈉.根據鈉離子物質的量可以得到氯離子物質的量,從而得到消耗鹽酸的量,因此答案選B.如果試題用常規方法,計算Na2O2和NaHCO3的分解產物,然后再與稀鹽酸反應,得到的物質的量與未加熱前比較,會使學生的運算量增大,解題步驟增多,打擊學生的積極性,不利于學生良好化學思想的養成.
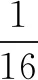

二、巧用元素守恒,解決混合問題
在高中化學一些混合物的問題中,常常沒有混合比例,這就要求學生能夠通過元素守恒思想,從化學反應前后元素不變的角度出發,將問題簡潔、輕松的解決.通過化學守恒思想的應用,也能夠讓學生理解化學微觀與宏觀的聯系,理解化學反應的本質內涵,提高學生的思維能力.在高中化學有關物質混合的試題中,巧用元素守恒,往往能夠起到意想不到的效果.
例3已知在KOH、K2O2混合物中,測得鉀元素的質量分數為70%,那么由此可得混合物中氫元素的質量分數為( ).
A.2.1% B. 1.3% C. 28.7% D. 27.9%
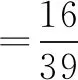
三、巧用電子守恒,解決復雜問題
化學反應的本質是電子的得失與原子的重新組合,在一些復雜、繁多的化學反應中,其得失電子是有跡可循的,根據電子守恒思想進行問題的分析,更容易抓住問題的本質,提高學生的解題效率.
例4已知銅與濃硝酸反應能夠生成一氧化氮、二氧化氮和四氧化二氮,現在將足量的銅放入濃硝酸中進行充分反應,將生成的氣體收集起來,然后與氧氣混合通入水中生成硝酸,共消耗標準狀況下氧氣1.68 L.現在往銅與濃硝酸反應后生成的硝酸銅溶液中加入5 mol/L 的氫氧化鈉,直到銅離子完成沉淀為止,共消耗NaOH的體積為( ).
A.2.30 mL B. 45 mL C. 60 mL D. 75 mL
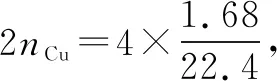
四、巧用物質的量守恒,解決綜合問題
在化學反應前后,化學元素的物質的量守恒,在一些看似沒有突破口的化學綜合問題分析中,學生要善于運用物質的量守恒,構建起化學反應前后的守恒關系,巧妙的應用到問題的解決過程中,往往能夠輕而易舉的解決問題.這樣,既有利于增強學生的化學守恒意識,也能夠提高學生的問題解決能力,增強學生的化學綜合素養.
例5將一定質量分數的硝酸銀溶液加入到KI溶液中完全反應,反應后測得溶液的質量不變,那么加入KI溶液中的硝酸銀溶液的質量分數是( ).
A.38.2 % B. 48.3% C. 50.6% D. 72.3 %

總之,高中化學解題過程中運用的守恒方法主要有物質的量、電子、質量、元素、原子守恒等,有時候還會用到幾種不同的守恒方法,在具體問題解決的過程中,教師要引導學生選擇正確的方法,這樣才能夠化繁為簡,迅速找到突破口,有效的解決化學問題,提高學生的解題能力,增強學生的自主學習能力.

