舌鱗狀細(xì)胞癌組織中FIP200與ATG7的表達(dá)水平研究
羅婕瑜 劉發(fā)煇 黃春英 姚金光


【摘要】 目的 通過免疫組化法檢測舌鱗狀細(xì)胞癌(tongue squamous cell carcinoma,TSCC)患者癌組織及癌旁組織中的200 kDA的家族相互作用蛋白(family interacting protein of 200 kDA,F(xiàn)IP200)、自噬相關(guān)基因7(autophagy related gene 7,ATG7)的表達(dá),并分析FIP200、ATG7在不同分組的TSCC中的表達(dá)情況,為TSCC的靶向治療提供前期實驗依據(jù)。
方法 選取2012年~2019年就診的36例TSCC手術(shù)患者的石蠟標(biāo)本用于FIP200免疫組化染色;34例TSCC手術(shù)患者的石蠟標(biāo)本用于ATG7免疫組化染色。以癌組織作為實驗組,同一切片的癌旁組織作為對照組,隨機(jī)選取鏡下視野求出面密度值作為FIP200、ATG7的表達(dá)情況。收集對應(yīng)患者的臨床資料并分析FIP200、ATG7表達(dá)與患者臨床病理特征的關(guān)系。使用 STRING網(wǎng)站構(gòu)建蛋白質(zhì)蛋白質(zhì)相互作用網(wǎng)絡(luò),分別分析與ATG7、FIP200相互作用最為密切的10個蛋白,使用生物信息學(xué)分析軟件FunRich對2個基因集分別進(jìn)行生物信息學(xué)富集分析。
結(jié)果 ATG7 及 FIP200在TSCC組織中的表達(dá)高于癌旁組織(P<0.05);ATG7在不同分化等級的癌組織中的表達(dá)水平不同,分化等級越高,ATG7的表達(dá)水平越低(P<0.05);與ATG7相互作用的10個蛋白分別是GABARAPL2、MAP1LC3B、BECN1、ATG10、GABARAP、ATG12、GABARAPL1、ATG3、MAP1LC3A和ATG5,ATG7作為RIGI/MDA5信號通路的負(fù)調(diào)節(jié)因子發(fā)揮作用(P<0.05);與FIP200相互作用的10個蛋白分別是BECN1、ULK2、ULK1、PIK3C3、ATG101、ATG13、ATG16L1、ATG14、PIK3R4和ATG5,F(xiàn)IP200主要參與細(xì)胞中ULK1ATG13FIP200復(fù)合體以及自噬小體的組成(P<0.001)。
結(jié)論 ATG7 及 FIP200 在TSCC組織中的表達(dá)高于癌旁正常組織;ATG7表達(dá)與TSCC的惡性程度有關(guān);ATG7作為RIGI/MDA5信號通路的負(fù)調(diào)節(jié)因子在生物學(xué)過程中發(fā)揮作用;FIP200參與ULK1ATG13FIP200復(fù)合體以及自噬小體的組成,對細(xì)胞自噬產(chǎn)生影響。
【關(guān)鍵詞】 FIP200;ATG7;TSCC;發(fā)病機(jī)制;生物信息學(xué)
中圖分類號:R730.2 文獻(xiàn)標(biāo)志碼: DOI:10.3969/j.issn.10031383.2021.06.003
Study on the expression of FIP200 and ATG7 in tissues of tongue squamous cell carcinoma
LUO Jieyu1, LIU Fahui2, HUANG Chunying1, YAO Jinguang1▲
(1. Department of Stomatology, 2. Department of Pathology, Affiliated Hospital of Youjiang Medical University for Nationalities, Baise 533000, Guangxi, China)
【Abstract】 Objective To detect the expressions of family interacting protein of 200 kDa (FIP200) and autophagy related gene 7 (ATG7) in tissues and paracancerous tissues of tongue squamous cell carcinoma (TSCC) patients by immunohistochemistry, and to analyze the expressions of FIP200 and ATG7 in different groups of TSCC, so as to provide a preliminary experimental basis for targeted treatment of TSCC.
Methods Paraffin specimens of 36 TSCC patients admitted to hospital from 2012 to 2019 were used for FIP200 immunohistochemical staining, and paraffin specimens of 34 TSCC patients were used for ATG7 immunohistochemical staining. Cancer tissues were used aexperimental group, paracancerous tissues in the same sections were used as control group, and the area density value of the field of vision under microscope was randomly selected as the expressions of FIP200 and ATG7. The clinical data of the corresponding patients were collected, and the relationship between the expressions of FIP200 and ATG7 anclinicopathological characteristics was analyzed. Proteinprotein interaction network was constructed by STRING website, and 10 proteins that interacted most closely with ATG7 and FIP200 were analyzed, respectively. FunRich (a bioinformatics analysis software) was used to conduct bioinformatics enrichment analysis on two gene sets, respectively.
Results The expressions of ATG7 and FIP200 in TSCC tissues were higher than those in paracancerous normal tissues (P < 0.05); the expression levels of ATG7 were different in cancer tissues with different grades of differentiation, the higher the grade of differentiation, the lower the expression level of ATG7 (P < 0.05); 10 proteins that interacted with ATG7 were GABARAPL2, MAP1LC3B, BECN1, ATG10, GABARAP, ATG12, GABARAPL1, ATG3, MAP1LC3A and ATG5, and as a negative regulator of RIGI/MDA5 signaling pathway, ATG7 played a role (P < 0.05); 10 proteins that interacted with FIP200 were BECN1, ULK2, ULK1, PIK3C3, ATG101, ATG13, ATG16L1, ATG14, PIK3R4 and ATG5, and FIP200 was mainly involved in the composition of ULK1ATG13FIP200 complex and autophagosome (P < 0.001).
Conclusion The expressions of ATG7 and FIP200 in TSCC tissues are higher than those in paracancerous normal tissues, and the expression of ATG7 is related to the malignant degree of TSCC. As a negative regulator of RIGI/MDA5 signaling pathway, ATG7 plays a role in biological processes. FIP200 is involved in the composition of ULK1ATG13FIP200 complex and autophagosome, and affects autophagy.
【Key words】 FIP200; ATG7; TSCC; pathogenesis; bioinformatics
過去40年中,全球范圍內(nèi)大多數(shù)地區(qū)舌鱗狀細(xì)胞癌(tongue squamous cell carcinoma,TSCC)的發(fā)病率以每年 0.4%至3.3%的速度增長,一些國家的發(fā)病率甚至增加了4倍。目前手術(shù)治療聯(lián)合放、化療是治療TSCC的首選方法,但TSCC患者的復(fù)發(fā)率與病死率仍居高不下,預(yù)后較差。因此,對TSCC的分子機(jī)制進(jìn)行進(jìn)一步研究,尋找TSCC的新的治療靶點具有重要意義。自噬是一種高度保守的溶酶體介導(dǎo)的保護(hù)細(xì)胞的過程。目前在許多腫瘤中都發(fā)現(xiàn)了自噬活性失調(diào)[1~2],調(diào)節(jié)自噬可以作為癌癥治療的有效干預(yù)策略[3]。細(xì)胞自噬與靶向抗癌藥物之間的作用機(jī)制十分復(fù)雜,關(guān)于TSCC自噬機(jī)制的研究可以進(jìn)一步推進(jìn)抗癌藥物的研發(fā),從而尋找一種有效地提高患者生存率的治療方法。既往研究發(fā)現(xiàn),200 kDA的家族相互作用蛋白(family interacting protein of 200 kDA,F(xiàn)IP200)、自噬相關(guān)基因7(autophagy related gene 7,ATG7)在腫瘤的發(fā)生、發(fā)展過程中扮演非常重要的角色。但它們在TSCC中的作用尚不清楚。本實驗通過研究FIP200、ATG7在TSCC組織中的表達(dá)情況,分析FIP200、ATG7在TSCC組織與癌旁正常組織中的表達(dá)差異及它們與臨床病理特征的關(guān)系,并通過生物信息學(xué)分析進(jìn)一步探討它們在舌癌中的作用機(jī)制,以期為TSCC的靶向治療及臨床診斷提供新的靶點。
1 材料與方法
1.1 實驗標(biāo)本來源
選取2012年~2019年于右江民族醫(yī)學(xué)院附屬醫(yī)院就診的36例TSCC手術(shù)患者的石蠟標(biāo)本用于FIP200免疫組化染色;34例TSCC手術(shù)患者的石蠟標(biāo)本用于ATG7免疫組化染色。納入標(biāo)準(zhǔn):所有患者均為初次治療;術(shù)前均未接受放療、化療;術(shù)前均未使用靶向抗癌藥物;原發(fā)病灶為TSCC;病理類型為TSCC;病理標(biāo)本切片經(jīng)HE染色后鏡下觀察,需同時包含有TSCC組織及癌旁組織。排除標(biāo)準(zhǔn):患者術(shù)前曾接受放化療、化療;術(shù)前曾使用靶向抗癌藥物;合并嚴(yán)重并發(fā)癥影響預(yù)后;TSCC為轉(zhuǎn)移病灶;病理類型為非鱗狀細(xì)胞癌或非舌部組織鱗狀細(xì)胞癌;患者病理標(biāo)本切片經(jīng)HE染色后鏡下觀察,壞死組織較多或不含有TSCC組織或癌旁組織。本研究經(jīng)右江民族醫(yī)學(xué)院附屬醫(yī)院倫理委員會審核批準(zhǔn)。
1.2 免疫組織化學(xué)染色
采用免疫組化法檢測FIP200及ATG7在TSCC組織及癌旁正常黏膜組織中的表達(dá),具體實驗步驟嚴(yán)格按試劑盒上的說明進(jìn)行(其中FIP200及ATG7抗體工作濃度均為 1∶100)。脫蠟至水、枸櫞酸鹽加熱抗原修復(fù),用 PBS代替一抗作為陰性對照,常規(guī) DAB 顯色,蘇木精對比染色,返藍(lán)后使用中性樹膠封片。
1.3 免疫組化結(jié)果評價方法
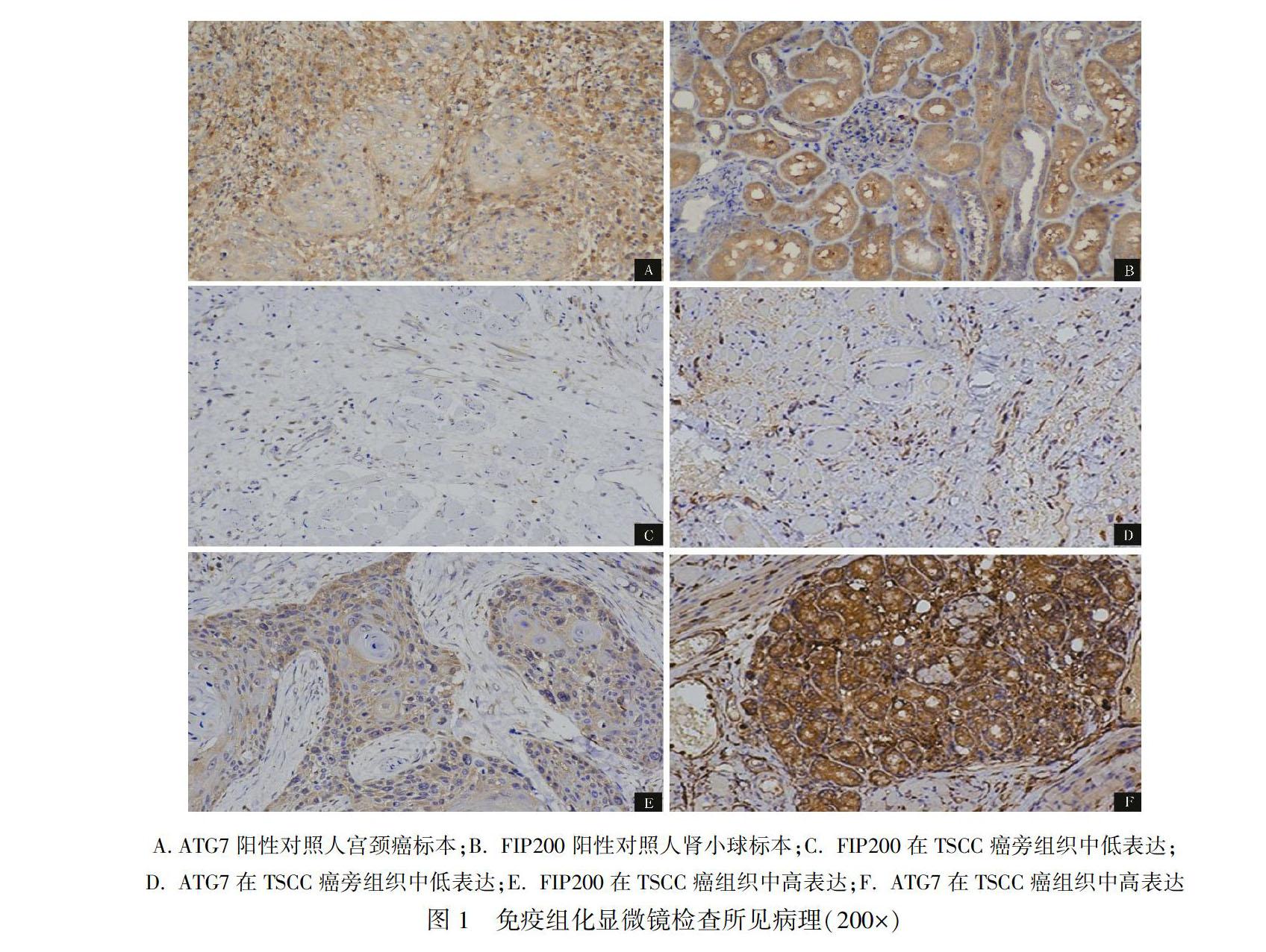
評價采用半定量法,在胞膜或胞質(zhì)中出現(xiàn)淡黃色即可記為陽性。每例標(biāo)本于低倍鏡下對組織病理切片作全面觀察,按照抗體使用說明書設(shè)置宮頸癌標(biāo)本為ATG7陽性對照組,腎小球標(biāo)本為FIP200陽性對照組。ATG7組及FIP200組內(nèi)每張切片至少隨機(jī)挑選3個200倍鏡下視野進(jìn)行拍照,其中包括癌組織和癌旁組織。使用光密度分析軟件:Imagepro plus 6.0選擇相同的棕黃色作為判斷所有照片陽性的統(tǒng)一標(biāo)準(zhǔn),并通過分析每張照片拍攝組織陽性的累積光密度值(IOD)和像素面積(AREA),并計算面密度(areal density),areal density=IOD/AREA,面密度值越大表明陽性表達(dá)水平越高,腫瘤免疫組化染色后面密度值結(jié)果根據(jù)中位數(shù)分為高低表達(dá)組。
1.4 統(tǒng)計學(xué)方法
使用SPSS 16.0統(tǒng)計學(xué)軟件進(jìn)行統(tǒng)計學(xué)分析。符合正態(tài)分布的計量資料使用均數(shù)±標(biāo)準(zhǔn)差(±s)表示,多個樣本均數(shù)比較采用單因素方差分析,組間比較采用配對樣本t檢驗,計數(shù)資料的組間比較采用四格表資料確切概率法,檢驗水準(zhǔn):α=0.05,雙側(cè)檢驗。在STRING11.0數(shù)據(jù)庫中設(shè)置最低相互作用分值為0.4,分別構(gòu)建ATG7與FIP200兩個基因的蛋白相互作用網(wǎng)絡(luò)。ATG7、FIP200蛋白相互作用網(wǎng)絡(luò)中的基因以P<0.05作為基因本體富集分析顯著性標(biāo)準(zhǔn)。
2 果
2.1 免疫組化結(jié)果分析
經(jīng)免疫組織化學(xué)法染色后鏡下觀察到:ATG7及FIP200主要表達(dá)于細(xì)胞漿。鏡下表現(xiàn)為細(xì)胞漿呈棕黃色或棕褐色染色,細(xì)胞核呈藍(lán)色。對比陽性對照組的結(jié)果(圖1A、B),在200倍鏡下每張切片隨機(jī)選取了至少3個視野進(jìn)行觀察,可以發(fā)現(xiàn)FIP200與ATG7均在癌旁組織中染色較淺(圖1C、D),在癌組織中細(xì)胞漿染色更深(圖1E、F)。
2.2 FIP200面密度值與臨床病理特征分析
實驗結(jié)果表明FIP200在TSCC組織的面密度值為(0.0384±0.0301),在癌旁正常組織中的面密度值為(0.0036±0.0028),兩組相比差異有統(tǒng)計學(xué)意義(t=6.906,P<0.001)。在Excel中使用MEDIAN函數(shù)計算面密度值中位數(shù),把標(biāo)本表達(dá)情況分為高表達(dá)與低表達(dá)兩組。統(tǒng)計檢驗結(jié)果顯示FIP200與患者性別、年齡、腫瘤大小、分化等級、淋巴結(jié)轉(zhuǎn)移、T分期及病理分期差異均無統(tǒng)計學(xué)意義(P>0.05),見表1。
2.3 ATG7面密度值與臨床病理特征分析
實驗結(jié)果表明ATG7在TSCC組織的面密度值為(0.1257±0.0960),在癌旁正常組織中的面密度值為(0.0208± 0.0172),兩組相比差異有統(tǒng)計學(xué)意義(t=6.272,P<0.001)。此外,統(tǒng)計分析結(jié)果表明ATG7在不同分化等級的癌組織中的表達(dá)差異有統(tǒng)計學(xué)意義(P=0.026),而在患者不同的性別、年齡、腫瘤大小、淋巴結(jié)轉(zhuǎn)移、T分期及病理分期間的表達(dá)差異均無統(tǒng)計學(xué)意義(P>0.05),見表2。進(jìn)一步分析表明中低分化的TSCC組織中ATG7的面密度值為(0.1918±0.0782),高分化組中ATG7的面密度值為(0.0941±0.0884),癌旁組織中ATG7的面密度值為(0.0208±0.0172),組間比較差異有統(tǒng)計學(xué)意義(F=34.51,P<0.0001),見圖2。
2.4 FIP200與ATG7基因富集分析結(jié)果
基因富集分析結(jié)果顯示,與FIP200相互作用的10個蛋白分別是BECN1、ULK2、ULK1、PIK3C3、ATG101、ATG13、ATG16L1、ATG14、PIK3R4和ATG5,它們主要參與了細(xì)胞中ULK1ATG13FIP200復(fù)合體以及自噬小體組成(P<0.001),見圖3和圖4;與ATG7相互作用的10個蛋白分別是GABARAPL2、MAP1LC3B、BECN1、ATG10、GABARAP、ATG12、GABARAPL1、ATG3、MAP1LC3A和ATG5,其作用主要作為維A酸誘導(dǎo)基因I/黑色素瘤分化相關(guān)抗原5(retinoic acidinducible gene i/melanoma differentiationassociated gene 5,RIGI/MDA5)信號通路的負(fù)調(diào)節(jié)因子發(fā)揮作用(P<0.05),見圖5和圖6。
3 論近年來,舌鱗狀細(xì)胞癌的發(fā)生發(fā)展和臨床治療越來越引起學(xué)者們的關(guān)注。盡管多學(xué)科聯(lián)合綜合序列治療逐漸在臨床中開展,如手術(shù)治療聯(lián)合術(shù)后放化療、靶向治療、免疫療法等。但TSCC因其自身的浸潤性強(qiáng)、易轉(zhuǎn)移、易復(fù)發(fā)等特點,手術(shù)切除腫物及淋巴結(jié)清掃術(shù)后患者生存率仍然偏低。探究TSCC的潛在分子機(jī)制,尋找有效的作用靶點對TSCC的治療具有重要意義。
自噬是在進(jìn)化過程中高度保守的、廣泛存在于真核細(xì)胞內(nèi)的一種溶酶體依賴性的降解途徑。自噬作為一種Ⅱ型程序性細(xì)胞死亡方式,與自噬相關(guān)蛋白一起在癌癥發(fā)生中起著至關(guān)重要的作用。抑制自噬能夠增強(qiáng)抗癌治療的效果,在腫瘤治療中針對自噬抑制與其他抗癌治療方法結(jié)合具有巨大潛在價值[4~5]。目前發(fā)現(xiàn),自噬可以促進(jìn)免疫細(xì)胞向癌床移動,其元件與惡性潛能相關(guān),并且預(yù)示著口腔鱗狀細(xì)胞癌的不良預(yù)后[6]。表明調(diào)節(jié)TSCC的自噬是一種潛在的治療策略。
FIP200、ATG7作為自噬相關(guān)基因在多種腫瘤中通過參與自噬調(diào)節(jié)發(fā)揮著重要作用。例如在ATG7與腫瘤的相關(guān)研究[7~10]表明,與正常組織相比,ATG7在人肺癌組織中過表達(dá)。而在肝細(xì)胞癌中,LncRNA通過海綿化MiR181a5p調(diào)節(jié)ATG7表達(dá)從而促進(jìn)自噬。此外,ATG7失活可以降低患者大腸癌癌前病變的風(fēng)險,敲除ATG7可以抑制致癌物誘導(dǎo)的致癌炎癥微環(huán)境,從而抑制腫瘤的發(fā)生[11]。這些研究都顯示了ATG7在腫瘤中的重要作用。本實驗使用免疫組化法證實ATG7在癌組織中的表達(dá)高于癌旁正常組織,這提示我們自噬活性在TSCC中可能得到增強(qiáng),進(jìn)一步的分析顯示ATG7在TSCC的中低分化標(biāo)本的表達(dá)水平高于高分化標(biāo)本,提示ATG7在TSCC中參與自噬并與TSCC的惡性程度有著密不可分的關(guān)系。既往研究顯示,F(xiàn)IP200介導(dǎo)的典型自噬是支持腫瘤細(xì)胞生長所必需的,在腫瘤發(fā)生的過程中起到關(guān)鍵作用[12]。本實驗證明了FIP200在癌組織中過表達(dá)。已有研究表明,F(xiàn)IP200過表達(dá)可促進(jìn)自噬,從而促進(jìn)腫瘤的發(fā)生和發(fā)展。不僅如此,在轉(zhuǎn)移癌中,F(xiàn)IP200蛋白表達(dá)水平高于原發(fā)癌[13],且在隨后治療后復(fù)發(fā)的轉(zhuǎn)移灶中其水平也升高,原發(fā)性乳腺癌中較高的FIP200 mRNA水平與較差的無病生存期顯著相關(guān)。我們的研究結(jié)果與目前已有的研究都顯示了FIP200在腫瘤中促進(jìn)腫瘤發(fā)生發(fā)展的重要作用,但其具體機(jī)制仍有待進(jìn)一步實驗證明。
為了進(jìn)一步探究ATG7與FIP200在TSCC中的潛在作用機(jī)制,本實驗使用在線生物信息學(xué)分析工具 STRING分別分析了與ATG7及FIP200相互作用最為密切的10個蛋白。了解與之特異性結(jié)合的這10個伴侶蛋白質(zhì)可較全面描述ATG7與FIP200的功能。隨后使用FunRich軟件分別對ATG7與FIP200進(jìn)行基因富集分析,通過分析表明FIP200參與了細(xì)胞中ULK1ATG13FIP200復(fù)合體以及自噬小體組成,進(jìn)一步證明FIP200是參與自噬發(fā)生的關(guān)鍵因子,這與GANLEY等人[14]的研究結(jié)論一致。過往研究表明,RIGI/MDA5信號通路參與抑制結(jié)腸癌、膠質(zhì)母細(xì)胞瘤、胃腺癌等多種腫瘤的發(fā)生過程[15~17],而我們的生物信息學(xué)分析和基因富集綜合分析發(fā)現(xiàn),ATG7作為RIGI/MDA5信號通路的負(fù)調(diào)節(jié)因子,表明ATG7可能作為癌基因促進(jìn)腫瘤的發(fā)生發(fā)展。這與本研究中ATG7作為癌基因在TSCC中高表達(dá)并與腫瘤分化程度相關(guān)的結(jié)論基本一致,也提示我們今后可以從RIGI/MDA5信號通路對ATG7的影響方面進(jìn)行研究。
綜上所述,F(xiàn)IP200、ATG7 在TSCC組織中呈高表達(dá),且ATG7與TSCC的惡性程度呈正相關(guān)關(guān)系,與患者腫瘤的組織學(xué)分級呈負(fù)相關(guān)關(guān)系,進(jìn)一步的基因富集分析說明這兩者是與自噬相關(guān)的關(guān)鍵基因,這些發(fā)現(xiàn)為TSCC自噬相關(guān)的發(fā)病機(jī)制的研究提供理論基礎(chǔ),為FIP200、ATG7作為腫瘤標(biāo)志物成為TSCC的臨床治療靶點提供了一定的研究依據(jù)。
參 考 文 獻(xiàn)
[1DIKIC I,JOHANSEN T,KIRKIN V.Selective autophagy in cancer development and therapy[J].Cancer Res,2010,70(9):34313434.
[2JONES S A,MILLS K H,HARRIS J.Autophagy and inflammatory diseases[J].Immunol Cell Biol,2013,91(3):250258.
[3GUO Y Y,ZHANG X,WU T H,et al.Autophagy in skin diseases[J].Dermatology,2019,235(5):380389.
[4GUO J Y,XIA B,WHITE E.Autophagymediated tumor promotion[J].Cell,2013,155(6):12161219.
[5WHITE E.Deconvoluting the contextdependent role for autophagy in cancer[J].Nat Rev Cancer,2012,12(6):401410.
[6SAKAKURA K,TAKAHASHI H,KAIRA K,et al.Immunological significance of the accumulation of autophagy components in oral squamous cell carcinoma[J].Cancer Sci,2015,106(1):18.
[7SUN S X,WANG Z H,TANG F,et al.ATG7 promotes the tumorigenesis of lung cancer but might be dispensable for prognosis predication:a clinicopathologic study[J].Onco Targets Ther,2016,9:49754981.
[8LVY J,ROMAGNOLO B.Autophagy,microbiota and intestinal oncogenesis[J].Oncotarget,2015,6(33):3406734068.
[9GUO J B,MA Y B,PENG X Q,et al.LncRNA CCAT1 promotes autophagy via regulating ATG7 by sponging miR181 in hepatocellular carcinoma[J].J Cell Biochem,2019,120(10):1797517983.
[10BALABURSKI G M,HONTZ R D,MURPHY M E.p53 and ARF:unexpected players in autophagy[J].Trends Cell Biol,2010,20(6):363369.
[11QIANG L,SAMPLE A,SHEA C R,et al.Autophagy gene ATG7 regulates ultraviolet radiationinduced inflammation and skin tumorigenesis[J].Autophagy,2017,13(12):20862103.
[12CHEN S,WANG C R,YEO S,et al.Distinct roles of autophagydependent and independent functions of FIP200 revealed by generation and analysis of a mutant knockin mouse model[J].Genes Dev,2016,30(7):856869.
[13HASHEMISADRAEI N,MLLERGREVEN G M,ABDULKARIM F W,et al.Expression of LC3B and FIP200/Atg17 in brain metastases of breast cancer[J].J Neurooncol,2018,140(2):237248.
[14GANLEY I G,LAM DU H,WANG J R,et al.ULK1.ATG13.FIP200 complex mediates mTOR signaling and is essential for autophagy[J].J Biol Chem,2009,284(18):1229712305.
[15GLAS M,COCH C,TRAGESER D,et al.Targeting the cytosolic innate immune receptors RIGI and MDA5 effectively counteracts cancer cell heterogeneity in glioblastoma[J].Stem Cells,2013,31(6):10641074.
[16WANG S Q,YANG X Y,YU X F,et al.Knockdown of IGF1R triggers viral RNA sensor MDA5 and RIGImediated mitochondrial apoptosis in colonic cancer cells[J].Mol Ther Nucleic Acids,2019,16:105117.
[17QU J,HOU Z H,HAN Q J,et al.Poly(I:C) exhibits an anticancer effect in human gastric adenocarcinoma cells which is dependent on RLRs[J].Int Immunopharmacol,2013,17(3):814820.
(收稿日期:2020-11-04 修回日期:2021-04-22)
(編輯:梁明佩)

