不同基因型腐爛莖線蟲群體雜交后代分子特征比較
倪春輝 李惠霞 李文豪 劉永剛 徐雪芬 韓變
(1. 甘肅農(nóng)業(yè)大學植物保護學院 甘肅省農(nóng)作物病蟲害生物防治工程實驗室,蘭州 730070;2. 甘肅省農(nóng)業(yè)科學院植物保護研究所,蘭州 730070)
腐爛莖線蟲(Ditylenchus destructor)廣泛分布于溫帶地區(qū):北美、歐洲、地中海(局部)、亞洲(局部),大洋洲、非洲也有少量報道,目前在中國、美國、加拿大、法國、德國和日本等25個國家均有發(fā)生和危害[1-2]。在我國,該線蟲嚴重危害甘薯[3]、馬鈴薯[4-5]和當歸[6]等作物,是農(nóng)業(yè)上重要的一種檢疫性線蟲[7]。研究表明,腐爛莖線蟲種內(nèi)分化嚴重,不同來源的腐爛莖線蟲在基因序列、耐寒性、致病性與形態(tài)特征等方面都存在差異,從不同寄主分離的群體雖存在致病力差異,尚不能劃分出生理小種[8]。林茂松等[9]發(fā)現(xiàn)鹽灘地區(qū)甘薯中分離的群體耐鹽性明顯高于低鹽的內(nèi)陸地區(qū)。王宏寶等[10]發(fā)現(xiàn)不同地理來源群體耐寒性有很大差異,部分群體可在零下70℃存活180多天。丁中等[11]發(fā)現(xiàn)河北地區(qū)腐爛莖線蟲群體對不同藥劑的抗藥性存在差異,抗藥性強的群體對涕滅威的抗性是敏感群體的3-4倍。王宏寶等[8]通過綜合分析,提出腐爛莖線蟲很可能是一個正處于快速進化過程中的復合種,或者為種內(nèi)不同生物型,或者是復合種下不同生物型。目前,該線蟲主要以ITS-rDNA序列差異來區(qū)分不同的基因型,對于致病型或生理小種的劃分尚缺乏足夠的科學依據(jù)。
宛菲等[12]發(fā)現(xiàn)我國甘薯腐爛莖線蟲群體核糖體DNA的ITS區(qū)序列存在明顯差異,可以劃分為A型和B型兩類;于海英等[13]發(fā)現(xiàn)在23個群體中,雖然A、B兩個類型ITS區(qū)序列差異較大,但28S rDNA D2/D3區(qū)序列片段長度一致,序列相似度達99%,差異較小。章淑玲等[14]研究發(fā)現(xiàn)腐爛莖線蟲ITS1-rDNA序列存在長(L)和短(S)兩種不同類型,長度差異與上述A、B類型相同,且差異主要表現(xiàn)在ITS1區(qū)。2011年,Subbotin等[15]研究指出,已報道的腐爛莖線蟲ITS-rDNA序列具有5種長度差異,且ITS1二級結(jié)構(gòu)差異主要出現(xiàn)在H9螺旋區(qū)域。根據(jù)H9螺旋結(jié)構(gòu)的有無及其差異,將70多個群體劃分為A-G 7個基因型。
腐爛莖線蟲種內(nèi)存在明顯的分化現(xiàn)象,本研究基于Subbotin等[15]基因型分化的研究,擬對腐爛莖線蟲不同基因型群體進行雜交,探索群體間是否存在生殖隔離,群體之間基因交流是否會引發(fā)后代遺傳變異,以期為該線蟲群體分化及致病性變異機制的研究提供理論依據(jù)。
1 材料與方法
1.1 材料
供試線蟲來源于馬鈴薯、當歸和黨參等寄主,采集自甘肅、黑龍江等地,詳細信息見表1。來源于當歸群體MXA2和來源于黨參群體WYA4的ITS二級結(jié)構(gòu)中H9螺旋結(jié)構(gòu)與Subbotin等[15]總結(jié)的存在差異,當歸群體ZXA1雖不具有H9螺旋結(jié)構(gòu),但與A基因型ITS1區(qū)H7/H8螺旋結(jié)構(gòu)存在差異,此3個群體均不能歸于A-G 7個基因型,暫定為N、H和K基因型。線蟲繁殖采用以茄鐮孢(Fusarium solani)平板培養(yǎng)物為載體和營養(yǎng)來源。
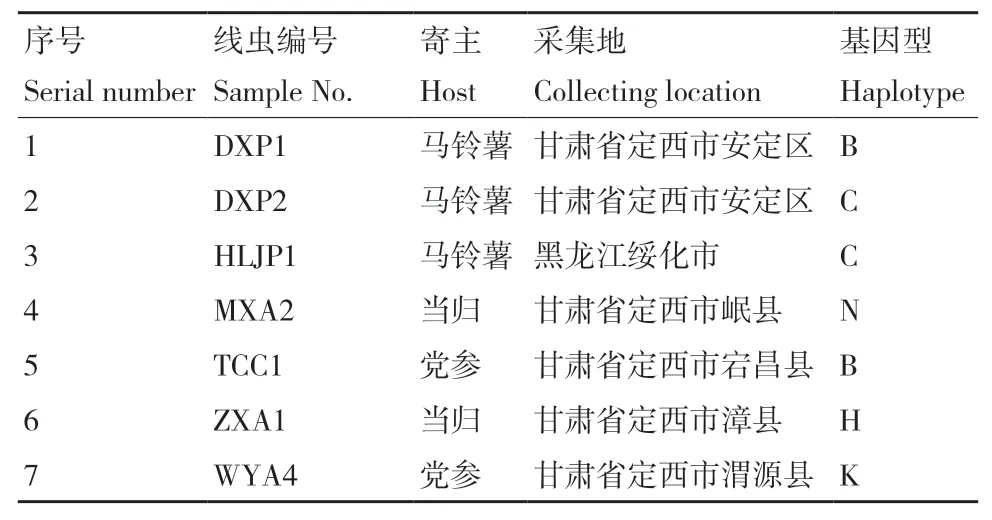
表1 供試腐爛莖線蟲群體信息 Table 1 Population information of D. destructor
1.2 方法
1.2.1 腐爛莖線蟲不同群體雜交組合 參照王宏寶等[16]和Webster[17]的方法,在長滿菌絲的PDA斜面滴一滴無菌水(約5 μL),用自制挑針挑取1條3-4齡幼蟲(母本)與另外一群體的5條雄蟲(父本),置于水滴中,輕輕放置于培養(yǎng)箱中培養(yǎng)。每個處理重復20管。以群體DXP1自交為對照,試驗雜交組合見表2。25℃下黑暗培養(yǎng)60 d后,采用改良貝曼漏斗法分離線蟲,統(tǒng)計線蟲數(shù)量,若線蟲數(shù)量≤6條(親本數(shù)量),則排除1條雌蟲和全為雄蟲(不統(tǒng)計),只統(tǒng)計幼蟲或者≥2條雌蟲。
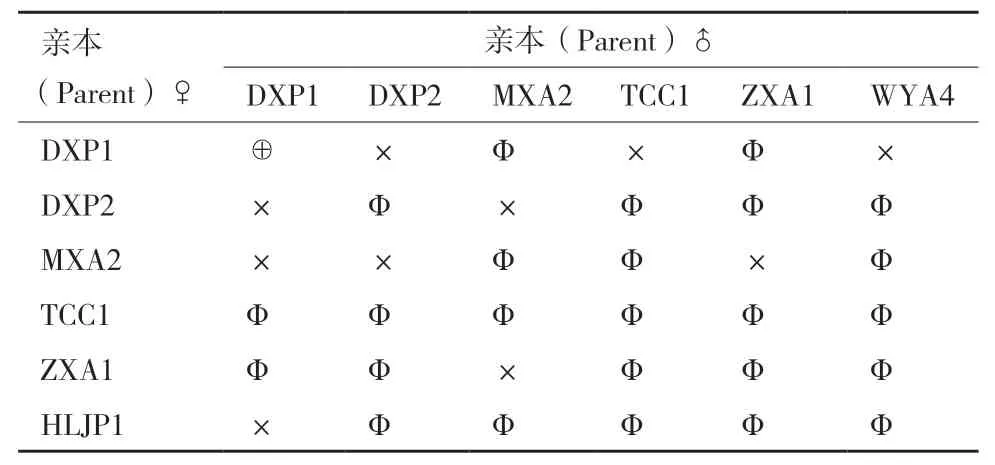
表2 腐爛莖線蟲群體雜交組合Table 2 Population hybrids combinations of D. destructor
1.2.2 ITS區(qū)PCR擴增與測序 線蟲DNA提取參照王江嶺等[18]方法略有改動。取單條線蟲于無菌水中清洗3次,挑入裝有10 μL WLB的200 μL PCR反應管中,離心后浸入液氮1 min,85℃水浴2 min,重復2次,隨后加入1 μL蛋白酶K(1 mg/mL),于PCR儀中65℃溫育1 h,95℃下10 min使蛋白酶K失活,以14 000 r/min離心5 min,最后于4℃保存?zhèn)溆谩?/p>
采用線蟲ITS區(qū)通用引物18S:5'-TTGATTAC- GTCCCTGCCC TTT-3'、26S:5'-TTTCACTCGCCGT- TACTAAGG-3'[19]與TW81:5'-GTTTCCGTAGGTG- AACCTGC-3'、AB28:5'-ATATGCTTAAGTTCAGCGGGT-3'[20],對線蟲ITS-rDNA基因進行PCR擴增。反應采用25 μL體系:上下游引物(10 μmol/L)各1 μL,2×San Taq Fast PCR Master Mix(with Blue Dye)12.5 μL(上 海 生 工),DNA模 板3 μL,ddH2O 7.5 μL。擴增程序:94℃ 4 min,94℃ 10 s,55℃ 20 s,72℃ 15 s,38個循環(huán),72℃延伸5 min后于4℃保存?zhèn)溆谩U增產(chǎn)物經(jīng)電泳檢測后送往北京擎科西安分公司測序,使用軟件SeqMan拼接測得的序列。
1.2.3 ITS-rDNA序列比對分析 使用軟件BioEdit對引物18S/26S與TW81/AB28擴增測序得到序列的進行比對,修正并統(tǒng)計引物TW81/AB28擴增產(chǎn)物的長度。并用軟件ClustalX比對分析親本和F1代序列。參 照Subbotin等[15]方 法,用 在 線 軟 件Mfold[21](http://www.unafold. org/mfold/applications/rnafoldingform.php)預測親本和雜交后代ITS-rDNA序列的RNA二級結(jié)構(gòu),并用Varna[22]與Photoshop cc2018對結(jié)構(gòu)進行美化與注釋,使用軟件BioEdit比對H9結(jié)構(gòu)序列。
1.2.4 ITS-RFLP 參考Subbotin等[15]方法,采用DdeI、Hinf I、Tru9 I(MseI)、SduI 4種 內(nèi) 切 酶,使用在線軟件Wbcuter 2.0(http://www.firstmarket.com/cutter/cut2.html)分析所得序列。
1.2.5 ITS-rDNA序列系統(tǒng)發(fā)育分析 參照Subbtion等[15]的方法,以BI法構(gòu)建系統(tǒng)發(fā)育樹。具體方法如下,用MAFFT軟件比對分析后,用DAMBE檢測飽和度,用軟件MrMTgui連接PAUP與MrModelTest進行模型選擇,最后使用Mrbayes以最佳模型構(gòu)建系統(tǒng)發(fā)育樹,用FigTree美化發(fā)育樹。
2 結(jié)果
2.1 不同來源腐爛莖線蟲雜交結(jié)果
不同來源腐爛莖線蟲群體11個組合生物學雜交結(jié)果顯示,群體內(nèi)自交處理(DXP1×DXP1)顯著大于其他處理。基因型內(nèi)雜交(TCC1×DXP1)與其他雜交處理無顯著差異,不同基因型群體雜交9個組合的F1代數(shù)量普遍較少。每個處理的20個重復中,只有少數(shù)重復發(fā)現(xiàn)F1代,且線蟲數(shù)量較少。B型群體DXP1自交F1代為18條/處理,其他處理線蟲數(shù)量均≤6條/處理,略小于自交處理。部分處理(WYA4×DXP1;HLJP1×DXP1;MXA2×DPX2;MXA2×DPX2;DXP2×MXA2)僅發(fā)現(xiàn)1條/處理(表3)。
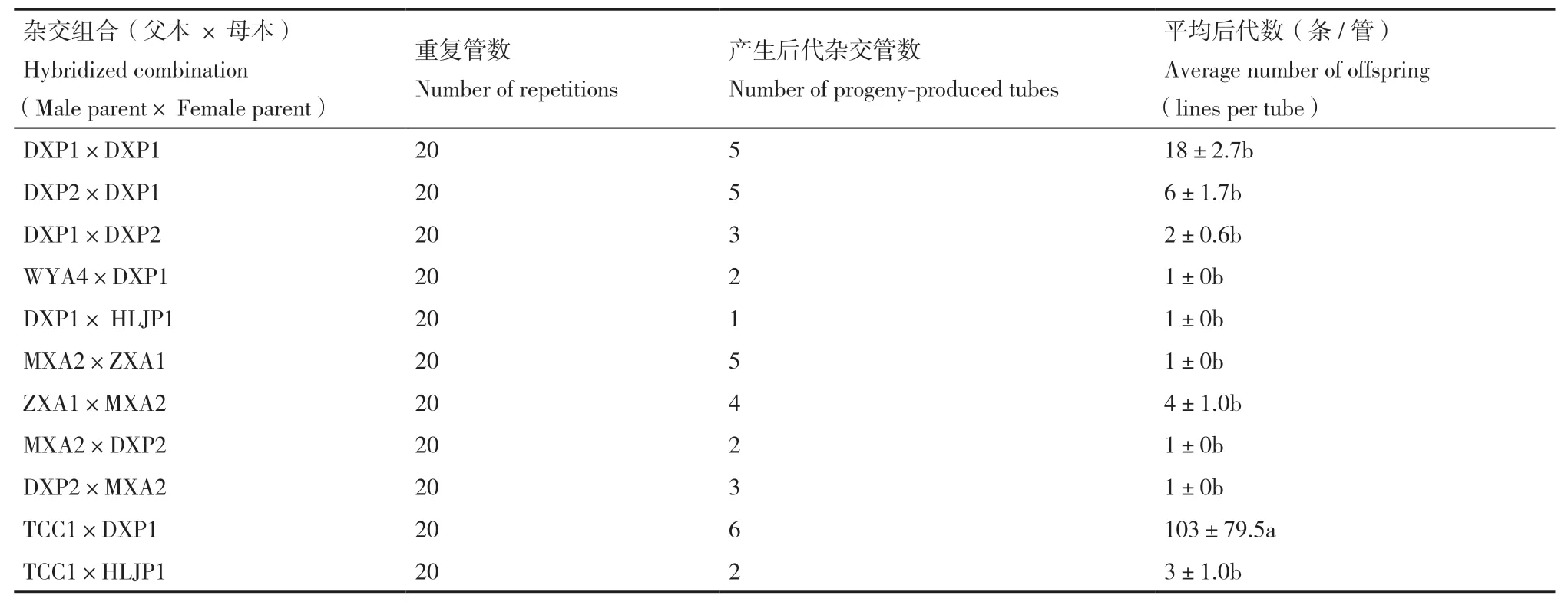
表3 腐爛莖線蟲群體生物學雜交結(jié)果Table 3 Biological hybridization results of D. destructor from different sources
2.2 腐爛莖線蟲雜交后代及親本群體ITS-rDNA序列比對分析
F1代數(shù)量較少,采用單條線蟲提取DNA,由于測序成功率較低,獲得5個雜交組合(DXP1×DXP1;MXA2×ZXA1;DXP2×DXP1;DXP1×DXP2;TCC1×DXP1)F1代ITS-rDNA序 列,長 度 均 為915 bp(表4)。B型自交(DXP1×DXP1)F1與親本序列相同,B型群體間雜交(TCC1×DXP1)F1與親本也無堿基差異。其他組合的F1代均與親本序列不同,差異主要表現(xiàn)在ITS1區(qū)。其中處理MXA2×ZXA1的F1代與親本差異最大,其親本序列相差164 bp,F(xiàn)1與父本MXA2(N型)序列堿基差異為38 bp,與母本ZXA1(H型)序列堿基差異為83 bp。雜交組合DXP2×DXP1、DXP1×DXP2后代與其親本DXP2(C型)相差24個堿基,與其親本DXP1(B型)相差1個堿基。結(jié)果表明親本間堿基數(shù)差異越大后代群體變異越大,后代與親本的堿基數(shù)差異越大。
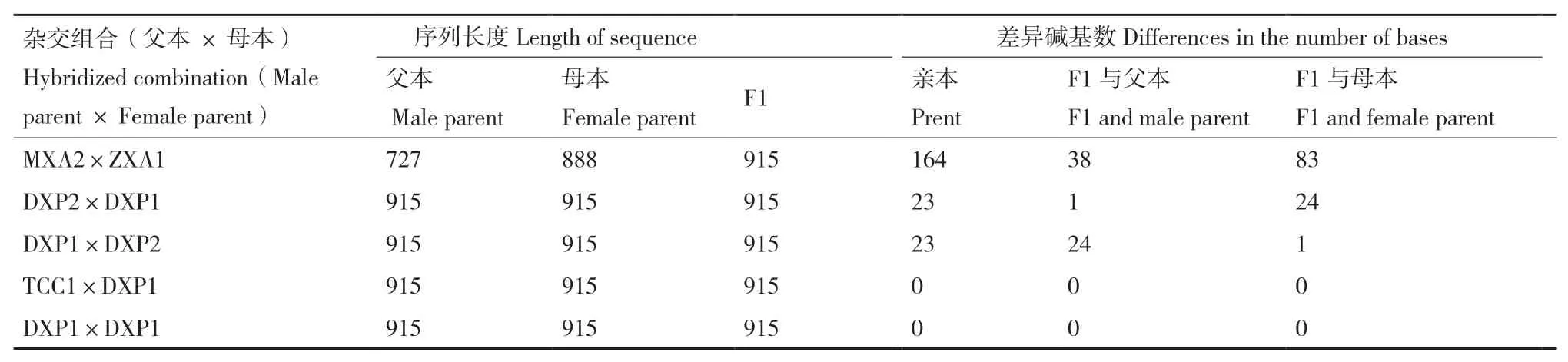
表4 不同來源腐爛莖線蟲雜交后代序列比對結(jié)果Table 4 Sequence alignment results of hybrid progeny of D. destructor from different sources
親本與后代ITS1區(qū)RNA二級結(jié)構(gòu)預測結(jié)果(圖1)表明,ITS1二級結(jié)構(gòu)比較保守,結(jié)構(gòu)大致相同,差異主要表現(xiàn)在螺旋H9區(qū)。對螺旋H9結(jié)構(gòu)和序列(圖2)比對發(fā)現(xiàn),群體MXA2×ZXA1雜交后代與親本差異最大。F1代與親本H9結(jié)構(gòu)和序列均存在差異,其父本MXA2(N型)具有H9結(jié)構(gòu),母本ZXA1(H型)不具有該結(jié)構(gòu),其后代結(jié)構(gòu)與DXP1(B型)相似,二者H9序列只差1個堿基。群體DXP1×DXP1、TCC1×DXP1與親 本H9結(jié)構(gòu)和序列均無差異;DXP2×DXP1、DXP1×DXP2結(jié)構(gòu)與DXP2(C型)相似,序列僅僅相差一個堿基。序列比對還發(fā)現(xiàn)有些F1代出現(xiàn)了新的變異,部分堿基序列與父本和母本的都不同。

圖1 不同來源腐爛莖線蟲雜交后代與親本ITS1二級結(jié)構(gòu)Fig. 1 Putative secondary structures of the ITS1 hybrid progeny and parental for D. destructoer with different origin

圖2 腐爛莖線蟲雜交后代與親本ITS1螺旋H9結(jié)構(gòu)差異與序列比對Fig. 2 Variations and alignment of helix H9 of ITS1 between hybrid progeny and parental of D. destructor
2.3 腐爛莖線蟲雜交后代及親本群體核糖體ITSRFLP分析
腐爛莖線蟲親本和雜交后代酶切結(jié)果見表5。結(jié)果表明,供試群體序列差異主要為長度不同。供試群體可以歸為兩類,Ⅰ類包括MXA2×ZXA1、TCC1×DXP1、DXP1×DXP1和DXP1, 其 中TCC1×DXP1和DXP1酶切片段數(shù)量和長度完全一致,MXA2×ZXA1與其他兩個組合片段數(shù)量相同,長度存在微小差異。Ⅱ類包括DXP2×DXP1、DXP1×DXP2、ZXA1、MXA2、DXP2,這些群體酶切片段數(shù)量相同,DXP2×DXP1、DXP1×DXP2和DXP2片段長度相同,與ZXA1和MXA2片段長度均有差異。這兩類差異主要為內(nèi)切酶SduI、Tru9I (MseI)酶切片段數(shù)量差異,Tru9I(MseI)將供試線蟲序列I類群體酶切為5個片段,將II類群體酶切為4個片段;SduI將I類群體酶切為4個片段,將II類群體酶切為3個片段。
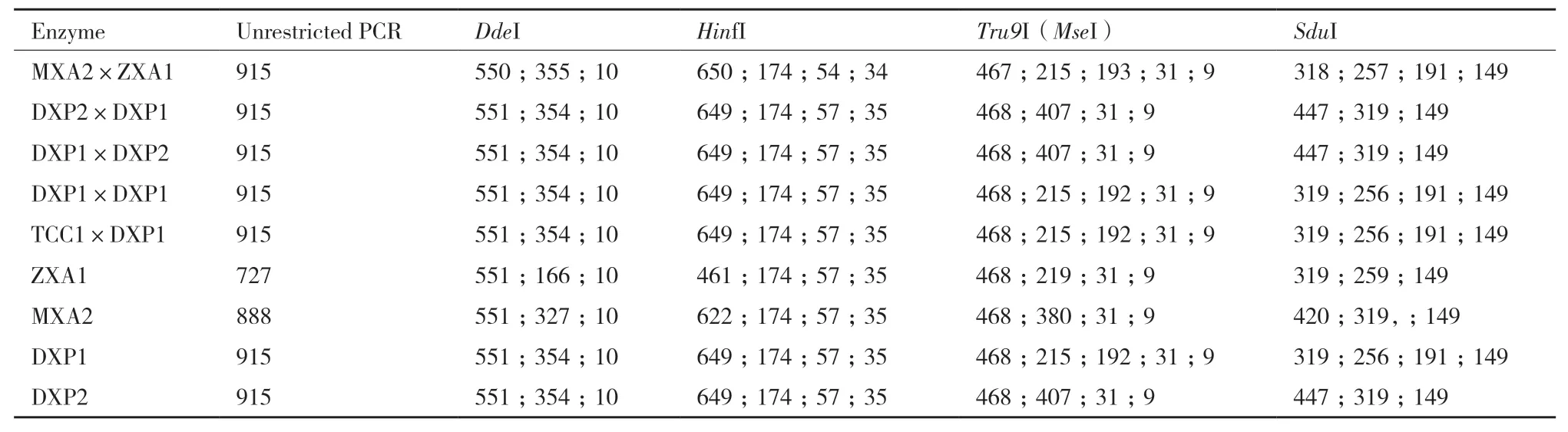
表5 腐爛莖線蟲親本和F1代酶切結(jié)果 Table 5 Parental and F1 enzyme digestion results of D. destructor
2.4 腐爛莖線蟲雜交后代及親本群體ITS-rDNA系統(tǒng)發(fā)育分析
以食菌莖線蟲為外群,采用BI法對測得的親本與雜交后代共9個群體ITS序列構(gòu)建系統(tǒng)發(fā)育樹(圖3)。9個群體可以分為兩支,DXP2、DXP1×DXP2和DXP2×DXP1聚為一支,親緣關(guān)系較近,其中DXP2與兩個F1代群體間存在一定的距離。MXA2、ZXA1、MXA2×ZXA1、TCC1×DXP1和DXP1(DXP1×DXP1)聚為一支,親緣關(guān)系較近,其中MXA2和ZXA1與其他群體存在一定的遺傳距離。4個不同來源群體雜交后代中MXA2×ZXA1的F1代、TCC1×DXP1的F1代與親本聚在一起,DXP1×DXP2的F1代、DXP2×DXP1的F1代 與 親本一方聚在一起。
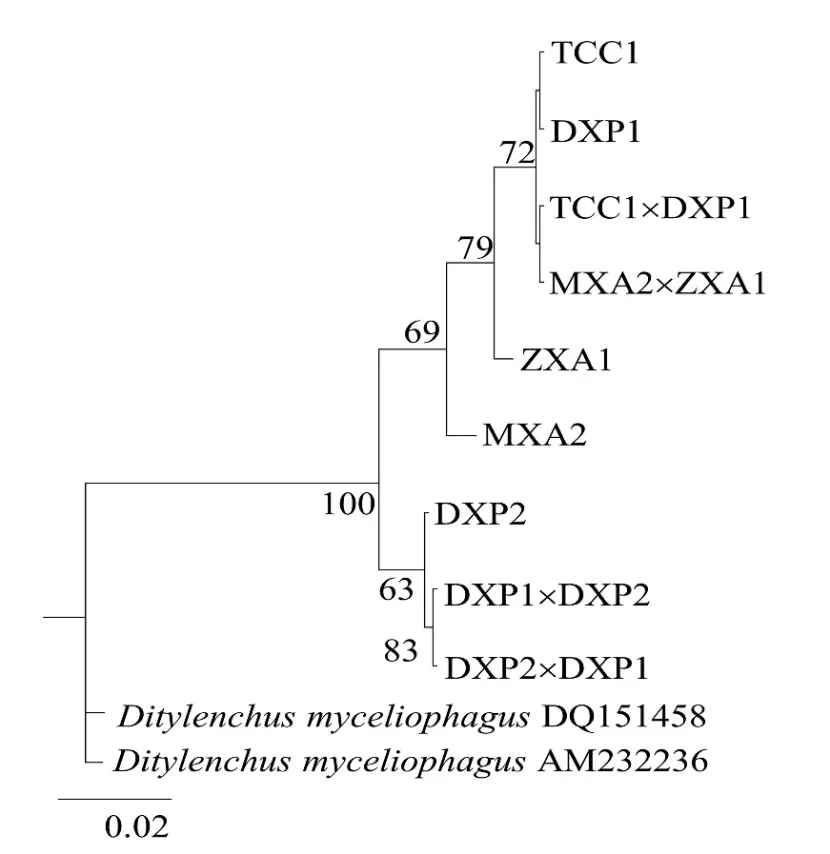
圖3 基于腐爛莖線蟲ITS-rDNA序列F1和親本的貝葉斯系統(tǒng)發(fā)育樹,最佳模型為GTR+GFig. 3 Phylogenetic tree from Bayesian analysis generated from the ITS-rRNA gene sequence dataset for D. destructor parental and F1 using the GTR+G model
3 討論
關(guān)于不同來源腐爛莖線蟲生物學雜交研究報道較少,國內(nèi)只有王宏寶等[16,23-24]開展了相關(guān)研究。王宏寶等[16]選用2個不同地理來源的甘薯群體,通過薯片平板雜交、薯條離心管雜交和薯塊切片打孔雜交等3種方法的對比發(fā)現(xiàn),薯塊切片打孔雜交法優(yōu)于其他方法,平均后代數(shù)為14.33條/皿,20個處理中有6個處理發(fā)現(xiàn)F1代。本試驗中,在線蟲培養(yǎng)過程中,發(fā)現(xiàn)來源于當歸和黨參的腐爛莖線蟲群體在甘薯很難繁殖,但所有群體均可在真菌上繁殖,故本試驗采用茄鐮孢菌為載體和營養(yǎng)來源,選取1條幼蟲與5條雄蟲進行雜交,以確保F1為雜交后代。由于受到試驗操作、線蟲自身情況以及線蟲活力等因素的制約,不同親本雜交后代數(shù)均比較少。本研究基因型內(nèi)自交(DXP1)后代數(shù)量多于王宏寶等[16]結(jié)果,但雜交后代數(shù)量除TCC1×DXP1(103條/處理)較多外,其他群體均較少,推測可能是所用線蟲群體差異較大所致。
Nei和Kumar等[25]研究表明,空間隔離、自然選擇、基因漂變和交配機會等因子會促進種群內(nèi)遺傳分化,增加亞種間的遺傳變異。不同地理群體間的空間隔離和基因流動的程度影響生殖隔離、遺傳變異和物種形成的潛力[26-27]。黃文坤等[27]發(fā)現(xiàn),腐爛莖線蟲群體的遺傳距離與地理距離呈正相關(guān),遺傳距離隨著地理距離的增大而增大。所以,空間隔離對基因交流具有一定的阻礙作用,降低或者阻斷基因交流,增強群體近緣交配程度,從而加速了種群內(nèi)亞居群間的遺傳分化。王宏寶等[16,23]對國內(nèi)來源于甘薯的A(短)和B(長)兩類基因型群體進行雜交,發(fā)現(xiàn)基因型內(nèi)群體均能雜交成功,基因型間部分群體存在生殖隔離。酶切結(jié)果表明,雜交F1代ITS序列與親本存在差異,并且發(fā)現(xiàn)同一基因型內(nèi)雜交后代繁殖力和致病力與自交后代存在差異,少數(shù)雜交后代致病力和繁殖力大于自交后代,但大多數(shù)群體致病力和繁殖力小于對照[24]。
本研究基于Subbotin等[15]的基因型分類,將一些不屬于A-G基因型的群體(MXA2、ZXA1和WYA4)與B基因型、C基因型進行雜交,發(fā)現(xiàn)B、C基因型正反交后代均接近于C基因型,N(父本)和H(母本)雜交后代與B基因較近,同一基因型內(nèi)雜交后代無變異。表明不同基因型間群體雜交會產(chǎn)生變異,所有群體變異區(qū)域均出現(xiàn)在H9螺旋結(jié)構(gòu),這與Subbotin等[15]的結(jié)果一致,且雜交后代可能會產(chǎn)生不同于親本的基因型。由于后代數(shù)量較少,未能對其雜交后代的形態(tài)、繁殖力和致病力變化進行分析,雜交后代基因型變化是否與其它生物學表型相關(guān)尚有待進一步探究。
本研究發(fā)現(xiàn)腐爛莖線蟲雜交F1代數(shù)量較少,但未發(fā)現(xiàn)生殖隔離,表明不同來源腐爛莖線蟲因空間隔離而使群體間親和度較低。不同基因型雜交后代與親本ITS序列出現(xiàn)差異,推斷群體間的基因交流會加大后代變異程度,從而產(chǎn)生新的基因型群體。腐爛莖線蟲種內(nèi)分化明顯,雖然本研究尚未證明基因變化與致病性相關(guān),但王宏寶等[24]研究表明,群體雜交可能產(chǎn)生強致病力的群體。因此,需要加強腐爛莖線蟲的檢疫,以減少群體間的基因流動。
4 結(jié)論
本研究采用1條幼蟲與5條雄蟲組合進行雜交。結(jié)果表明,產(chǎn)生F1代數(shù)量普遍較少,B型群體TCC1(父本)和DXP1(母本)雜交后F1代數(shù)量為103條/處理,顯著大于其他處理。B型群體DXP1自交F1數(shù)量為18條/處理,其他F1代線蟲數(shù)量均≤6條/處理。由于后代數(shù)量較少,11個F1代中,只獲得5個群體的ITS-rDNA序列,發(fā)現(xiàn)同一基因型內(nèi)雜交和自交所得F1代ITS-rDNA序列與親本無差異,不同基因型雜交所得F1代與其親本ITSrDNA序列均存在差異。不同基因型群體間雖親和度低,產(chǎn)生的F1代數(shù)量較少,但未發(fā)現(xiàn)生殖隔離。雜交后代的遺傳變異主要出現(xiàn)在ITS1區(qū)H9螺旋區(qū)域,并且親本之間差異越大,其后代與親本之間差異也越大。

