房顫射頻消融術所致獲得性肺靜脈狹窄2例并文獻復習
徐婷 劉娜 王曉娣 孔杰俊 林勇
獲得性肺靜脈狹窄(acquired pulmonary venous stenosis,APVS)常見于完全性或部分性肺靜脈畸形引流矯治術后并發癥,也可并發于特發性縱隔纖維化、胸部放療、惡性腫瘤浸潤、心包炎和組織胞漿菌病等。環肺靜脈電隔離術目的在于阻斷潛在的肺靜脈前庭部位的微折返和顫動樣傳導,是房顫患者射頻消融治療最常見的術式,曾被認為極少造成肺靜脈狹窄[1],但該并發癥一旦發生,臨床上可能表現為非特異性的呼吸系統癥狀,如果不及時進行干預治療,往往會導致狹窄進展為完全閉塞,值得持續關注[2-3]。現報道我院收治的兩例房顫射頻術后APVS的患者,以提高臨床醫生對該病的認識。
資料與方法
例1:患者男性,31歲,因“咳嗽、咳痰伴咯血6月”于2019年10月8日入院。患者6月前無明顯誘因出現咳嗽、咳痰;陣發性咳嗽,無明顯晝夜差別,咳少量白痰,伴咯血,多為痰中帶血,色紅,每日咯血2~3mL,并間斷發熱,陣發性胸悶;于外院行胸部CT示左肺滲出樣病灶,左側胸腔積液,予氣管鏡探查及引流胸水送檢,未見腫瘤及結核依據,反復多次予抗感染治療,復查左側胸腔積液有所吸收,但左下肺病灶吸收不良,且咳嗽、咳痰、咯血癥狀時有再發,擬“咯血查因”收入院。患者自發病來無胸痛及呼吸困難,食納及睡眠好,大小便正常。有“陣發性房顫”病史一年余,發作時感心悸,每月發作1~2次。2019年1月16日行房顫射頻消融術,術式為環肺靜脈電隔離,術后房顫未再復發,常規應用華法林抗凝治療3月。入院后查血常規、超敏C反應蛋白、血沉、D-二聚體,未見異常,腫瘤標記物:甲胎蛋白、癌胚抗原、鱗癌相關抗原、細胞角蛋白19片段、神經元特異烯醇化酶、胃泌素釋放肽前體、糖類抗原19-9、糖類抗原125未見異常;自身抗體初篩(含ANCA相關抗體,抗腎小球基底膜抗體)未見異常,血清G試驗、GM試驗、隱球菌莢膜抗原,均為陰性。行CT引導經皮左下肺病灶穿刺活檢,病理回示:“送檢肺組織纖維組織伴炎癥細胞浸潤,局部肺泡上皮不典型增生,腫瘤不除外”。動態觀察患者房顫射頻消融術前及術后胸部CT,見術后左下肺靜脈充盈缺損,分支輕度狹窄(見圖1、圖2)。肺靜脈造影后行經皮肺靜脈支架植入術(具體不詳),術后患者咯血癥狀改善,復查胸部CT病灶較前明顯吸收,術后隨訪六月,未再發生咯血。
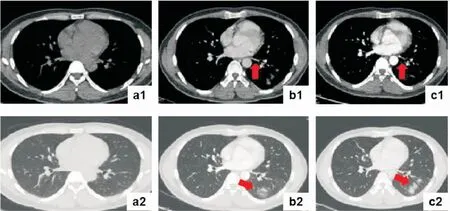
圖1 病例1射頻消融術前及術后胸部CT表現
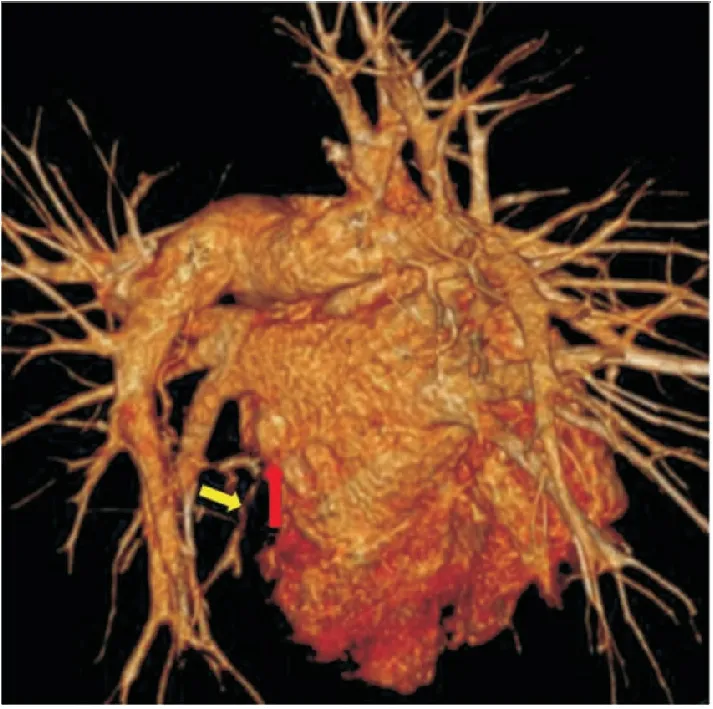
圖2 病例1射頻消融術后CTA三維重建
例2:患者男性,54歲,因“咯血1月”于2019年12月13日入院。患者1月前無明顯誘因出現咯血,每日1~4口,為鮮紅色血液或暗紅色血塊,無發熱、咳嗽、咳痰、胸悶、氣喘,于當地醫院查胸部CT,示左下肺滲出,予抗感染治療后病灶未見明顯吸收,癥狀無改善,門診擬“咯血查因”收入院。患者發病以來偶有腹瀉,為稀便,無發熱、胸悶、氣喘、呼吸困難,食納一般,睡眠尚可,小便正常。既往有“消化性潰瘍”病史十年,三月前有嘔血,予藥物治療后好轉。有“高血壓”病史2年,服用“培哚普利”,血壓控制良好。有“陣發性房顫”病史6月,2019年8月29日行房顫射頻消融術,術式為環肺靜脈電隔離;術后嘔血,考慮經食管超聲損傷,予禁食、胃腸減壓、抑酸、營養支持治療后好轉;術后予達比加群抗凝治療,2019年12月1日停藥。入院后,查超敏CRP、血常規、血沉未見明顯異常,凝血功能示:D-二聚體0.52mg/L,PT及APTT正常范圍。糞便常規:潛血弱陽性。予鹽酸小檗堿、雙岐桿菌、洛哌丁胺,對癥治療后好轉。查自身抗體初篩(含ANCA相關抗體,抗腎小球基底膜抗體)未見異常,血清G試驗、GM試驗、隱球菌莢膜抗原均為陰性。胸部CT增強示左下肺靜脈閉塞(見圖3、圖4),肺靜脈造影后行左下肺靜脈球囊擴張后植入支架(Boston Express LD支架),術后復查胸部CT左下肺滲出吸收,咯血癥狀好轉,術后隨訪四月,未再出現咯血。
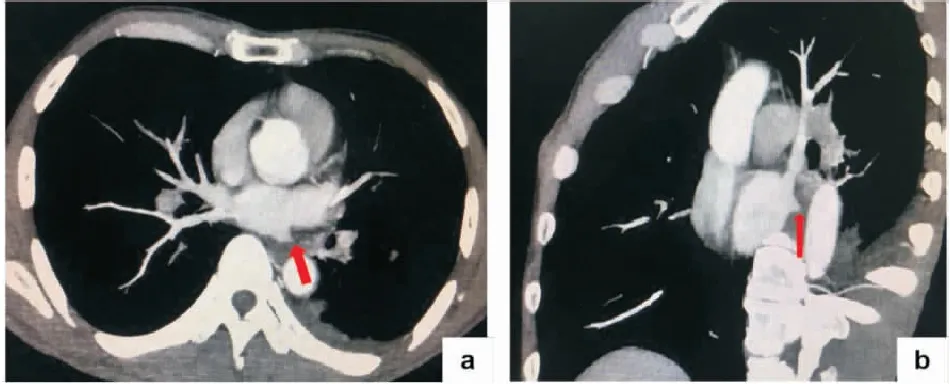
圖3 病例2射頻消融后胸部增強CTA
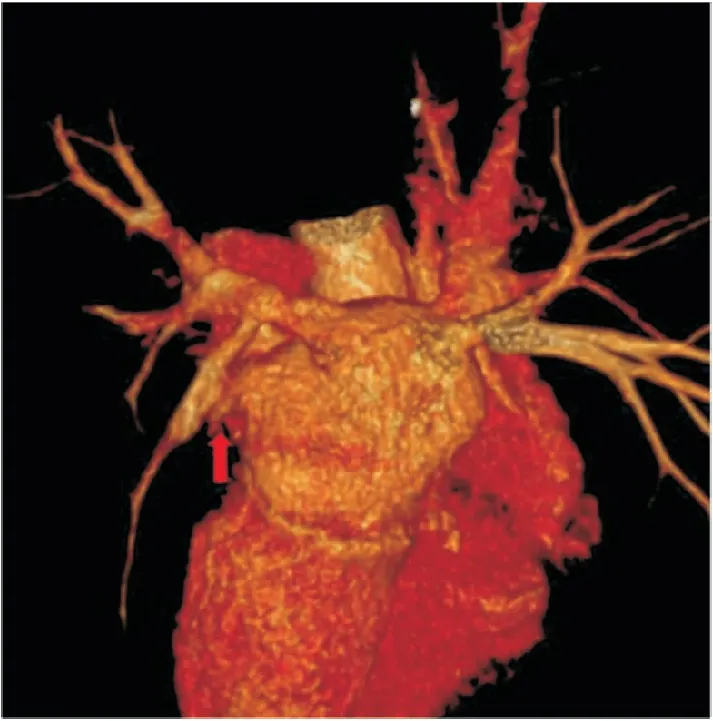
圖4 病例2射頻消融術后CTA三維重建
討 論
肺靜脈等異位興奮灶發放的快速沖動,在房顫(尤其是陣發性房顫)的發生中占有重要的地位。導管射頻消融,因其在維持竇性心律和改善生活質量等方面優于抗心律失常藥物治療,以A級證據被推薦于癥狀性陣發性房顫患者以及經至少一種Ⅰ類或Ⅲ類抗心律失常藥物治療后效果不佳或不能耐受者的治療[4]。對于心功能正常的年輕患者,進行房顫射頻消融需要充分的適應癥,PVS涉及多條靜脈時,會導致嚴重的不可逆肺動脈高壓并終末期右心衰竭,在極端情況下,甚至需要心肺移植[5]。近年的研究表明房顫射頻消融并不改善患者臨床預后[6],基于改善癥狀而進行房顫射頻消融術,更應嚴格把握適應證。
對于房顫消融后出現APVS癥狀的患者,常用橫斷面成像作為初始診斷的措施,并有助于指導進一步評估,肺靜脈長軸直徑與射頻消融前上相比減少50%或肺靜脈口橫截面積減小75%(對應于直徑減小50%左右)常被用于的診斷PVS的放射學標準[7-9]。有研究應用心臟磁共振測量186例患者房顫射頻消融前后肺靜脈口橫截面積,發現在第一次房顫消融后,約有三分之二的患者的肺靜脈孔面積變小,減少的程度呈正態分布,平均減少約5%~10%;有三分之一的患者肺靜脈孔面積較射頻消融前有所增大;在該研究中,僅有1例患者肺靜脈狹窄面積超過50%[10]。因此,如患者無臨床癥狀,可以不進行PVS的篩查。另有研究表明,在成功的房顫消融后,肺靜脈孔的內徑和左房體積均有所減小,在評估肺靜脈狹窄的直徑時,須將左房體積考慮在內[11]。
房顫術后發生APVS的機率不僅與患者本身肺靜脈的發育程度有關,也與射頻消融的術式、溫度、深度等相關。有研究發現射頻電流/低溫球囊擴張(RFC/CB)術后發生顯著肺靜脈狹窄的風險較低,輕度肺靜脈狹窄在標準劑量激光球囊消融術后發生的機率較高,在低溫球囊消融術后的機率較低[12]。采用單次短冷凍策略的第二代冷凍消融術相較于傳統的電隔離術發生肺靜脈狹窄的風險更低[13]。頭對頭研究發現,與射頻消融相比,低溫冷凍消融可減少左側肺靜脈的急性狹窄[14]。在房顫的射頻消融治療中可考慮應用低溫冷凍劑來替代傳統的射頻消融。
在無創方式(CT增強三維重建等)明確肺靜脈狹窄/閉塞后,如癥狀明顯,需行干預時,仍推薦進行侵入式的肺靜脈造影,約有三分之一的患者在狹窄/閉塞的肺靜脈中有殘存的微通道,經微通道球囊血管成形術或支架植入術可顯著緩解癥狀,尤其是支架植入,可以顯著降低了隨后再狹窄的發生率[15]。有研究回顧性評估了單一中心接受導管介入射頻消融治療的APVS患者,發現介入房顫消融術后APVS的總發生率為0.78%,APVS患者分別接受經皮經腔球囊成形術(PTA)和支架植入(81% vs 19%), 在中位隨訪6個月(四分位范圍:3~55個月)后,PTA術后再狹窄率為53%,支架植入后為19%(P=0.007 )[16]。梅奧診所的研究表明有多次房顫消融史和球囊擴張治療的患者發生肺靜脈再狹窄的風險最高;使用支架治療的肺靜脈再狹窄風險顯著降低(HR:2.84;95%CI:1.75至4.61;P<0.0001);僅用球囊擴張治療的靜脈,球囊壓力越高,再狹窄的風險越低(HR:0.87;95%置信區間:0.78~0.98;P=0.02)[17]。
在支架的選擇上,外周大直徑裸金屬支架(LD-BMS)的再狹窄率,僅為冠狀動脈藥物洗脫支架(DES)組的1 / 3,DES植入導致再狹窄率高[18]。肺靜脈支架后,支架內血栓形成導致的再狹窄也是臨床需要特別關注的問題。PVS支架植入術可迅速恢復肺血流,改善癥狀,再狹窄發生率長期較低。但如果房顫復發,特別是對于CHA2DS2-VASc評分大于2分者,血栓形成的高風險仍然存在[19]。在支架血栓閉塞后,可考慮應用牛心包補片以Prolene 5-0線連續縫合的方式進行肺靜脈增寬成形術[20],在嚴重、多發性PVS的情況下,應將手術治療作為一種治療選擇,進行常規討論[21]。
本案中兩例患者均有房顫射頻消融術史,所應用的術式為環肺靜脈電隔離,兩例均為術后三月發病,以咯血為首發癥狀,影像學表現為狹窄肺靜脈分支區域的滲出及實變樣病灶,發生機制為肺靜脈狹窄后產生肺淤血,分支肺小靜脈破裂,故在胸部CT上病灶多呈現現磨玻璃樣,可伴有小葉間隔增厚及胸腔積液。肺靜脈狹窄確診需行肺靜脈造影,但因該檢查有創,并不能作為咯血患者的初診檢查,在胸部CT平掃中如出現左房后方,肺靜脈開口區域與主動脈間的間隙增寬,同時患者有射頻消融、放療等病史,可行胸部CT增強CTA,并三維重建肺血管可予助診。房顫射頻消融治療后出現反復咯血,是嚴重肺靜脈狹窄的表現,本案中兩例患者,最終行肺血管造影明確診斷,并植入支架,術后癥狀緩解。正因為房顫射頻消融術技術日臻完善,經驗不斷增加,因房顫所致的APVS往往被臨床醫生所忽略。咯血患者常首診于呼吸科,加之患者胸部CT常有磨玻璃影、胸腔積液,常被誤診為肺部感染,咯血后隨血液吸收及經呼吸道咯出,胸部CT上常呈現病灶有所好轉的征象,從而導致反復進行抗感染治療。本案兩例患者所給予的經驗教訓有以下幾點:(1) 臨床醫師在規范化培訓的過程中,應廣泛了解各個專科的技術特點、原理,著重臨床技能的培養,更要重視病理學、病理生理學、解剖學等基礎知識在臨床具體病例中的應用。(2) 住院醫師需注意病史的采集,以及系統回顧,這些可以為診斷提供重要的線索。(3) 多學科會診可為患者的診斷及治療提供更好的方案,更有利于患者的預后。

