小豆幼苗對低溫脅迫的生理應激及烯效唑的緩解效應
項洪濤,李 琬,何 寧,劉 佳,王詩雅,王曼力,王彤彤,楊純杰
(1. 黑龍江省農業科學 院耕作栽培研究所,哈爾濱 150086;2. 黑龍江省農業科學院 植物保護研究所,哈爾濱 150086;3.黑龍江八一農墾大學 農學院,黑龍江 大慶 163319)
小豆(Vignaangularis)是喜溫喜光不耐冷、短日照作物,是我國重要的食用豆類作物之一,近年來種植面積逐漸增加。小豆對溫度敏感,最適生育溫度為20~24℃,低于該溫度即發生低溫脅迫甚至產生冷害[1]。低溫影響植物生長和代謝,使植株體內活性氧(reactive oxygen species,ROS)自由基大量積累,未被及時清除的ROS積累在植物體內,導致植物細胞膜脂過氧化傷害[2],影響作物正常的理化代謝功能和途徑。李海燕等[3]研究表明,低溫脅迫使H2O2含量顯著增加,低溫時間越長,增加趨勢越明顯。張愛冬等[4]也指出,隨著溫度降低,植物葉片H2O2含量呈上升趨勢,促使細胞膜透性增大,胞內電解質外滲,加劇膜質過氧化作用。項洪濤等[5]指出,低溫導致植物體內MDA含量增加,并隨脅迫強度和脅迫時間而增多。鄧化冰等[6]也得出相似結論,認為低溫導致植物葉片MDA含量顯著增加,加劇膜質過氧化程度,導致膜結構破壞,質膜透性加大,電解質外滲,從而影響葉片的生理生化機能。
烯效唑(uniconazole),簡稱S3307,是一種具有廣譜、高效、低毒、低殘留特點的植物生長延緩劑,S3307有提高作物產量的作用,常被用在調控作物生長發育、增強抗逆性的等方面[7]。相關研究表明,低溫條件下,S3307能顯著提高秋茄幼苗的超氧化物歧化酶(superoxide dismutase,SOD)和過氧化物酶(peroxidase,POD)活性[8],可以顯著提高水稻滲透調節物質含量[5],顯著降低綠豆ROS類物質以及丙二醛(MDA)的積累[9],顯著提高大豆的產量[10]。綜上可以看出S3307能夠有效緩解作物的低溫脅迫,但鮮有關于S3307提高小豆幼苗抗性的報道。葉片是小豆重要的光合器官,起到合成并供給同化產物的重要作用,當小豆受到低溫脅迫時,葉片生理代謝會受到阻礙并影響幼苗建植,最終導致產量下降。因此本試驗于幼苗期對小豆進行低溫處理,開展低溫脅迫及預噴施S3307對小豆葉片抗逆生理及產量的影響研究,旨在分析S3307緩解小豆苗期低溫的作用,豐富東北地區小豆抗冷技術工程體系,為小豆耐冷栽培、高產優質生產提供理論支持。
1 材料與方法
1.1 試驗材料
供試小豆品種為耐冷品種龍小豆4號和冷敏品種天津紅,材料由國家食用豆產業技術體系蕓豆育種崗位專家魏淑紅研究員饋贈。
供試植物生長調節劑為烯效唑(S3307),由黑龍江八一農墾大學化控研究中心提供。
1.2 試驗設計
試驗在黑龍江省農業科學院耕作栽培研究所盆栽場及人工氣候室內進行。采用盆栽方式,試驗用盆高30 cm、直徑25 cm,每盆裝自然風干壤土7.0 kg,播種后覆土200 g,每盆保苗15株(5穴×3株)。試驗用土取自哈爾濱市道外區民主鄉,土壤類型為草甸黑土。供試土壤的理化性質:土壤容重約1.72 g·cm-3,最大田間持水量約25.65%,有機質含量2.63%、全氮1.46 mg·g-1、全磷0.66 mg·g-1、緩效鉀325.7 mg·kg-1、堿解氮165.0 mg·kg-1、速效磷41.25 mg·kg-1、速效鉀156.7 mg·kg-1、土壤pH6.69。4月18日播種(陽光型人工氣候室內播種,哈爾濱地區4月中旬室外溫度相對偏低,不利出苗),每品種分別播種75桶,選取長勢均勻的樣本進行試驗,試驗共設6個處理,每個處理設3次重復,具體設計見表1。
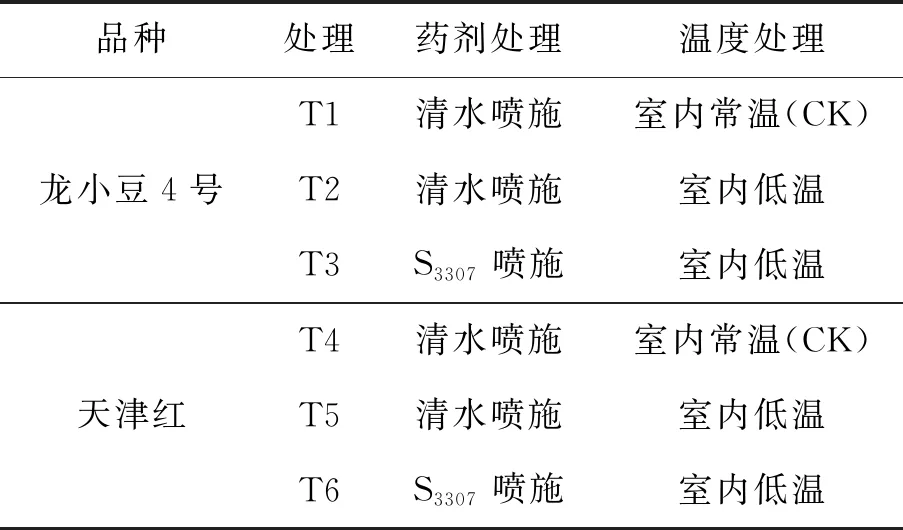
表1 試驗設計方案
于幼苗期(4月30日,此時真葉完全展開,第一片復葉露頭)進行低溫處理,處理溫度為恒定4℃。進行低溫處理當天上午10∶00,采取葉面噴施方式施用S3307,使用濃度20 mg·L-1,折合用液量22.5 mL·m-2(使用濃度和使用劑量為本課題組前期試驗所得)。噴施完畢后,于當晚20∶30進入事先預冷的人工氣候室冷房內進行低溫處理,持續時間12 h,CK處理溫度人工氣候室內自然溫度(當日夜間溫度為17℃),次日上午8∶30停止低溫處理。并進行第一次取樣,之后每天上午8∶30順延進行下一次取樣,共取樣5 d,記為取樣第1天~第5天。
1.3 測定項目與方法
1.3.1取樣方法
低溫處理后,連續取樣5次,每天上午8∶30取樣一次,各處理分別進行取樣,將小豆植株葉片迅速剪下裝入標記好的自封袋內,并立即放入液氮中,而后置于-80℃冰箱中保存,待測生理指標。
1.3.2測定方法
按照李合生等[11]的方法采用氮藍四唑(NBT)法測定超氧化物歧化酶(SOD)活性、愈創木酚法測定過氧化物酶(POD)活性、采用分解過氧化氫含量速率法測定過氧化氫酶(CAT)活性、采用硫代巴比妥酸(TBA)法測定丙二醛(MDA)含量,過氧化氫(H2O2)含量的測定采用碘化鉀法[12]。
1.4 數據分析
試驗所有數據利用Excel2010進行處理和作圖,使用DPS軟件進行統計分析。
2 結果與分析
2.1 低溫脅迫對小豆幼苗葉片膜損傷的影響
2.1.1對葉片H2O2含量的影響
由圖1可知,幼苗期低溫處理后,小豆葉片H2O2含量快速升高,隨著取樣時間的延續,小豆葉片H2O2含量呈下降趨勢。對龍小豆4號來說,第1天和第2天取樣時,H2O2含量均為T2>T1,方差分析結果表明差異達到顯著水平;第3天到第5天取樣時,T2和T1之間差異減小,差異未達到顯著水平。天津紅H2O2含量的表現與龍小豆4號一致,說明低溫對不同抗性小豆品種影響趨勢一致。從圖1中可以看出,與T2處理相比,噴施S3307處理龍小豆4號H2O2含量第1天顯著降低了6.03%,第2天降低了2.81%;與T4處理相比,噴施S3307處理天津紅的H2O2含量第1天和第2天分別顯著降低6.51%和8.32%,之后處理間H2O2含量差異不顯著,說明低溫脅迫下噴施S3307處理能抑制H2O2含量的升高。對于不同抗性品種而言,S3307對冷敏品種天津紅的效果更好。
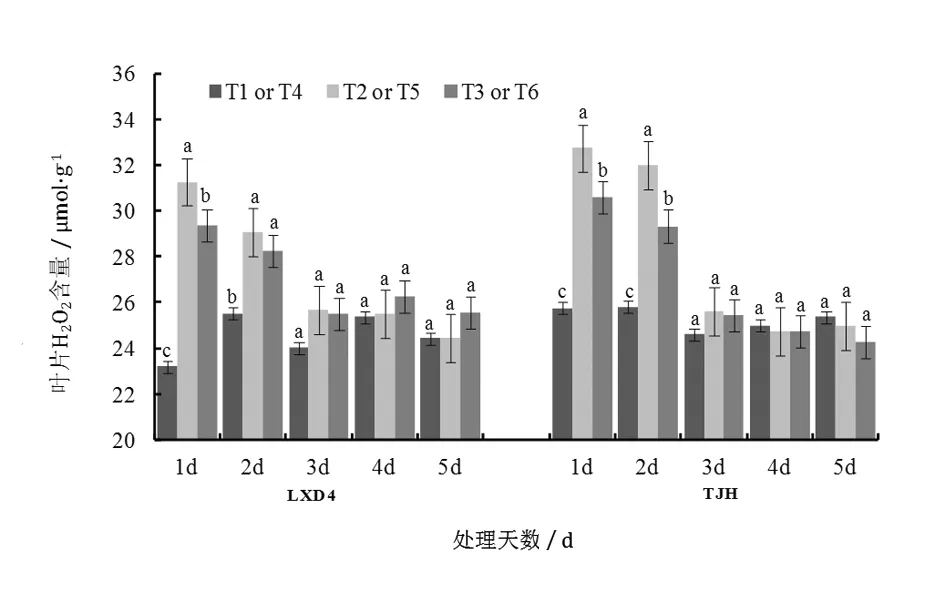
圖1 低溫脅迫及噴施S3307對小豆幼苗葉片H2O2含量的影響
2.1.2對葉片MDA含量的影響
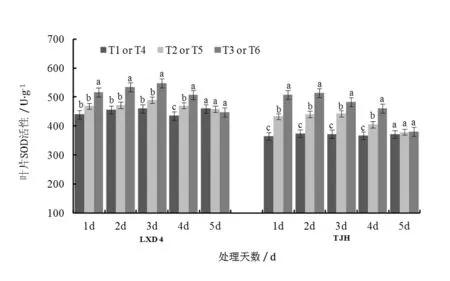
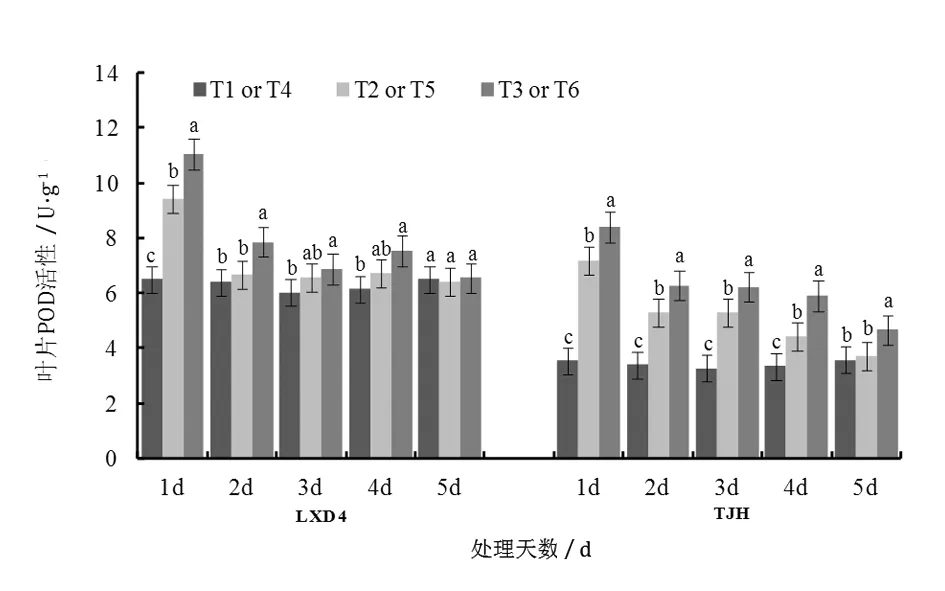
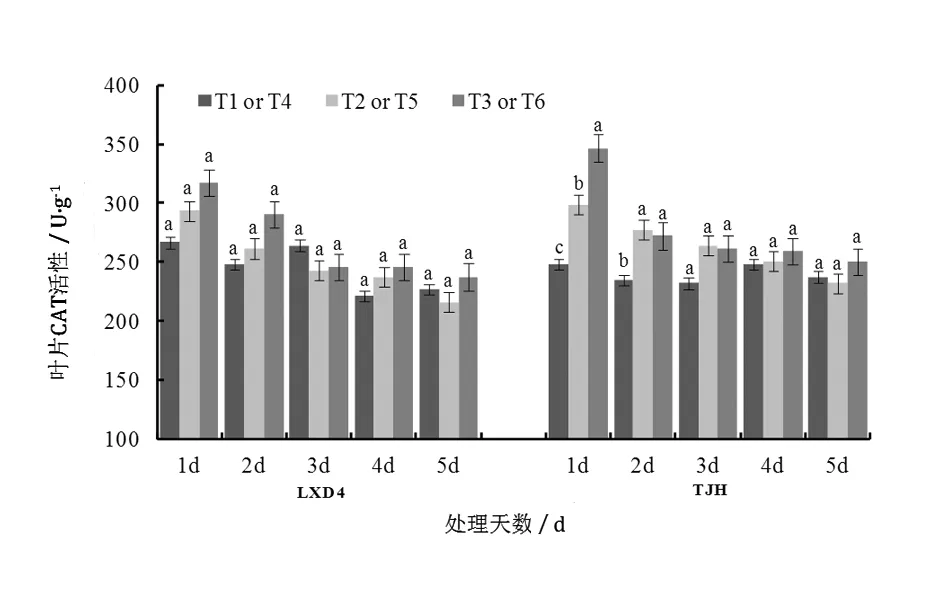
由圖2可知,幼苗期低溫處理后,小豆葉片MDA含量明顯升高,隨著取樣時間的延續,MDA含量呈下降趨勢。對龍小豆4號來說,第1天到第3天取樣時,T2的MDA含量均高于T1,分別高出65.56%、20.75%和7.20%,方差分析結果表明差異達到顯著水平;第4天和第5天取樣時,T2和T1之間含量差減小,未達到顯著差異水平。低溫處理對天津紅MDA含量影響規律與龍小豆4號相同,但抗性較強的品種龍小豆4號的MDA含量相對較低,說明低溫對不同品種小豆葉片MDA含量影響一致,但影響程度上存在差別。對龍小豆4號來說,第1天到第3天取樣時,MDA含量均為T3 圖2 低溫脅迫及噴施S3307對小豆幼苗葉片MDA含量的影響 2.2.1對葉片SOD活性的影響 由圖3可知,低溫處理及噴施后S3307后,小豆葉片SOD活性相應提高,各處理大致呈現先升后降的變化趨勢。整體看龍小豆4號的活性高于天津紅(T1>T4),這與其耐冷性強有關。對龍小豆4號來說,第1天到第4天取樣時,T2>T1,分別高出6.67%、3.37%、6.64%和8.13%,T2和T1間差異在第4天達到顯著水平。對天津紅而言,第1天到第4天取樣時,T5>T4,分別高出18.48%、18.21%、18.72%和10.24%,差異均達到顯著水平;直到第5天差異不顯著。說明低溫對不同品種小豆葉片內SOD活性影響具有較大影響,對耐冷性較弱天津紅影響更大。噴施S3307能進一步提高低溫條件下SOD活性,龍小豆4號第1天到第4天取樣時,各處理間高低順序均為T3>T2>T1,其中T3較T2分別提高10.20%、13.03%、11.55%和7.65%,方差分析結果表明T3均顯著高于T2和T1。對天津紅來說,第1天到第4天取樣時,各處理間高低順序均為T6>T5>T4,其中T6較T5分別提高了17.26%、16.81%、9.05%和13.92%,方差分析結果表明T6均顯著高于T5和T4。綜合來看,噴施S3307對不同抗性的小豆品種具有相同的調控規律。 圖3 低溫脅迫及噴施S3307對小豆幼苗葉片SOD活性的影響 2.2.2對葉片POD活性的影響 從圖4可以看出,幼苗期低溫處理后小豆葉片POD活性增加,隨著取樣時間的推移POD活性整體大致呈下降趨勢。龍小豆4號在第1天到第4天取樣時,POD活性均為T2>T1,僅第1天POD活性差異達到顯著水平。天津紅經低溫處理后,第1天到第5天取樣時,POD活性均為T5>T4,分別高出102.44%、56.21%、62.13%、31.67%和3.55%,前4天的差異均達顯著水平。說明不同抗性品種對低溫的感受不同,抗性較弱的天津紅對低溫更為敏感,其POD活性持續較高,來抵御低溫的脅迫傷害,而抗性較強的龍小豆4號葉片內POD活性僅取樣第1天顯著高于對照,說明其對低溫鈍感,短時低溫對其傷害不大。噴施S3307后,龍小豆4號在第1天到第5天取樣時POD活性均為T3>T2,分別高出17.16%、17.78%、4.46%、11.87%和2.08%,前2天的差異達到顯著水平。對天津紅來說,第1天到第5天全部取樣期間,各處理間高低順序均為T6>T5>T4,方差分析結果表明T6均顯著高于T5和T4。整體來看,噴施S3307能進一步提高低溫條件下POD活性,對天津紅的POD活性具有更加明顯的調控效應。 圖4 低溫脅迫及噴施S3307對小豆幼苗葉片POD活性的影響 2.2.3對葉片CAT活性的影響 由圖5可知,幼苗期低溫處理后,小豆葉片內CAT活性呈下降的變化趨勢。各取樣時期內,龍小豆4號的T2和T1之間差異不大,經過方差分析可知各取樣時期內不同處理間CAT活性沒有顯著性差異。天津紅經低溫處理后,第1天到第4天取樣時,CAT活性均為T5>T4,分別高出20.43%、18.18%、13.79%和1.08%,且前2天的差異達顯著水平。說明不同抗性品種對低溫的應激存在差異,短時低溫對抗性較弱的天津紅CAT活性影響更為明顯。噴施S3307能進一步提高低溫條件下CAT活性,對于龍小豆4號而言,CAT活性提高不明顯,處理間CAT活性均未達到顯著水平;對天津紅來說,第1天取樣時,T6顯著高于T5和T4,其他取樣時期T6和T5之間差異不顯著。 圖5 低溫脅迫及噴施S3307對小豆幼苗葉片CAT活性的影響 自然界中植物生長發育不可避免地受到低溫、干旱等逆境因素的影響,其中溫度是影響植物生長發育,甚至導致植物死亡的最關鍵環境因子。低溫對植物形態結構和代謝活動都有明顯的影響甚至傷害,使植物在逆境下產生復雜的生物化學和生理學上的響應[13]。低溫脅迫可引起細胞內部的ROS類物質、膜脂過氧化產物、酶功能等發生生理改變[14]。 H2O2是植物體內一類重要的ROS物質,正常條件下H2O2的產生和清除過程基本保持一種精細的平衡狀態,這樣既保證了植物體內H2O2具有一定的生理功能,同時也將其對植物的傷害效應降到最低。如果打破H2O2產生和清除的這種平衡,就會出現H2O2的積累。由于它具有較高的氧化還原活性,所以能引起細胞內大分子氧化損傷,最終抑制植物體內多種生理生化反應,影響植物體內的調控和代謝[15]。MDA是細胞膜過氧化的產物,能夠抑制細胞保護酶活性,從而加劇膜脂過氧化,同時其本身也是具有細胞毒性的物質,其含量的高低可作為質膜受損的重要指標,脅迫強度越大,MDA含量越多,MDA含量與植物耐寒性間呈負相關[7]。張騰國等[16]指出油菜受到低溫脅迫后體內H2O2含量迅速增加,鄧化冰等[17]指出低溫脅迫導致水稻葉片H2O2和MDA含量迅速上升,膜透性增大,損傷細胞生理功能,張愛冬等[4]在對絲瓜的研究中也有相似的報道。本研究結果也表明低溫誘導小豆葉片體內H2O2和MDA含量顯著增加,但隨著溫度恢復時間的延長,H2O2含量逐步下降并與對照趨平,這是小豆體內的保護機制的生理作用,尤其是抗氧化酶活性的提高,起到很強的清除H2O2的作用,并抑制ROS自由基與脂質作用發生過氧化反應,最終抑制MDA的產生,有效降低MDA含量。 植物抵御外界脅迫能力的強弱與抗氧化系統水平的高低具有相關性[13],抗氧化酶是指植物體內存在的一系列可以防止自由基對植物造成毒害的具有清除活性氧自由基功能的酶,如保護酶系統主要包括超氧化物歧化酶(superoxide dismutase,SOD)、過氧化物酶(peroxidase,POD)、過氧化氫酶(catalase,CAT)等。植物通過SOD、POD和CAT三者協同作用,使體內的氧自由基維持在較低水平,可以在一定程度上減緩或防御低溫脅迫[18]。SOD的主要作用是清除超氧根陰離子(O2·-),但同時產生H2O2,而POD和CAT通過酶促作用降解多余的H2O2等ROS,避免植物遭受因脅迫引起的過氧化傷害。相關研究指出低溫可導致植物體內SOD、POD和CAT活性先升高后下降,短時期內可清除多余的ROS,但隨著低溫脅迫時間的延長,這種保護機能逐漸下降甚至崩潰[7],這與李春燕等[19]的報道相似,其指出低溫處理一段時間后保護酶活性表現出持續下降的趨勢,并表明這種持續下降的現象是低溫對作物造成了不可恢復的傷害。本研究結果也表明低溫脅迫下小豆葉片的SOD和POD活性顯著提高,消除ROS的過氧化反應,消除或緩解低溫的脅迫效應。 植物生長調節劑預處理是緩解植物非生物脅迫重要措施,S3307是一種有效的植物生長延緩劑,能夠顯著提高逆境脅迫下作物的抗性生理并有效緩解產量因子受到脅迫,促使作物產量有效提高。Zhao等[10]指出開花期低溫條件下,S3307能降低ROS產生速率及MDA含量,并促進保護酶活性提高;楊文鈺等[20]指出S3307能減少膜脂過氧化物MDA含量,提高SOD、POD和CAT活性,并增加植物幼苗體內游離脯氨酸的含量;Xiang等[21]指出低溫脅迫下S3307能相應提高SOD、POD和CAT活性,增強作物的抗冷性,緩解脅迫并提高產量。本試驗結果表明,噴施S3307能緩解低溫脅迫對小豆造成的傷害,與噴施清水相比,能夠顯著降低H2O2和MDA含量、提高SOD和POD活性,增加小豆幼苗的抗冷性。 幼苗期短時低溫引起小豆葉片H2O2和MDA含量提高,SOD和POD活性提高,預噴施S3307具有提高小豆幼苗緩解低溫脅迫的作用,能顯著降低H2O2和MDA含量,顯著提高SOD和POD活性。不同品種小豆的生理應激存在顯著差異,抗性較弱的品種天津紅對低溫應激反應更為劇烈;噴施S3307能夠有效緩解低溫脅迫對小豆的傷害,對天津紅的緩解效應更加明顯,增加其抗冷性。
2.2 低溫脅迫及噴施S3307對小豆幼苗葉片抗氧化酶系統的影響
3 結論與討論

