超聲造影肝臟影像報告與數據系統對甲胎蛋白陰性肝細胞癌的診斷價值
王佩華,聶芳,王國娟,王蘭,范瀟
蘭州大學第二醫院超聲醫學中心,甘肅 蘭州 730030;*通信作者 聶芳 ery_nief@lzu.edu.cn
原發性肝癌是全球最常見的惡性腫瘤之一[1],在我國發病率居惡性腫瘤第四位,死亡率居第二位[2]。肝細胞癌(hepatocellular carcinoma,HCC)約占原發性肝癌的80%~90%,起病隱匿,約70%以上發現時已屬于晚期,預后差[3-4]。甲胎蛋白(alpha-fetoprotein,AFP)是HCC早期篩查的重要血清學腫瘤標志物,但臨床上約30%~40%的HCC患者AFP呈陰性[5],易誤診為其他肝臟腫瘤。因此,早期準確診斷對AFP陰性患者治療方案的選擇及改善預后尤為重要[6]。超聲造影(CEUS)可顯示腫瘤微血管灌注情況,在HCC早期診斷中具有重要價值。超聲造影肝臟影像報告與數據系統(contrast-enhanced ultrasound liver imaging reporting and data system,CEUS LI-RADS)自提出后相關研究多集中在該分類LR-5、LR-M類標準對HCC的診斷效能方面,但對AFP陰性HCC診斷價值的研究較少。本研究擬探討CEUS LI-RADS對AFP陰性HCC的診斷效能,以期提高對AFP陰性HCC的早期診斷準確率。
1 資料與方法
1.1 研究對象 回顧性分析2018年1月—2020年10月于蘭州大學第二醫院就診的HCC高危患者,納入標準:①具有HCC高危風險因素,包括肝硬化(不含18歲以下先天性或血管性因素所致肝硬化)、慢性乙型病毒肝炎、目前或既往有HCC病史、成人肝移植的供體及受體等[7];②無超聲造影劑(六氟化硫)過敏,無嚴重心肺功能不全,非妊娠期或哺乳期女性;③CEUS檢查前未接受任何治療;④血清AFP為陰性且均為CEUS檢查前后1周內測定結果。排除標準:①無HCC高危風險因素;②CEUS圖像不完整或圖像質量不佳;③CEUS檢查前已行手術切除或消融等治療。最終納入108例HCC高危患者,均具有肝病背景,其中慢性乙型肝炎76例(70.4%)、乙肝肝硬化26例(24.1%)、丙肝肝硬化5例(4.5%)、自身免疫性肝硬化1例(0.9%)。其中男85例,女23例,年齡26~82歲,平均(54.5±9.5)歲。共篩查肝局灶性病變112個,最大直徑0.7~18.0 cm,平均(4.7±3.6)cm,最終所有病灶除HCC經病理或臨床診斷標準證實外,其余病灶均經病理證實。
HCC臨床診斷標準[8]:對于肝癌高危患者,當肝內結節直徑≤2 cm時,動態增強MRI、動態增強CT、CEUS或普美顯增強MRI 4項檢查中至少有2項顯示“快進快出”的肝癌典型特征或當肝內結節直徑>2 cm時,上述4種影像學中有1項檢查顯示該典型特征即診斷為HCC。以本院檢驗科AFP(化學發光法)正常值0~7 ng/ml為依據,AFP<7 ng/ml為AFP陰性。本研究經醫院醫學倫理委員會批準,所有患者在CEUS檢查前均簽署知情同意書。
1.2 儀器與方法 使用Philips EPIQ 7、Siemens ACUSON Sequoia彩色多普勒超聲診斷儀,分別配以凸陣探頭C5-1、5C1,頻率均為1~5 MHz,于低機械指數模式下進行CEUS。造影劑使用聲諾維。患者取平臥位或左側臥位,常規掃查肝臟,記錄病灶的部位、大小、回聲等,然后選取病灶最佳切面,將SonoVue加入5.0 ml生理鹽水稀釋,反復振蕩混勻后根據儀器和患者情況抽取1.0~2.0 ml采取團注法注射,在CEUS模式下連續實時動態觀察病灶4~6 min并存儲圖像。
1.3 圖像分析 由2名具有5年以上腹部CEUS診斷經驗并可獨立分析圖像進行LI-RADS分類的主治醫師采用盲法獨立分析,并參照CEUS LI-RADS v2017對每個病灶進行分類。2名觀察者僅被告知圖像來自有HCC高危風險因素的患者。觀察者間診斷意見不一致時,由第3位具有10年以上腹部CEUS診斷經驗的副主任醫師進行最終分類。
CEUS LI-RADS診斷標準見表1。LR-NC類:圖像質量不佳或不完整而不能分類;LR-1類:明確良性,如肝囊腫、典型血管瘤、典型局灶性脂肪沉積或缺失;LR-2類:良性可能性大,直徑<10 mm的實性結節或任意大小的非實性結節造影始終呈等增強和持續2年及以上直徑均未增加的LR-3類病灶;LR-3類:中度可疑HCC;LR-4類:HCC可能性大;LR-5類:肯定HCC;LR-M類:可能或肯定為惡性病變,但不一定是HCC;LR-TIV類:明確的靜脈內瘤栓[7]。動脈期高增強:整體或部分增強,非環狀或周邊不連續團狀增強。早期廓清為病灶在注射造影劑后<60 s開始廓清,晚期廓清為≥60 s開始廓清。顯著廓清:病灶在注射造影劑后2 min內在聲像圖上表現為“黑洞”。輕度廓清:病灶較周邊肝實質呈低增強,但非“黑洞”表現,≥2 min表現為“黑洞”也為輕度廓清。
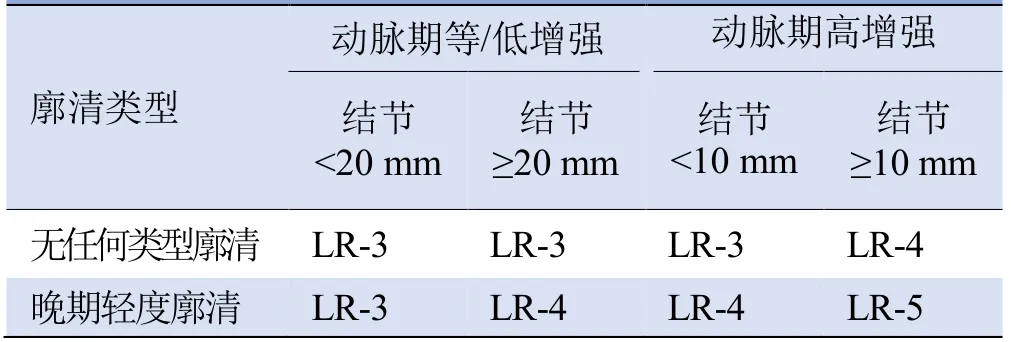
表1 CEUS LI-RADS分類診斷標準
1.4 統計學方法 應用SPSS 25.0軟件,符合正態分布的計量資料以±s表示,以組織病理學或臨床診斷為標準,計算CEUS LI-RADS分類診斷AFP陰性HCC的敏感度、特異度、陽性預測值、陰性預測值及診斷符合率。組間率的比較采用χ2檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 最終診斷結果 112個病灶最終經病理證實為HCC 32個,經臨床標準診斷為HCC 60個。其余20個病灶均經病理證實,分別為血管瘤3個、局灶性結節性增生(focal nodular hyperplasia,FNH)1個、肝上皮樣血管內皮瘤(hepatic epithelioid hemangioendothelioma,HEHE)1個、肝內膽管細胞癌(intrahepatic cholangiocarcinoma,ICC)4個、肝轉移癌(metastatic liver cancer,MLC)3個、肝原發性黏膜相關淋巴組織(mu-cosa-associated lymphoid tissues,MALT)結外邊緣區B細胞淋巴瘤1個。
2.2 CEUS LI-RADS最終分類情況 112個病灶CEUS LI-RADS分類:LR-1、LR-2、LR-3、LR-4、LR-5、LR-M類病灶分別為3個(2.7%)、2個(1.8%)、5個(4.5%)、15個(13.4%)、70個(62.5%)、17個(15.2%),見圖1~3。最終LR-1類3個均為血管瘤;LR-2類1個再生結節、1個不典型增生結節;LR-3類1個再生結節、3個不典型增生結節、1個HCC;LR-4類1個不典型增生結節、13個HCC、1個HEHE;LR-5類1個FNH,69個HCC;LR-M類9個HCC、4個ICC、3個MLC、1個MALT結外邊緣區B細胞淋巴瘤。
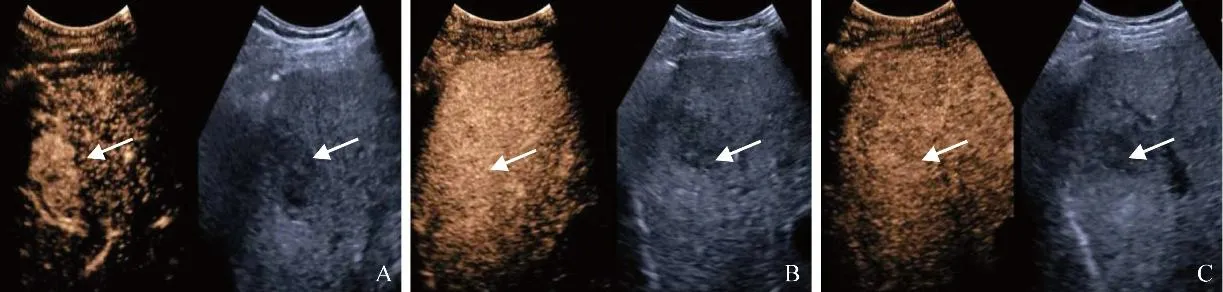
圖1 男,47歲,LR-4類,高分化HCC。肝S8可見一低回聲病灶(箭),大小約3.5 cm×2.8 cm,動脈期18 s呈不均勻高增強(A);門靜脈期56 s等增強(B);延遲期168 s持續等增強,未見明顯廓清(C)
2.3 CEUS LI-RADS分類對AFP陰性HCC的診斷價值 LR-3、LR-4、LR-5、LR-M類診斷AFP陰性HCC的陽性預測值分別為20.0%(1/5)、86.7%(13/15)、98.6%(69/70)、52.9%(9/17),見表2。與最終診斷結果對照,LR-3類80%(4/5)為再生結節或不典型增生結節。LR-4類中AFP陰性HCC達86.7%(13/15)。LR-5類診斷AFP陰性HCC陽性預測值高(98.6%,69/70),但敏感度偏低(75%,69/92),若將LR-4類及以上分類作為AFP陰性HCC診斷標準,敏感度明顯高于單獨應用LR-5類[89.1%(82/92)比75%(69/92),P<0.05],且具有更高的診斷符合率[(88.4%(99/112)比78.6%(88/112),P<0.05],同時兩者陽性預測值差異無統計學意義(P>0.05),見表3。
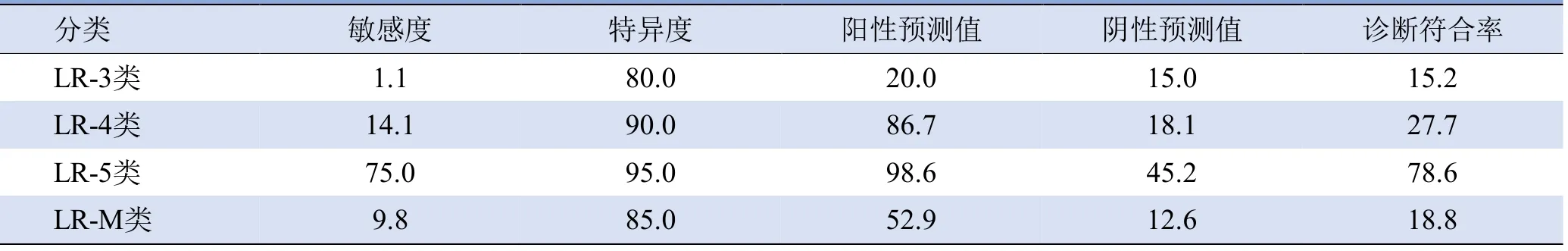
表2 LR-3、LR-4、LR-5、LR-M類對AFP陰性HCC的診斷效能(%)
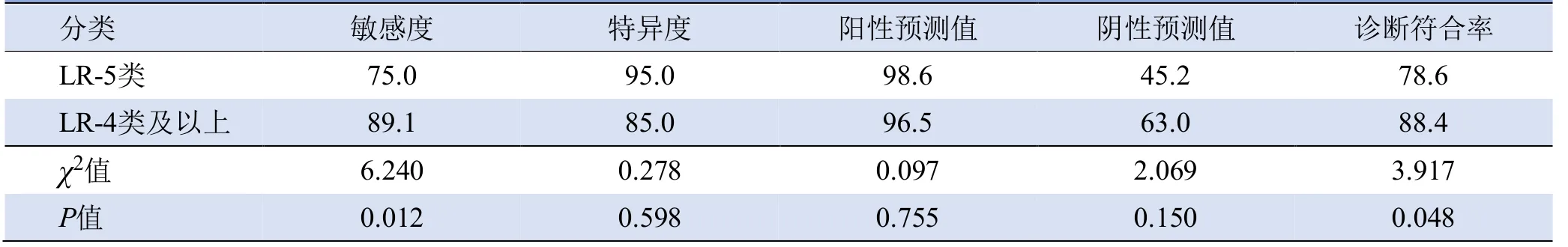
表3 LR-5類、LR-4類及以上分類對AFP陰性HCC的診斷效能比較(%)
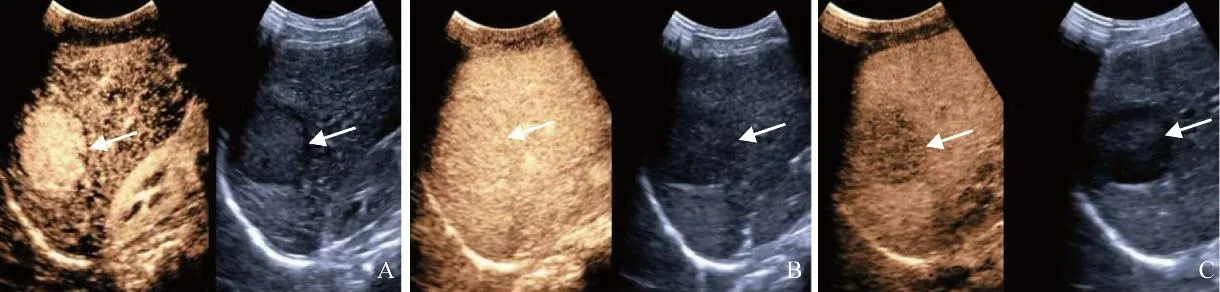
圖2 女,46歲,LR-5類,高-中分化HCC。肝S6可見一低回聲病灶(箭),大小約4.8 cm×3.7 cm,動脈期16 s呈不均勻高增強(A);門靜脈期62 s等增強(B);延遲期128 s輕度廓清(C)
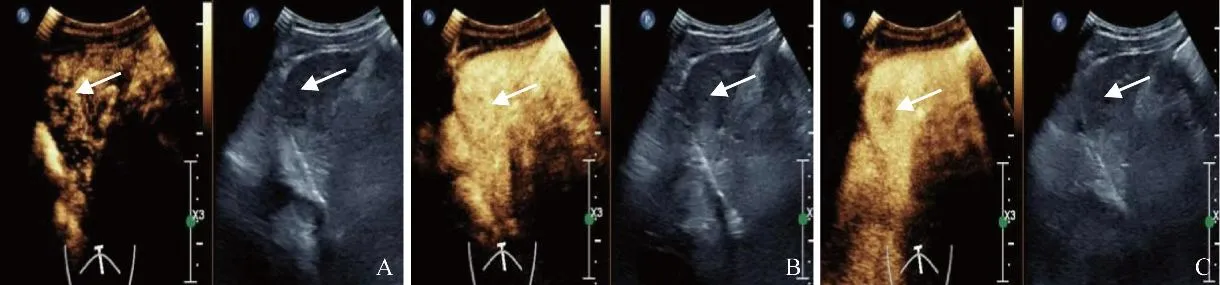
圖3 男,59歲,LR-M類,胃腺癌肝轉移。肝左葉可見一低回聲結節(箭),大小約1.5 cm×1.1 cm,動脈期23 s呈不均勻環狀高增強(A);21 s達峰(B);28 s開始廓清(C)
3 討論
3.1 概述 影像學檢查作為最常用的無創監測及診斷方法,在肝癌的檢出、定性、分級及治療中至關重要,多國肝癌診斷指南已將影像學診斷作為臨床診斷標準。有研究表明:CEUS對HCC的診斷敏感度和陽性預測值較高[9],分別為84.4%和89.3%,與普美顯增強MRI相似。2016年美國放射學會(American College of Radiology,ACR)在增強CT和MRI LIRADS基礎上發布CEUS LI-RADS,并于2017年更新,該分類對肝癌高危人群肝內局灶性病變進行分類,能有效提示病灶為HCC的可能性。既往研究表明,CEUS LI-RADS對肝硬化背景下的肝臟局灶性病變具有很高的診斷價值[10],但其診斷AFP陰性HCC的價值還需進一步探究。
3.2 CEUS LI-RADS對AFP陰性HCC的診斷效能本研究結果顯示,LR-5類診斷AFP陰性HCC的陽性預測值較高,與既往不限制AFP表達情況的相關研究結果并無明顯差異[10-11],但敏感度及診斷符合率偏低。LR-4類對AFP陰性HCC的陽性預測值為86.7%,敏感度僅為14.1%,將LR-4類及以上分類作為標準后診斷敏感度提高,同時陽性預測值及特異度未見明顯減低,診斷符合率也得到提高。LR-5類為明確HCC,但是部分HCC門靜脈期及延遲期均未見明顯廓清而被納入LR-4類,考慮與病灶分化程度有關[12],既往有研究表明AFP可反映腫瘤細胞的增殖活性和腫瘤負荷[13],其水平升高多與腫瘤分化不良相關,因而AFP陰性HCC多分化程度較高,惡性程度較低,癌細胞分化接近于正常肝組織,病灶內仍存在網狀內皮細胞及門靜脈供血,因此廓清較為緩慢,Feng等[14]研究發現:在無明顯廓清的HCC病灶中高分化者占73.7%,提示HCC的廓清行為與病灶細胞分化程度具有一定的相關性。本研究15例LR-4類80%病灶門靜脈期及延遲期均表現為未見明顯廓清,其中AFP陰性HCC占91.7%,因此對于AFP陰性肝內局灶性病變,當延遲相未出現明顯廓清而被納入LR-4類時,仍需高度懷疑HCC。其余3個LR-4類病灶門靜脈期均有晚期輕度廓清,2個最終診斷為HCC,1個最終病理診斷為HEHE,主要原因可能是HEHE惡性潛能在肝血管瘤與血管肉瘤之間,為低中度惡性腫瘤[15],其血供不豐富,因此動脈期呈不均勻低增強,且該病例具有慢性乙型肝炎背景,腫瘤標志物均為陰性,故納入LR-4類。另外,本研究LR-5類病灶中1例最終病理診斷為FNH,其原因可能是FNH內無門靜脈及中央靜脈,其內血流直接引流至肝靜脈導致FNH門靜脈相造影劑消退呈低增強改變[16],因此被納入LR-5類。
LR-M類為明確或可能的非HCC惡性病變,其主要目的是區分ICC等肝臟其他惡性病變及HCC[6]。Terzi等[10]研究發現:LR-M中48%的結節為HCC,本研究LR-M類52.9%(9/17)病灶最終診斷為AFP陰性HCC,與上述結果相似,但由于本研究納入標準較為嚴格,納入LR-M的其他惡性病變較少,致使LR-M中HCC占比相對升高。較低分化HCC生長速度快,新生血管扭曲,門靜脈系統加速消退,廓清速度越快,出現廓清的概率越大[12],因此部分HCC被納入LR-M類。而在一項針對≤20 mm肝臟局灶性病變研究中LR-M類HCC占75%[17],明顯高于本研究結果,其原因可能是ICC等其他惡性病變惡性程度高、生長速度快、直徑明顯增大,納入上述研究的病例較少,從而導致LRM中大部分病灶為HCC,但本研究尚未對不同病灶大小的CEUS LI-RADS進行相關性分析,未來可進一步探究。同時有研究發現:將早期廓清時間調整為<45 s時,可明顯提高LR-M類鑒別HCC與其他惡性腫瘤的敏感度和特異度[18],有待進一步研究驗證。本組1例MALT淋巴瘤的造影表現為動脈期高增強,門靜脈早期廓清且延遲期明顯廓清,呈現惡性病灶增強模式[19],符合LR-M類診斷標準。因此,CEUS LI-RADS中LRM類標準能夠鑒別AFP陰性HCC與肝臟其他惡性腫瘤,但可能需要更為嚴格的LR-M標準才能提高診斷敏感度及特異度,其診斷效能仍有待未來進一步研究確認。
LR-3類為HCC中度可疑,但具體概率尚不明確。本研究中LR-3類多為再生結節及不典型增生結節,AFP陰性HCC僅占20.0%(1/5),明顯低于相關文獻報道[10],其原因可能為很多LR-3類患者僅選擇觀察隨診,未進一步治療,無法獲得病理,導致病例數偏少。
3.3 本研究的局限性 ①各組病例數分布不均衡,大多數為LR-5類,其他類別病灶數偏少,可能存在偏倚;②未對各病灶造影參數進行定量分析,未來可使用定量分析軟件進一步驗證;③未比較AFP陰性HCC與AFP陽性HCC的CEUS LI-RADS分類,今后可進一步研究。
CEUS LI-RADS分類標準對AFP陰性HCC的診斷具有較高的應用價值,特別是以CEUS LR-4類及以上分類作為診斷標準時,具有較高敏感度和診斷符合率,有利于對AFP陰性肝癌高危患者肝內局灶性病變做出早期診斷,為臨床醫師診斷HCC提供新的思路。

