胃癌患者血清和組織miR-30a表達與胃泌素及患者臨床病理特征的相關性研究*
向進平,周澤偉,孫 娟
重慶醫科大學附屬第一醫院大足醫院/重慶市大足區人民醫院消化內科,重慶 402360
胃泌素是一種主要由胃竇中的胃泌素表達細胞產生的肽激素,是胃酸輸出的重要生理調節因子和胃上皮細胞增殖的調節因子[1]。循環胃泌素-17(G-17)水平升高常見于萎縮性胃炎引起的高胃泌素血癥患者,多與幽門螺桿菌(Hp)持續感染及相關慢性炎性反應有關[2],易增加胃腺癌和神經內分泌腫瘤的發生風險[3]。既往有研究證實,胃泌素在胃癌組織中呈高表達,并且與胃癌晚期、淋巴結轉移和預后不良有關[4]。然而,胃泌素影響胃癌發生的潛在分子途徑及其調控機制還有待進一步研究。眾所周知,微小RNA(miRNAs)控制著大部分基因組的轉錄或轉錄后翻譯過程,而且具有組織特異性和結構穩定性等特點,是癌癥診斷、治療和預后評估方面最具潛力的生物標志物之一[5]。本研究采用Target Scan預測胃泌素可能是miR-30a的候選靶基因之一,基于這一推斷,本研究納入68例胃癌患者,通過檢測循環血清和胃癌組織標本中miR-30a相對表達量,分析與胃泌素、患者臨床病理特征的相關性,為尋找胃癌治療的新靶點提供一定的循證數據支持。
1 資料與方法
1.1一般資料 本研究經重慶醫科大學附屬第一醫院大足醫院倫理委員會批準,獲得所有研究對象知情同意后,采集血液標本和組織標本用于研究。選取2018年3月至2019年12月重慶醫科大學附屬第一醫院大足醫院68例胃癌患者作為研究對象。納入標準:(1)所有患者均經組織病理學證實為胃腺癌;(2)未接受任何形式的化療、放療或靶向治療等術前治療;(3)接受根治性或非根治性胃癌切除+淋巴結清掃手術。排除標準:(1)合并其他同期或既往惡性腫瘤者;(2)被診斷為全身炎癥性疾病、肝硬化或慢性肝衰竭,或腎功能異常者。共收集連續的有完整臨床資料和腫瘤組織的68例胃癌患者,男45例,女23例,年齡33~75歲,平均(57.56±11.57)歲。基于美國癌癥聯合委員會和國際抗癌聯盟分期系統進行TNM分期[6]。另選取30例健康者(年齡、性別、體質量指數、吸煙史等與胃癌患者相匹配)血樣作為對照組,所有血常規和血生化指標均正常。
1.2標本采集和處理 胃癌患者在手術前使用靜脈穿刺法采集5 mL血樣,對照組人群使用體檢時采集的血樣。室溫下凝血后,1 500 r/min離心15 min,收集上清液,置于-20 ℃冷凍待檢。對于胃癌患者,在手術過程中獲得新鮮組織標本后,立即置于液氮中保存,隨后置于-80 ℃長期保存,直至用于RNA提取。使用前調取病理組織切片,由重慶醫科大學附屬第一醫院大足醫院病理科醫師采用盲法復閱,確定為原發性胃腺癌組織,且癌旁正常組織無癌細胞浸潤。胃癌患者的基線評估包括詳細病史和體格檢查,以及血清腫瘤標志物癌胚抗原(CEA)、糖類抗原(CA)19-9、CA125、G-17水平檢測。CEA、CA19-9和CA125的臨界值分別為5 ng/mL、39 U/mL、35 U/mL。
1.3血清和胃癌組織RNA提取及實時熒光定量聚合酶鏈反應(qRT-PCR)檢測miR-30a相對表達量 采用miRCURYTM RNA分離試劑盒(丹麥Exiqon公司)從200 μL血清/50 mg胃癌組織勻漿中分離出包括miRNA在內的總RNA。采用miRCURY LNATM Universal RT microRNA PCR Kit(丹麥Exiqon公司)對200 ng RNA進行反轉錄(42 ℃ 60 min,95 ℃ 5 min)得到cDNA。使用1 μL cDNA模板配制PCR反應體系,在iQ5光學實時PCR儀(美國Bio-Rad公司)上完成PCR:95 ℃ 10 min;95 ℃ 10 s+60 ℃ 1 min+72 ℃ 30 s,40次循環。小分子U6被用作胃癌組織和血清標本數據正常化的內源性控制。用2-ΔΔCt法測定胃癌組織與癌旁正常組織、血清標本中miR-30a相對表達量。miR-30a:正向5′-GCA GCT GCA AAC ATC CGA C-3′和反向5′-GCG ACT GTA AAC ATC CTC GAC T-3′;U6:正向5′-GAG ACG GGA ACG ACA AAC CT-3′和反向5′-TGG ACG AAG AGG ATT CGC TG-3′。
1.4生物信息學分析 采用GEPIA(Gene Expression Profiling Interactive Analysis,http://gepia.cancer-pku.cn)數據庫和OncomiR數據庫(http://www.oncomir.org)分析胃泌素基因(GAST)和miR-30a在胃癌組織和癌旁正常組織中的表達量,并繪制Kaplan-Meier生存曲線。
1.5雙熒光素酶報告基因分析 采用GAST-3′UTR野生型或突變型和miR-30a模擬物的pLMP載體共轉染HEK-293細胞。轉染48 h后取細胞進行裂解。用雙熒光素酶報告者檢測系統(美國Promega公司)在轉染后48 h進行報告者檢測,并用共轉染的腎素熒光素酶對轉染效率進行標準化。所有試驗至少進行3次。
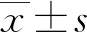
2 結 果
2.1生物信息學數據庫分析GAST和miR-30a在胃癌組織中的表達量及與預后的關系 GEPIA數據庫分析顯示,胃癌組織GAST表達量較癌旁正常組織升高,差異有統計學意義(P<0.05);OncomiR數據庫分析顯示,胃癌組織中miR-30a表達量低于癌旁正常組織,差異有統計學意義(P<0.05)。Pearson相關分析顯示,GAST與miR-30a表達量呈明顯負相關(r=-0.520,P<0.05)。采用上述數據庫進一步分析GAST和miR-30a在胃癌組織中的表達量與生存期的關系,結果發現,高低GAST或miR-30a表達量患者的生存預后差異無統計學意義(P>0.05)。見圖1。

注:A為GEPIA數據庫或OncomiR數據庫分析GAST和miR-30a在胃癌組織和癌旁正常組織中的表達差異及相關性,T為胃癌組織,N為癌旁正常組織;B為胃癌組織中GAST和miR-30a不同表達量患者的生存曲線。
2.2雙熒光素酶報告基因分析 基于Target Scan預測,miR-30a(358~364 nt)含有與GAST(60~66 nt)靶向結合的互補序列。雙熒光素酶報告基因分析結果顯示,miR-30a mimics和GAST-3′UTR-WT共轉染,熒光素酶相對表達量降低(P<0.05)。見圖2。

注:與NC mimics比較,*P<0.05。
2.3胃癌患者血清和胃癌組織中miR-30a相對表達量 經qRT-PCR檢測,與健康者血樣比較,胃癌患者血清miR-30a相對表達量明顯降低[(0.688±0.279)vs.(1.000±0.200),t=5.524,P<0.05];與癌旁正常組織比較,胃癌組織中miR-30a相對表達量明顯降低[(0.348±0.244)vs.(1.000±0.175),t=13.211,P<0.05]。胃癌患者血清和胃癌組織中miR-30a相對表達量呈正相關(r=0.376,P=0.002)。見圖3。

圖3 胃癌患者血清和胃癌組織中miR-30a相對表達量的關系
2.4胃癌患者血清和胃癌組織中miR-30a相對表達量與臨床病理特征的關系 胃癌患者血清和胃癌組織中miR-30a相對表達量與腫瘤最大徑、TNM分期、血清CEA、CA19-9、CA125水平及Hp感染均有關(P<0.05)。見表1。
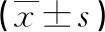
表1 胃癌患者血清和胃癌組織中miR-30a相對表達量與臨床病理特征的關系
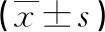
續表1 胃癌患者血清和胃癌組織中miR-30a相對表達量與臨床病理特征的關系
2.5胃癌患者血清miR-30a相對表達量與血清G-17水平的關系 Pearson相關分析顯示,胃癌患者血清miR-30a相對表達量與血清G-17水平呈負相關(r=-0.729,P<0.05)。見圖4。

圖4 胃癌患者血清miR-30a相對表達量與血清G-17水平的相關性
3 討 論
miRNAs作為一類內源性非蛋白編碼的小分子RNA,大約30%的人類基因組具有轉錄后調控作用,其依賴于互補的RNA-RNA結合抑制翻譯、增加切割或誘導靶基因的降解等。由于miRNAs控制著基因組的很大一部分,它們的表達模式具有組織特異性,并且在許多惡性腫瘤中呈表達失調狀態,因此,miRNAs有可能成為癌癥診斷和治療的重要靶點。
在既往研究中,LI等[7]構建了差異miRNAs/mRNA表達譜,并鑒定了12種基因因其網絡化程度高而被認為是中心基因,包括miR-29c、miR-30a、miR-335、miR-101等,其中miR-30a可能在hub基因調控中發揮重要作用。本研究首先通過生物信息學數據庫檢索及qRT-PCR對68例胃癌患者血清標本、組織標本進行檢測,證實胃癌患者血清中miR-30a相對表達量低于健康對照者,同時,胃癌組織中miR-30a的相對表達量亦低于癌旁正常組織,說明miR-30a在胃癌的發生過程中屬于功能性基因。通過分析血清和胃癌組織中miR-30a相對表達量與胃癌患者臨床病理特征的關系,證實腫瘤最大徑>5.0 cm、TNM分期為Ⅲ~Ⅳ期、血清腫瘤標志物異常升高者血清和胃癌組織中miR-30a相對表達量明顯降低,說明miR-30a在胃癌進展中扮演著抑癌基因的角色。miR-30a是許多類型癌癥中最有潛力的抑癌基因之一,它可以通過不同的靶基因抑制癌細胞的生長、遷移和侵襲。YU等[8]的研究證實,上調miR-30a表達可以靶向抑制成纖維細胞活化蛋白a活化,進而抑制胃癌轉移。LIU等[9]研究證實,miR-30a-5p通過直接靶向胰島素樣生長因子1受體(IGF-1R)抑制胃癌細胞AGS、HGC27、BGC823、SGC7901等的生長和轉移。因此,miR-30a-5p/IGF-1R軸可能是胃癌治療的潛在靶點。
本研究發現,胃癌患者有Hp感染者血清和胃癌組織miR-30a相對表達量低于無Hp感染者。LIU等[10]通過體內試驗構建miR-30a基因敲除小鼠模型,與Hp感染的野生型小鼠比較,Hp感染的miR-30a基因敲除小鼠表現出慢性胃炎、慢性萎縮性胃炎、非典型增生及其他癌前病變或腺癌表現的發病率明顯增加,并通過影響癌基因的表達促進腫瘤發展。上述結果說明,miR-30a對于Hp感染者胃癌細胞的生長有一定的抑制作用。Hp持續感染和相關慢性炎癥引起的慢性胃萎縮與胃癌的發生密切相關,而胃腺萎縮可以促進胃泌素大量分泌。MURPHY等[11]通過幾十年的隨訪數據證實,高胃泌素血癥患者人群胃癌的發病風險大大增加。因此,眾多學者普遍認為胃泌素是一種致癌生長因子,在結直腸[12]、胃[13]、肝臟[14]等器官的癌癥進展中起重要作用。陳遠等[15]研究證實,血清G-17在胃癌患者中呈高表達,并且與胃癌晚期、淋巴結轉移和預后不良有關;GAST基因的異常表達受轉錄后水平環境因素的影響,如Hp感染。
本研究為了進一步明確miR-30a在胃癌發生中的作用,首先通過Target Scan生物學軟件預測miR-30a存在與GAST mRNA靶向結合的互補序列,并且通過熒光素酶報告基因分析證實,以GAST編碼序列為靶點的miR-30a可以有效地沉默GAST的表達。因此,本研究推斷胃泌素在胃癌患者血清中的過度表達可能與miR-30a表達下調有關。通過分析胃癌患者血清miR-30a相對表達量與G-17水平的關系,證實二者存在明顯負相關。根據上述結果推斷,針對miR-30a/胃泌素研發新的靶向治療藥物可能適合于Hp感染引起的胃腺癌的治療。
綜上所述,胃癌患者血清和胃癌組織中miR-30a相對表達量普遍降低,而且與腫瘤最大徑、TNM分期、血清學腫瘤標志物水平及Hp感染均有關;此外,GAST是miR-30a的潛在靶基因。因此,miR-30a表達下調可能是胃泌素促進胃癌細胞生長和遷移的重要原因,為針對miR-30a/胃泌素研發靶向治療胃癌的新型藥物提供了新的思路。

