腎胺酶減輕高糖誘導的足細胞損傷
趙 婷, 張芳菲, 尹建永, 汪年松,2, 王 鋒,2*
1. 上海交通大學附屬第六人民醫院腎內科,上海 200030 2. 上海市第八人民醫院腎內科,上海 200235
糖尿病是一種常見的代謝性疾病,其特征為患者血糖長期高于標準值。2019年,全世界有4.63億成人患糖尿病;國際糖尿病聯合會估計,到2045年全世界范圍內將有成年7億糖尿病患者[1]。糖尿病腎病(diabetic nephropathy, DN)是糖尿病的嚴重并發癥,是終末期腎臟疾病的主要原因[2-3]。DN的早期病理變化涉及多種機制,包括小血管病變、腎小球肥大、腎小球基底膜(glomerular basement membrane,GBM)增厚和腎小管損害,隨著病程進展,最終出現腎小球硬化和腎小管間質纖維化。足細胞是腎小球濾過屏障的關鍵組成部分,實驗與臨床研究[4-5]均表明,腎小球足細胞損傷是導致糖尿病腎小球硬化癥的主要機制。目前DN的治療措施有限,血糖控制和血壓控制只能部分緩解DN進展,因此,迫切需要尋找DN的治療新靶點和藥物。
腎胺酶是2005年耶魯大學華人學者Xü等[6]發現的一種黃素蛋白,主要表達在腎臟和心臟,結構中含有單胺氧化酶結構域,可分解兒茶酚胺,調節血壓與心血管功能[7]。以往研究[8]表明,腎胺酶對嚙齒動物有強大而快速的降壓作用,可降低心臟的收縮力和心率,提示腎胺酶這種作用可能通過降解循環兒茶酚胺而介導。
除了作為酶發揮作用,腎胺酶還有細胞與組織保護功能[9-10],在多種急性和慢性腎臟疾病的動物模型中均顯示抗凋亡和抗炎作用,可減輕腎臟損傷[11-13]。腎胺酶在完全單側輸尿管梗阻模型和5/6腎切除模型中顯著減輕慢性腎臟病(chronic kidney disease, CKD)纖維化[12,14],參與局部和遠程缺血預處理對急性腎損傷的保護作用[15-16]。腎胺酶缺失的腎缺血再灌注(ischemia/reperfusion, IR)的小鼠炎癥和細胞凋亡增加及顯著腎小管壞死;而重組腎胺酶能改善這些變化[17]。本課題組以往研究[18]發現,用腎胺酶進行預處理,可減輕對比劑誘發的腎病大鼠(contrast-induced nephropathy,CIN)腎功能的惡化,減輕腎小管壞死、氧化應激、細胞凋亡和炎癥。另有研究[19]發現,腎胺酶可改善單側輸尿管梗阻(unilateral ureteral obstruction,UUO)大鼠的腎間質纖維化,通過抑制氧化應激來發揮抗纖維化作用。然而,腎胺酶對高糖誘導的足細胞損傷是否有減輕作用尚未明確。本研究通過高糖培養足細胞并補充腎胺酶,來探討腎胺酶對高糖誘導的足細胞損傷的作用及其可能的機制。
1 材料與方法
1.1 細胞來源 條件性永生的小鼠足細胞MPC5細胞系由復旦大學兒童醫院徐虹教授友情贈送。
1.2 主要試劑 RPMI1640培養基購于美國Thermo Fisher Scientific公司;胎牛血清(FPS,Fetal Bovine Serum)購于美國Gibco公司;甘露醇購于美國Sigma-Aldrich公司;反轉錄試劑盒M-MLV Reverse Transcriptase購于美國Promega公司;實時熒光定量PCR試劑盒購于美國Thermo Fisher Scientific公司;Trizol購于美國Invitrogen公司;SYBR Green PCR預混液購于TaKaRa公司;StepOnePlus PCR Systems購于美國Applied Biosystems公司;caspase-3活性檢測試劑盒購于碧云天公司;Ⅳ型膠原α酶聯免疫吸附測定(enzyme linked immunosorbent assay,ELISA)試劑盒購于美國Cloud-Clone公司;轉化生長因子β1(transforming growth factor β1,TGF-β1)及單核細胞趨化因子1(monocyte chemoattractant protein 1,MCP-1)ELISA試劑盒均購于美國R&D Systems公司;p21 ELISA試劑盒購于英國Abcam公司;重組腎胺酶由本實驗室制備[20]。
1.3 細胞處理 足細胞先于33℃、5% CO2培養箱中擴增性培養5 d:用含10 U/mL γ-干擾素的RPMI1640完全培養基(含10%滅活FBS、100 U/mL青霉素和0.1 g/L鏈霉素)培養細胞。培養瓶內鋪0.1 g/L Ⅰ型膠原并于37℃培養箱孵育1 h,將上述擴增性培養的細胞接種到培養瓶,且培養基不含干擾素,于37℃、5% CO2培養箱中培養14 d,促其分化成熟。具體培養方法參考相關文獻[21-22]。
將同步化處理(1% FBS培養24 h)的分化成熟的足細胞隨機分為對照組(D-葡萄糖5 mmol/L培養)、甘露醇組(D-葡萄糖5 mmol/L+甘露醇25 mmol/L培養)、高糖組(D-葡萄糖30 mmol/L培養)和腎胺酶處理組(重組腎胺酶蛋白60 μg/mL預處理6 h+D-葡萄糖30 mmol/L培養)。腎胺酶使用濃度經既往實驗[13]及Wang等[23]測試為最適濃度。48 h后收集細胞進行分析。實驗重復3次。
1.4 Ⅳ型膠原α、TGF-β1、MCP-1與F-actin mRNA檢測 收集各組細胞以Trizol提取總RNA,用M-MLV Reverse Transcriptase 試劑盒反轉錄成cDNA,用StepOnePlus PCR系統和SYBER Green PCR master Mix實時熒光定量PCR,反應體系和反應條件按照說明書配制和設置。以18s rRNA為內參基因。各基因引物序列見表1。
1.5 Caspase-3活性檢測 用胰酶消化各組細胞,并收集至備用的細胞培養液中。離心后收集細胞,按照每200萬細胞加入100 μL裂解液的比例加入裂解液,重懸沉淀,冰育裂解15 min后離心,取上清測定caspase-3酶的活性。依次加入底物和待測樣品及標準品。caspase-3催化底物Ac-DEVD-pNA產生黃色的pNA,pNA在405 nm附近有強吸收,通過測定吸光度來檢測caspase 3的活性。

表1 各基因引物序列
1.6 Ⅳ型膠原α、TGF-β1和MCP-1蛋白表達的檢測 細胞上清1 000×g離心20 min,取上清,分別在預先包被小鼠Ⅳ型膠原α、TGF-β1和MCP-1蛋白捕獲抗體的微孔中,依次加入待測樣品、標準品、HRP標記的檢測抗體,經過溫育后徹底洗滌。用底物TMB顯色,TMB在過氧化物酶的催化下轉化成藍色,并在酸的作用下轉化成最終的黃色。顏色的深淺與樣品中的蛋白含量正相關。用酶標儀在450 nm波長處測定吸光度(A值),計算樣品濃度。
1.7 p21活性的檢測 采用ELISA試劑盒檢測上清中p21活性,預先包被小鼠p21捕獲抗體的微孔中,依次加入標本、標準品、HRP標記的檢測抗體,經過溫育后徹底洗滌。用底物TMB顯色,TMB在過氧化物酶的催化下轉化成藍色,并在酸的作用下轉化成最終的黃色。顏色的深淺與樣品中的p21活性正相關。
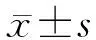
2 結 果
2.1 足細胞Ⅳ型膠原α表達水平 結果(圖1)表明,與對照組相比,高糖誘導使足細胞Ⅳ型膠原α的表達水平顯著升高(P<0.05);腎胺酶處理足細胞Ⅳ型膠原α表達水平顯著下調(P<0.05)。甘露醇組與對照組差異無統計學意義。

圖1 腎胺酶使高糖誘導的足細胞Ⅳ型膠原α表達水平下調
2.2 足細胞TGF-β1表達水平 結果(圖2)表明,與對照組相比,高糖誘導足細胞TGF-β1表達水平顯著升高(P<0.05);腎胺酶處理使高糖誘導的足細胞TGF-β1表達水平顯著下調(P<0.05)。甘露醇組與對照組差異無統計學意義。
2.3 足細胞MCP-1表達水平 結果(圖3)表明,與對照組相比,高糖誘導細胞MCP-1表達水平增高(P<0.05);腎胺酶處理使高糖誘導的足細胞MCP-1表達水平顯著下調(P<0.05)。甘露醇組與對照組差異無統計學意義。
2.4 足細胞p21的活性 結果(圖4)表明,與對照組相比,高糖誘導足細胞p21活性增強(P<0.05);腎胺酶使高糖誘導的足細胞p21活性降低(P<0.05)。甘露醇組與對照組差異無統計學意義。

圖2 腎胺酶使高糖誘導的足細胞TGF-β1表達水平下調

圖3 腎胺酶使高糖誘導的足細胞MCP-1表達水平下調

圖4 腎胺酶下調高糖誘導的足細胞p21活性
2.5 足細胞caspase-3活性 結果(圖5)表明,與對照組相比,高糖誘導足細胞caspase-3活性顯著升高(P<0.05);腎胺酶下調高糖誘導的足細胞caspase-3活性(P<0.05)。甘露醇組與對照組差異無統計學意義。
2.6 足細胞F-actin表達比較 結果(圖6)表明,各組足細胞骨架蛋白F-actin mRNA表達差異無統計學意義。

圖5 腎胺酶下調高糖誘導的足細胞caspase-3活性

圖6 各組足細胞F-actin表達情況
3 討 論
DN已成為全球范圍內終末期腎病的主要原因之一。臨床以蛋白尿、高血壓和腎功能的逐漸喪失為特征。DN一旦發展到終末期腎病甚至腎衰竭,將需要進行替代治療,這對患者和社會來說都是非常大的負擔。因此,探尋其更加有效的治療方式極為迫切。
病理上,DN主要體現在細胞外基質的沉積、腎小球基底膜增厚、腎小球增殖性變化以及腎小管萎縮,最終導致不可逆的腎小球硬化和間質纖維化,這也是多種腎臟疾病的最終共同途徑[24]。足細胞即腎小囊臟層上皮細胞,附著于腎小球基底膜的外側,連同血管內皮細胞和腎小球基底膜構成了腎小球血液濾過屏障。足細胞是腎小球濾過屏障的關鍵組成部分,也是產生膠原的重要細胞之一,容易受到多種因素的損傷[25-26]。足細胞損傷和凋亡在DN的發生發展中起關鍵作用[27]。在DN中,足細胞損傷伴隨復雜的生物學變化,包括細胞代謝異常和細胞完整性丟失及凋亡。足細胞形態變化主要包括足細胞肥大、足細胞上皮-間質轉化、足細胞脫離和凋亡[28]。足細胞損傷最終導致蛋白尿,細胞外基質(extracellular matrix, ECM)成分的積聚和腎小球硬化[29]。
本研究采用體外高糖培養足細胞,模擬了DN的生理環境,并用腎胺酶重組蛋白預處理足細胞以研究其作用。膠原蛋白是細胞外基質的主要成分,且Ⅳ型膠原是基底膜網狀結構的關鍵組成成分。本研究發現,在高糖刺激下,足細胞Ⅳ型膠原α表達水平顯著增加,而腎胺酶可降低足細胞Ⅳ型膠原α表達水平,減少細胞外基質積聚。本研究還證明腎胺酶可抑制高糖誘導的足細胞凋亡,可顯著降低足細胞凋亡相關蛋白caspase-3活性,這與Wang等[23]的研究結果一致。
TGF-β1是轉化生長因子β細胞因子超家族的多肽成員,具有控制細胞生長、增殖、分化和凋亡等多種細胞功能。以往研究[30]證明糖尿病環境增強氧化應激并誘導TGF-β1的表達。TGF-β1誘導ECM的過量產生和抑制ECM的降解,是導致大多數慢性腎臟病纖維化的主要細胞因子[31]。TGF-β1還通過增加腎小球通透性和減少近段小管的重吸收來調節尿白蛋白排泄和誘導上皮-間質轉化[32-33]。此外,TGF-β1還是促進足細胞凋亡的重要細胞因子之一[34]。與上述結論一致,本研究證明高糖培養的足細胞TGF-β1表達顯著增加,而重組腎胺酶可抑制高糖培養的足細胞TGF-β1表達。
單核細胞/巨噬細胞是DN腎臟中最豐富的浸潤細胞[35]。趨化因子及其受體在免疫細胞向腎臟組織的遷移中起關鍵作用,其中重要的趨化因子之一為MCP-1。MCP-1趨化單核細胞到腎臟,介導腎臟炎癥和纖維化[36-37],是識別腎纖維化危險的潛在生物標志物[38-39]。MCP-1可反映DN中腎小管損傷和腎臟炎癥的水平[40],是預測DN進展的重要因子[41-42]。同樣地,本研究證明腎胺酶可顯著降低高糖培養的足細胞MCP-1表達水平。
足細胞肥大是糖尿病腎病最早的腎小球形態變化之一,在DN的進展中發揮重要作用[43-44]。其中p21又叫p21Waf1/Cip1,也稱為細胞周期蛋白依賴性激酶抑制劑1,能夠抑制細胞周期蛋白,干擾細胞周期進程,使細胞周期停滯,導致細胞肥大[45-46]。p21在DN的腎小球肥大中起關鍵作用[47]。p21還與腎臟纖維化密切相關。研究[48]表明p21基因敲除可顯著抑制腎臟纖維化,降低TGF-β表達水平。本研究發現,高糖誘導足細胞中p21活性增加,腎胺酶可顯著抑制該效應。因此腎胺酶可能通過抑制p21活性恢復足細胞細胞周期、抑制細胞肥大和減輕纖維化。
綜上所述,本研究利用體外試驗證實腎胺酶可減輕高糖誘導的足細胞損傷和凋亡,可能與抑制炎癥、纖維化和p21活性有關。因此,腎胺酶可能具有保護腎功能的作用,為臨床治療DN提供了新的思路。然而,本研究僅限于體外試驗,且暫時沒有發現高糖和腎胺酶對足細胞骨架蛋白的影響,因此,腎胺酶對DN患者腎功能的保護作用以及其詳細機制尚需要進一步探究。
利益沖突:所有作者聲明不存在利益沖突。

