十水草酸鈰的熱分解過程以及熱分解動力學研究
苑斯雯,楊金月,周冠辰,謝 非,黃云海,田貝倩,吳德慧,侯學鋒, 黃 欣,3*,郝紅勛,3*
(1.中國核電工程有限公司,北京 100840; 2.天津大學化工學院國家工業結晶工程技術研究中心,天津 300072) 3.天津化學化工協同創新中心,天津 300072)
稀土元素由于其獨特的電子構型,在光、電、磁等方面具有許多獨特的性質,并因此被贊譽為新材料的寶庫[1]。CeO2作為一種重要的稀土化合物,已經被廣泛應用在催化、傳感器、固體電解質和拋光劑等領域[2-3]。研究CeO2的制備過程,對于獲得不同物理化學性質的CeO2材料具有非常重要的理論指導意義。
目前文獻中報道的CeO2的制備方法包括溶膠-凝膠法、水熱法、沉淀法和煅燒法等[4-7]。在這些方法中,煅燒法由于可以在較短時間內獲得均勻的高純度的CeO2粉末,且兼具成本低、設備簡單的特性,被廣泛用于CeO2的制備[7-8]。在煅燒過程中,可通過控制煅燒前驅體的性質以及煅燒條件,來實現對最終產品物理性質的調控。因此,通過研究前驅體在不同條件下的煅燒過程,對深入了解煅燒反應的機理以及控制目標產物的理化性質具有重要的理論價值。
熱分析技術已經被廣泛地應用在研究各類固態反應的熱行為以及熱力學性質中,例如脫水、分解和氧化還原等過程[9-11]。目前,已經有一些文獻對草酸鈰水合物的熱分解性質進行了報道[12-13]。但是這些研究都是在單一氣氛(空氣)下對草酸鈰水合物的熱分解過程進行研究,缺乏草酸鈰水合物在惰性氣氛等條件下的熱分解機理的探究,對草酸鈰水合物在不同氣氛下的熱分解機制可能存在的差異也缺乏對比。
基于以上背景,本研究通過采用TG-DSC熱分析技術,對比研究了十水草酸鈰分別在N2和O2氣氛下煅燒時的差異,證實了十水草酸鈰在N2和O2氣氛下煅燒時會經歷不同的分解過程,并推測了相應的反應機理。此外,本研究還測定了十水草酸鈰在O2氣氛下2步熱分解的動力學參數,為后續煅燒制備CeO2提供了重要的熱力學數據。
1 實驗部分
1.1 十水草酸鈰[Ce2(C2O4)3·10H2O]的制備
將Ce(NO3)3·6H2O(上海邁瑞爾化學技術有限公司,質量分數為99.5%,metals basis)溶解于適量蒸餾水中,得到特定濃度的六水硝酸鈰溶液;在30 ℃的反應溫度以及500 r·min-1的攪拌轉速下,向六水硝酸鈰溶液中加入特定濃度的草酸水溶液,控制反應條件,即可得到CeO2的前驅體——草酸鈰水合物。
1.2 十水草酸鈰[Ce2(C2O4)3·10H2O]的表征
對按1.1制備得到的Ce2(C2O4)3·10H2O進行形貌分析、粉末X射線衍射(PXRD)以及固體紅外(FTIR)測試。其中,形貌分析采用光學顯微鏡進行。粉末X射線衍射采用Rigaku D/max-2500, Cu_Kα進行測試, 衍射角測試范圍為2°~50°,掃描速度為8(°)·min-1。固體紅外采用Bruker Alpha FTIR-ATR儀器,測量范圍為4 000~400 cm-1, 分辨率為4 cm-1。
1.3 十水草酸鈰[Ce2(C2O4)3·10H2O]的熱分析
對按1.1制備得到的Ce2(C2O4)3·10H2O進行TG-DSC(Mettler-Toledo TG)熱分析測試。分別取19.640 8和23.136 9 mg樣品置于坩堝中,控制10 ℃·min-1的升溫速率,分別在N2和O2氣氛下,在30~800 ℃范圍內進行升溫操作。
2 結果與討論
2.1 十水草酸鈰[Ce2(C2O4)3·10H2O]的表征結果
經沉淀反應得到的草酸鈰水合物的PXRD譜圖如圖1所示。該譜圖與文獻中報道的草酸鈰十水合物單斜結構的衍射峰匹配良好(晶胞參數為a=1.1340 nm,b=0.9630 nm,c=1.0392 nm,β=114.5° (JCPDS Card No 20-0268))[14],初步證明了得到的草酸鈰水合物為具有單斜晶習的Ce2(C2O4)3·10H2O。另外,將本實驗得到的草酸鈰水合物與文獻中報道的草酸鈰十水合物的PXRD譜圖[15]進行對比,發現它們的衍射峰基本一致,由此進一步說明了實驗得到的草酸鈰產品為草酸鈰十水合物。所示。對于該紅外譜圖,2 700~3 600 cm-1處的寬的紅外吸收峰對應水的紅外吸收峰,1 598、1 363和1 309 cm-1處的吸收峰為草酸的紅外吸收峰。489 cm-1處的吸收峰為Ce—O的伸縮振動峰。將該紅外譜圖與文獻[16]中報道的Sm3+摻雜的十水草酸鈰的紅外譜圖進行對比,發現它們的特征吸收峰基本一致,由此進一步證明了實驗得到的為草酸鈰十水合物。

圖1 十水草酸鈰的PXRD譜圖Fig.1 PXRD pattern of cerium oxalate decahydrate

圖2 十水草酸鈰的紅外譜圖Fig.2 Infrared spectrum of cerium oxalate decahydrate
對經沉淀反應得到的十水草酸鈰的晶習進行研究,取適量樣品置于載玻片上進行顯微鏡分析,得到如圖3所示的產品形態圖。從圖3中可以看出十水草酸鈰產品呈現出不規則的棒狀形態。
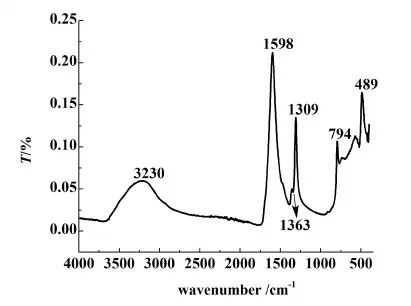
圖3 十水草酸鈰的顯微鏡圖像Fig.3 Microscope image of cerium oxalate decahydrate
2.2 十水草酸鈰[Ce2(C2O4)3·10H2O]的熱分解特性
N2氣氛下,在30~800 ℃之間對十水草酸鈰樣品進行加熱,得到如圖4所示的TG以及DSC曲線。N2氣氛下煅燒十水草酸鈰最后得到的產物呈現黑色(圖5)。從以上結果可以推測出,在N2氣氛下,草酸鈰水合物的熱分解主要有3步:首先,產品在40~340 ℃之間失去10個結晶水得到Ce2(C2O4)3,對應DTA曲線中峰頂溫度為145 ℃的第1個大吸熱峰。該步的實驗失量率為24.33%,理論計算值為24.86%。故進一步確定本實驗產品為Ce2(C2O4)3·10H2O。其次,在350~530 ℃之間,Ce2(C2O4)3分解為Ce2O2CO3,同時釋放出CO2和CO,對應DTA曲線上峰頂溫度為403 ℃的吸熱峰。根據文獻,CO在惰性氣氛中,在大約400~475 ℃之間會發生Boudouard反應生成CO2和單質C[17],由此導致灼燒的粉末變黑。這一步的理論失量率為23.76%,實驗失量率為23.63%。最后,在530~800 ℃之間Ce2O2CO3進一步熱分解為CeO2,同時釋放出CO。這一步的理論失量率為3.87%,實驗失量率為3.89%。最后灼燒產物的黑色是由于沉積的單質C導致的。
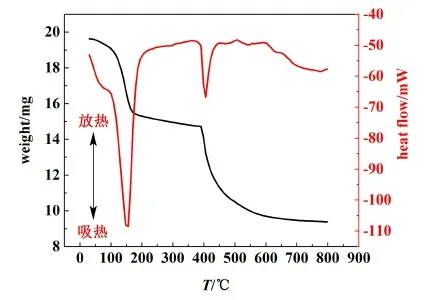
圖4 N2氣氛下的十水草酸鈰的TG/DSC曲線Fig.4 TG/DSC curves of cerium oxalate decahydrate under N2 atmosphere
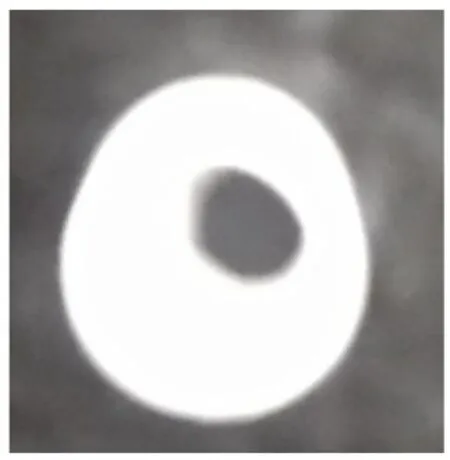
圖5 十水草酸鈰在N2氣氛下的灼燒產物Fig.5 Calcined product of cerium oxalate decahydrate under N2 atmosphere
O2氣氛下,在30~800 ℃之間進行升溫,得到如圖6所示的TG以及DSC曲線。最后得到的產物呈現淺黃色(見圖7),CeO2的顏色與文獻中報道一致。因此,從上述結果推測在O2氣氛下,草酸鈰水合物的熱分解主要有2步:首先,產品在40~260 ℃之間失去10個結晶水,對應DTA曲線上峰頂溫度為150 ℃的吸熱峰。該步的實驗失量率為24.56%,理論計算值為24.86%。故確定本實驗產品為Ce2(C2O4)3·10H2O。此外,在270~450 ℃之間,Ce2(C2O4)3直接分解為CeO2,同時釋放出CO2和CO,對應DTA曲線上峰頂溫度350 ℃的尖銳的放熱峰,放熱主要由3價鈰氧化以及產生的CO發生氧化反應生成CO2所致。該步的理論失量率為27.62%,實驗失量率為29.68%。與N2氣氛中有所不同,該步驟釋放出的CO直接與O2反應,轉化為CO2。分解過程中同時沒有單質C的生成,因此最后產物呈現淺黃色。溫度升高到450 ℃以上時,草酸鈰水合物已經基本分解完全。
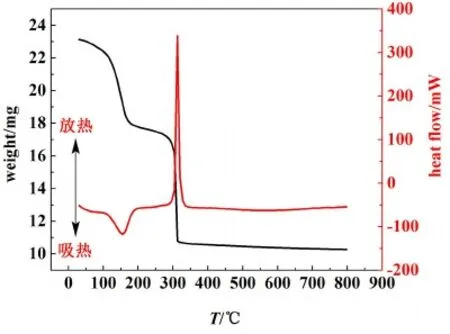
圖6 O2氣氛下的十水草酸鈰的TG/DSC曲線Fig.6 TG/DSC curves of cerium oxalate decahydrate under O2 atmosphere

圖7 十水草酸鈰在O2氣氛下的灼燒產物Fig.7 Calcined product of cerium oxalate decahydrate under O2 atmosphere
對草酸鈰水合物在N2和O2下灼燒后的產物進行PXRD測試,掃描范圍為20°~80°,掃描速度為8(°)·min-1,得到如圖8所示的PXRD譜圖。從圖8中可以看出,草酸鈰水合物在N2和O2氣氛下完全灼燒后產物的PXRD譜圖一致,均與文獻中報道的CeO2的衍射峰一致。
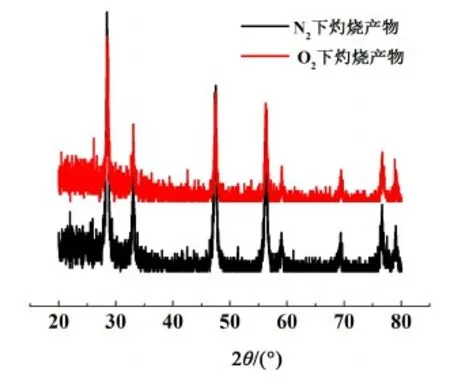
圖8 N2與O2氣氛下十水草酸鈰灼燒產物的PXRD譜圖Fig.8 PXRD patterns of the calcined products of cerium oxalate decahydrate under N2 and O2 atmospheres
綜上,將Ce2(C2O4)3·10H2O在N2與O2氣氛下的熱分解步驟以及相應的機制總結如下。
2.2.1 N2氣氛下
Ce2(C2O4)3·10H2O在N2氣氛下的熱分解過程的可能機制如式(1)~式(4)。
Ce2(C2O4)3·10H2O→Ce2(C2O4)3+10H2O
(40~340 ℃)
(1)
Ce2(C2O4)3→Ce2O2CO3+2CO2+3CO
(350~530 ℃)
(2)
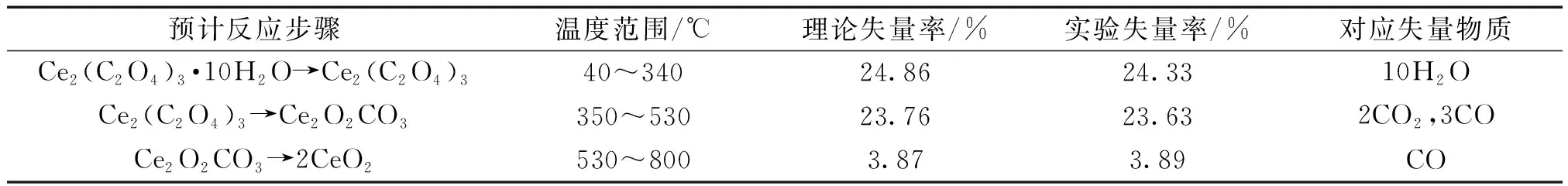
表1 N2氣氛下草酸鈰水合物的熱分解步驟Table 1 Thermal decomposition steps of cerium oxalate hydrate under N2 atmosphere

表2 O2氣氛下草酸鈰水合物的熱分解步驟Table 2 Thermal decomposition steps of cerium oxalate hydrate under O2 atmosphere
2xCO(g)→xCO2(g)+xC(s)
(450 ℃,Boudouard反應)
(3)
Ce2O2CO3→2CeO2+CO (530~800 ℃)
(4)
2.2.2 O2氣氛下
Ce2(C2O4)3·10H2O在O2氣氛下的熱分解過程的可能機制如式(5)~式(7)。
Ce2(C2O4)3·10H2O→Ce2(C2O4)3+10H2O
(40~260 ℃)
(5)
Ce2(C2O4)3→2CeO2+2CO2+4CO
(270~450 ℃)
(6)
CO+1/2O2→CO2
(7)
2.3 十水草酸鈰[Ce2(C2O4)3·10H2O]在O2氣氛下的熱分解動力學
由2.2節可知,在N2氣氛下對十水草酸鈰進行煅燒時,煅燒產物表面附著有黑色的炭黑,因此N2不適合作為煅燒制備CeO2的合適氣氛,而O2可以作為制備CeO2的氣氛。因此本研究進一步對草酸鈰十水合物在O2氣氛下灼燒時的熱分解動力學進行考察。取適量樣品,設定樣品升溫速率分別為5、7、10、15和20 ℃·min-1, 在30~800 ℃之間進行TG/DSC實驗。實驗得到的TG、DTG和DTA曲線分別如圖9~圖11所示。從圖9~圖11中可以看出,隨著升溫速率的增大,熱失量過程會向右移動,相應的DTG和DTA曲線上峰頂溫度和峰開始的溫度也會向溫度增大的方向移動。
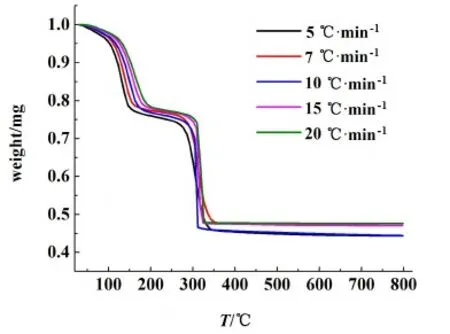
圖9 O2氣氛下不同加熱速率下的TG曲線Fig.9 TG curves under different heating rates in O2 atmosphere
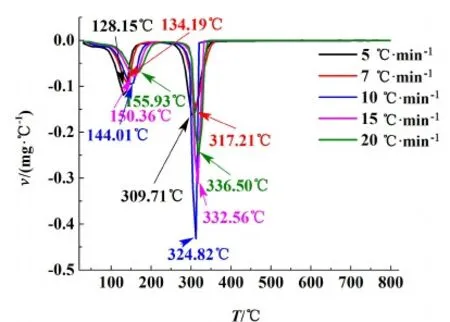
圖10 O2氣氛下不同加熱速率下的DTG曲線Fig.10 DTG curves under different heating rates in O2 atmosphere
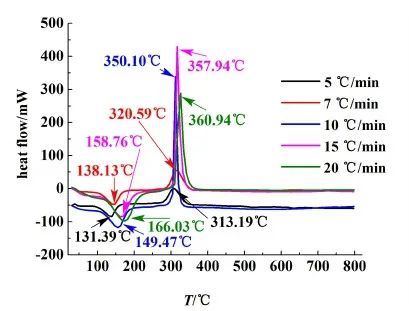
圖11 O2氣氛下不同加熱速率下的DTA曲線Fig.11 DTA curves under different heating rates in O2 atmosphere
對于第1步脫水過程,利用積分等轉化率法對其動力學參數進行求解,采用的方程為Flynn-Wall-Ozawa方程,方程形式如式(8)[18]:
(8)
式(8)中:G(α)表示反應機理函數的積分表達形式;β表示升溫速率,℃·min-1;A代表阿倫尼烏斯頻率因子,min-1;E表示活化能,J·mol-1;T表示溫度,K;α表示質量轉化率,定義如式(9):
(9)
式(9)中:m0、mt和m∞分別代表樣品最初質量、t時刻質量和最終質量;t為時間。
由式(9)可知,對于任何轉化率α,作lgβ-1/T直線圖,直線斜率為-0.457E/R,由此可以求出反應活化能,而且所得活化能和反應機理函數G(α)無關。
對于第1步脫水過程,在不同加熱速率下到達不同轉化率的溫度結果如表3所示,并將數據按照FWO方程擬合的結果同樣列于表3中,數據擬合圖如圖12所示。
由表3和圖12可知,對于第1段脫水過程,當轉化率在0.1~0.9范圍時,活化能數值處于53.50~65.63 kJ·mol-1,繪制第1步活化能隨轉化率變化的曲線圖,結果如圖13所示。由圖13可知在轉化率為0.1~0.9時,隨著轉化率的增大,活化能也逐漸小幅增大。
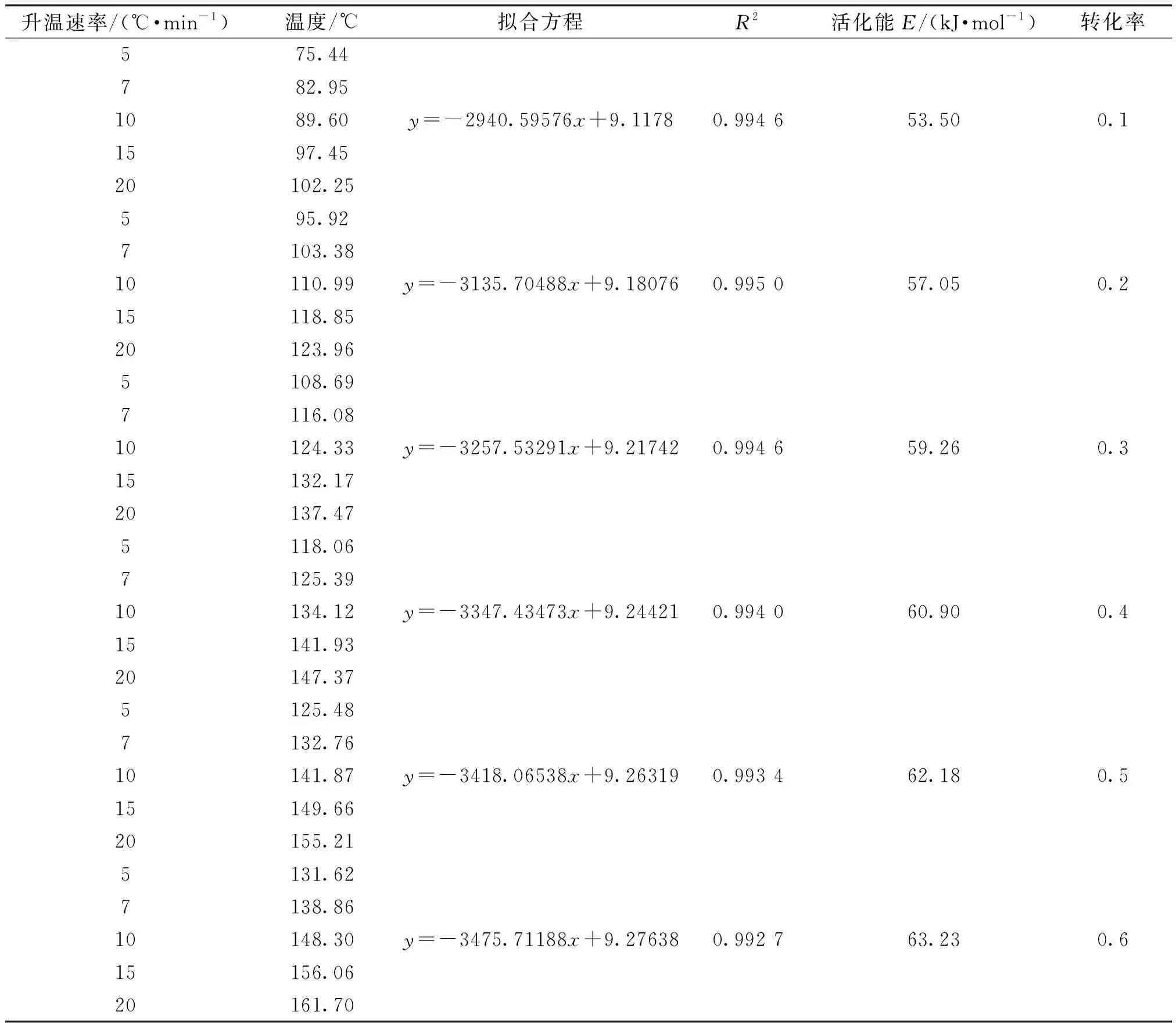
表3 十水草酸鈰熱分解第1步等轉化率法求解結果Table 3 The results of the first step of thermal decomposition of cerium oxalate decahydrate by using isoconversional method
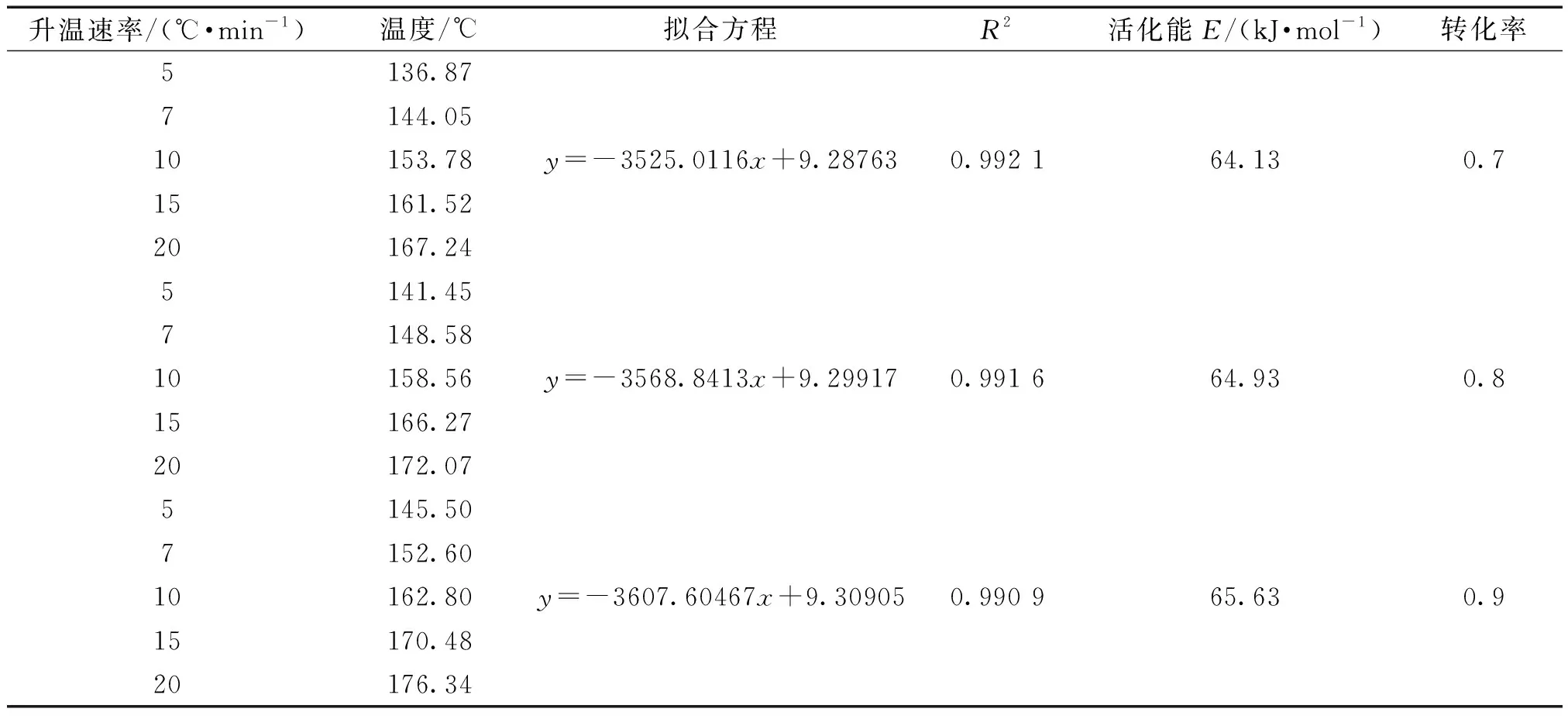
續表3
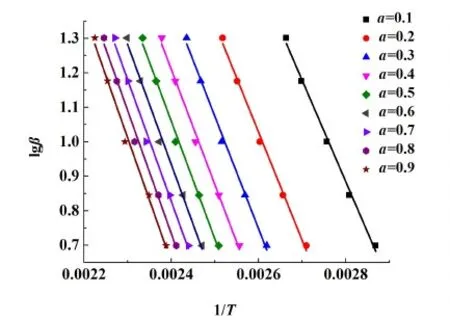
圖12 利用FWO等轉化率法進行第1段脫水過程的 動力學分析Fig.12 Kinetic analysis of the first dehydration process by using FWO isoconversional method
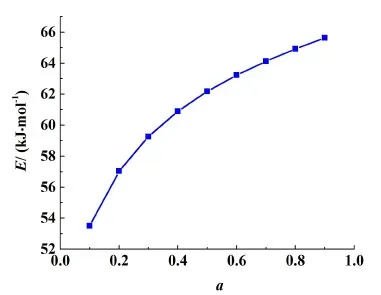
圖13 第1段脫水過程活化能隨轉化率變化趨勢曲線Fig.13 The variation trend of activation energy when the conversion rate varying in the first stage
下面對第1步脫水過程的具體動力學方程進行求解,同樣利用FWO方程[式(8) ]。
選取不同的反應機理函數G(α),對lgG(α)-1/T作圖,選取相關系數R2好且活化能數值符合利用等轉化率法得到的活化能的動力學方程。本研究中選取了常見的30種反應機理函數。對不同加熱速率下的動力學方程進行擬合,發現式(10)具有很好的相關系數,且活化能取值合理。擬合結果見表4。
G(α)=α3/2
(10)
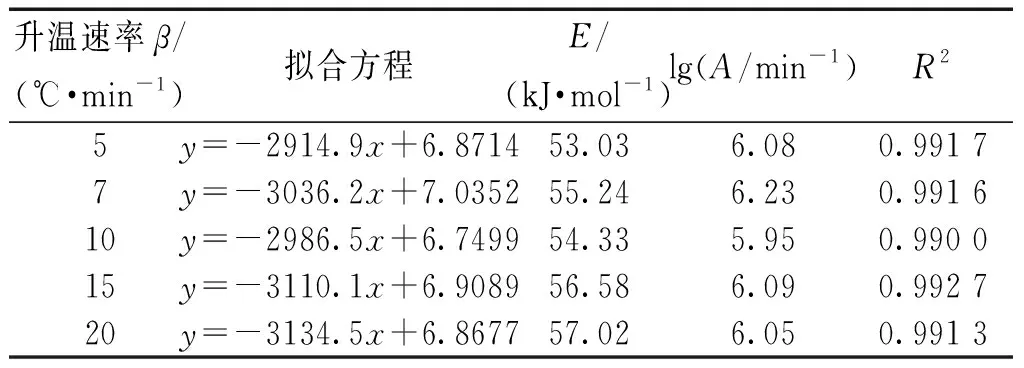
表4 十水草酸鈰熱分解第1步動力學參數求解結果Table 4 Kinetic parameters of the first stage of thermal decomposition of cerium oxalate decahydrate
采用式(10)對不同加熱速率下的脫水動力學過程進行擬合,并與實驗得到動力學曲線進行了比較,比較結果見圖14。
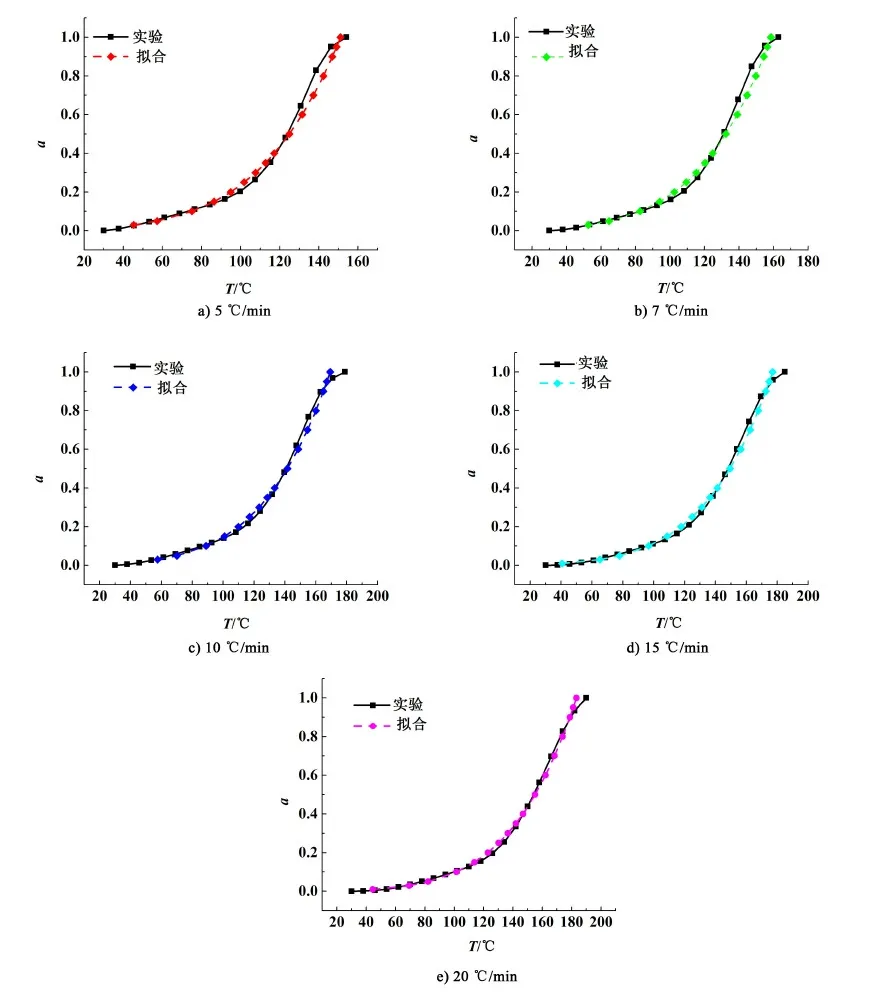
圖14 第1段脫水過程在不同加熱速率下的實驗與擬合的熱分解動力學曲線Fig.14 Experimental and fitted thermal decomposition kinetic curves of the first stage under different heating rates
由圖14可知,式(10)可以很好地擬合不同加熱速率下第1段脫水過程的熱分解動力學,由此總結出第1段脫水過程在不同加熱速率下的動力學方程,結果如表5所示。
對于草酸鈰十水合物的第2步熱分解過程,由于第2步分解過程在采用等轉化率法計算活化能時,lgβ與1/T之間的相關性較差,因此未采取等轉化率法求解活化能。首先根據Kissinger方法,確定了活化能的一個大概值。

表5 十水草酸鈰熱分解第1步動力學方程求解結果Table 5 Kinetic equation of first stage of thermal decomposition of cerium oxalate decahydrate
將O2氣氛下草酸鈰水合物在不同升溫速率下的第2步熱失量反應的起始峰溫和峰頂溫度總結在表6中。
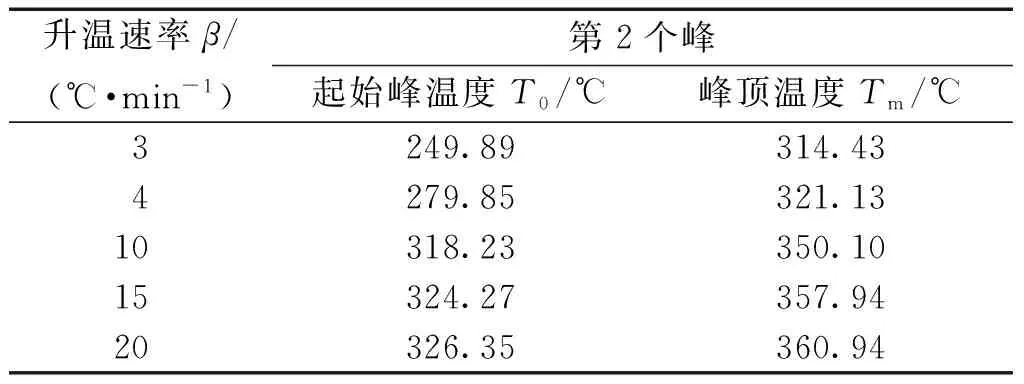
表6 十水草酸鈰熱分解第2步溫度數據Table 6 Temperature data of the second step of thermal decomposition of cerium oxalate decahydrate
根據Kissinger法[19-20]:
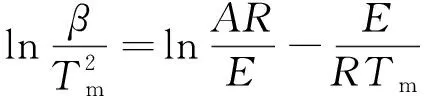
(11)
式(11)中:A為指前因子;R為氣體常數;E為活化能;Tm為峰頂溫度。
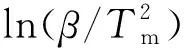
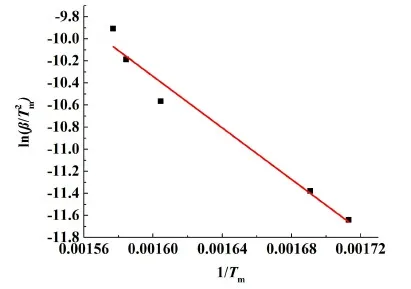
圖15 Kissinger法求解十水草酸鈰熱分解第2步活化能Fig.15 The activation energy of the second step of thermal decomposition of cerium oxalate decahydrate by using Kissinger method
利用Kissinger法求解出草酸鈰水合物熱分解第2步的活化能約為97.00 kJ·mol-1, 指前因子為lnA=17.69。然后依據固態物質熱分解的基本規則[Ea=(80~250) kJ·mol-1, lnA=(7~30)][21]選取了每一步加熱速率下的相關系數最好,符合熱分解基本規則,且活化能數值與由Kissinger法求出的活化能數值最接近的動力學方程,結果如表7~表8所示。當升溫速率為3、4、5和7 ℃·min-1時,式(12)可以很好地擬合實驗動力學曲線。當升溫速率為10、15和20 ℃·min-1時,式(13)可以很好地擬合實驗動力學曲線。
G(α)=[-ln(1-α)]2/3
(12)
G(α)=α1/2
(13)
將實驗得到的動力學曲線與擬合得到的動力學曲線進行比較,比較結果如圖16所示。
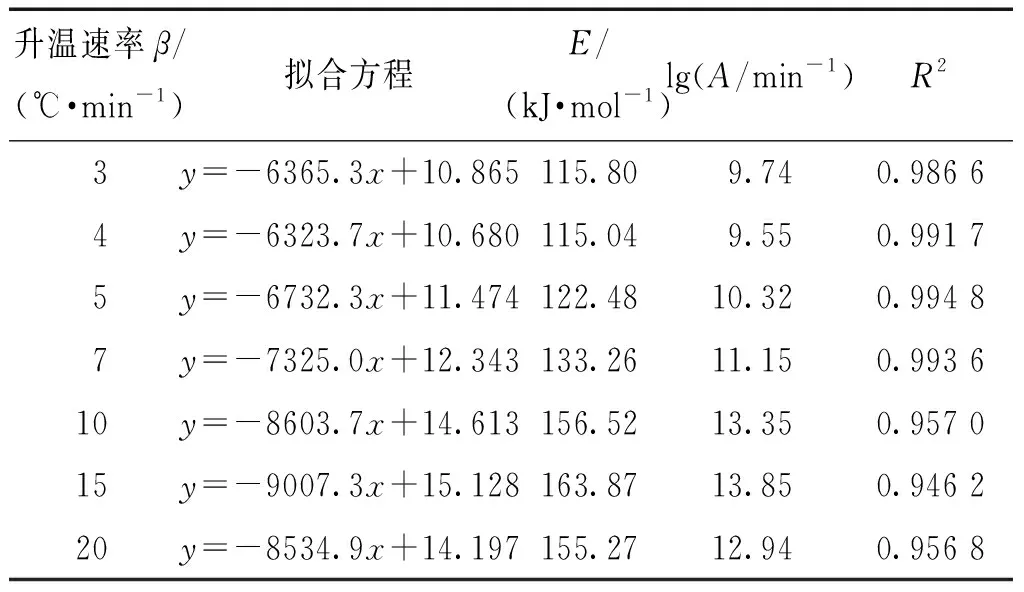
表7 十水草酸鈰熱分解第2步動力學參數求解結果Table 7 The kinetic parameters of second stage of thermal of cerium oxalate decahydrate
將十水草酸鈰在氧氣氣氛下以10 ℃·min-1煅燒時的熱分解動力學參數總結(見表9),并與文獻值進行比較,發現本研究得到的十水草酸鈰2步熱分解的活化能與文獻報道值比較接近。
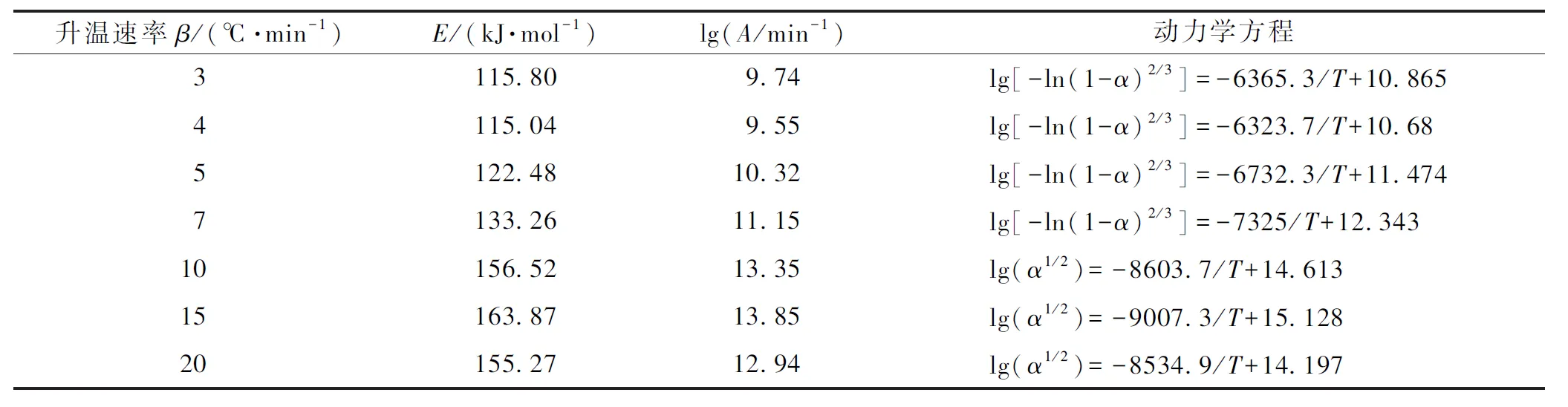
表8 十水草酸鈰熱分解第2步動力學方程求解結果Table 8 The kinetic equations of second stage of thermal decomposition of cerium oxalate decahydrate

圖16 第2段脫水過程在不同加熱速率下的實驗與擬合的熱分解動力學曲線Fig.16 Experimental and fitted thermal decomposition kinetic curves of the second stage under different heating rates

表9 十水草酸鈰熱分解動力學參數匯總Table 9 Summary of thermal decomposition kinetic parameters of cerium oxalate decahydrate
3 結論
利用TG-DSC法研究了十水草酸鈰在N2和O2氛圍下煅燒過程的差異及其分解動力學機理。結果表明十水草酸鈰在N2和O2氣氛下加熱煅燒時會經歷不同的熱分解過程,在N2氣氛下,十水草酸鈰的熱分解過程歷經3步,首先十水草酸鈰脫去十分子結晶水生成Ce2(C2O4)3,而后Ce2(C2O4)3先分解得到中間產物Ce2O2CO3,最后Ce2O2CO3進一步熱分解生成CeO2,最后煅燒產物表面附著有單質C,導致煅燒產物呈現黑色。而在O2氣氛下,十水草酸鈰熱分解過程歷經2步,第1步同樣是脫去十分子結晶水生成Ce2(C2O4)3,而后Ce2(C2O4)3直接熱分解為CeO2,最后煅燒產物呈現淺黃色。此外,本研究也采用了Flynn-Wall-Ozawa模型對十水草酸鈰在O2氣氛下的熱分解動力學參數進行了求解,對于第1步脫水過程,當轉化率在0.1~0.9范圍內,活化能處在53.50~65.63 kJ·mol-1。對于第2步熱分解過程,當升溫速率為10 ℃·min-1時,活化能為156.52 kJ·mol-1。本研究對深入了解十水草酸鈰在不同氣氛下煅燒的熱分解過程及熱分解機理提供了重要的理論依據,并且為后續煅燒制備CeO2也提供了重要的熱力學及動力學數據。

