模擬子宮微環境誘導大鼠胎盤間充質干細胞向子宮內膜上皮細胞方向分化的實驗研究*
李愛麗,趙飛,張彤艷,馬志玲,肖雅琳
(邯鄲市中心醫院1.東區婦四科,2.西區普外二科 河北 邯鄲056001)
子宮內膜不僅具有高度的增殖活性,還具有周期性更新的特性,并受卵巢激素變化的調節[1]。子宮內膜的來源與循環的骨髓干細胞有關,也可能與內膜中殘留的胚胎干細胞有關[2]。胎盤間充質干細胞(placental mesenchymal stem cells,PMSCs)屬于一類多能干細胞,是從胎盤組織中分離培養出來的。PMSCs 具有易貼壁生長的特性,其生物學特性與骨髓間充質干細胞相似,具備高自我更新和多向分化的能力[3-4]。對哺乳類動物和人類來說子宮內膜是維持正常生殖能力的必要條件[5]。有研究表明[6],子宮內膜損傷可導致不孕,損傷的子宮內膜會出現大量的瘢痕化,導致子宮供血不足,影響胚胎著床。由于機體子宮功能和內環境的有序性和復雜性,因此目前無良好的治療方法,隨著干細胞技術的發展,臨床開始使用干細胞誘導分化修復子宮內膜[7-8]。本研究模擬子宮微環境誘導大鼠PMSCs 向子宮內膜上皮細胞方向分化,以期為臨床運用干細胞分化修復子宮內膜提供依據。
1 材料與方法
1.1 材料
實驗動物:選擇2月齡的SD 大鼠,體重150~180 g,由南京君科生物工程有限公司提供。實驗試劑:DMEM 培養基(美國HyClone 公司),兔抗大鼠波形蛋白抗體、小鼠抗大鼠角蛋白抗體(美國Gibco 公司),兔抗大鼠細胞角蛋白7(CK-7)、細胞角蛋白18(CK-18)、細胞角蛋白19(CK-19)、上皮膜抗原(EMA)抗體(上海鈺博生物科技有限公司),DMEM/F12 培養液(杭州吉諾生物醫藥技術有限公司)。
1.2 方法
1.2.1 大鼠PMSCs 原代培養及傳代將雌、雄大鼠按1∶3 合籠,于第2 天上午8:00 查看是否有陰栓形成,如有則確定為受孕,記為ES。進入無菌室,將孕13.5 d 的SD 大鼠處死,75%酒精消毒20 min 后,放入超凈工作臺內,打開腹腔及子宮,可見有成串胎鼠,剪開羊膜后從臍帶胎盤端離斷,收集所有胎盤,用無菌鹽水沖洗,小心去除殘余臍帶和羊膜組織,將剩余的胎盤組織用無菌組織剪剪成1 mm×1 mm×1 mm 的小塊。將組織放入50 ml 的離心管中,加入混合酶(胰蛋白酶∶I 型膠原酶=1∶1),放入37℃水浴箱內消化50 min,消化過程中每隔20 min 搖動1 次,最終用含10%胎牛血清的DMEM 終止消化,隨即用200 μm的不銹鋼篩濾掉未消化的組織,過濾后的細胞液以1 000 r/min 離心10 min,收集細胞沉淀。在一次性的15 ml 離心管內加入5 ml 由1.131 g/ml 的percoll 液和PBS 混合制成1.073 g/ml 的細胞分離液,用培養基將細胞沉淀混勻后緩慢加入細胞分離液中,然后900 r/min 離心25 min,離心后用移液管小心地吸取白膜層,PBS 洗滌收集的細胞,離心后去除PBS,最終用含10% FBS 的DMEM 培養液吹洗管內細胞制成懸液,將細胞以1×l06/ml 接種至標記好的25 cm×25 cm 培養瓶中,置于培養箱內,其溫度設置為37℃,CO2濃度為5%。3 d后首次換液,倒置相差顯微鏡下觀察細胞形態和細胞增殖狀況。根據細胞生長情況每2~3 天換液1 次,待細胞鋪滿瓶底約80%以上時,消化細胞,以l∶2 比例進行傳代。
1.2.2 繪制細胞生長曲線取生長良好的第3 代PMSCs 制備單細胞懸液,調整細胞濃度為2×104個/ml 接種到24 孔板,每孔接種0.5 ml,放入37℃、5% CO2培養箱內培養,每天隨機選取3 個培養孔,胰酶消化后計算每孔細胞數,取3 孔內細胞數均值,待細胞長滿時停止計數。以時間為橫坐標,細胞數為縱坐標,繪制細胞生長曲線,連續觀察14 d,未計數細胞每3 天換液1 次。
1.2.3 子宮內膜誘導培養液的制備將1%戊巴比妥鈉40 mg/kg 麻醉后的雌性SD 大鼠,置于超凈工作臺上消毒,準備各種器械、試劑、耗材,打開腹腔取出雙側子宮,用PBS 沖洗3 次以去掉組織表面血污,放入加有雙抗、PBS 的60 mm 培養皿中清洗,小心去除最外層的漿膜層,縱行剖開后再橫向剪成0.3~0.5 cm 的小段,稱取濕重,按100 g/L 加入DMEM 培養基,4℃搖床震蕩2 h,4℃冰箱過夜,4℃、3 000 r/min離心30 min,離心后吸取上清液,用一次性無菌過濾器過濾至新的離心管內,密封,置入-20℃冰箱冷凍保存。
1.2.4 大鼠PMSCs 體外誘導分化子宮內膜細胞取出裝有大鼠第3 代PMSCs 的培養瓶,去除原有培養基,向瓶內加入少許消化酶,以能覆滿瓶底為限,室溫下消化1~2 min 后輕輕搖晃,當顯微鏡下發現細胞回縮、間隙增大、細胞變類圓形時,立即終止消化,吸除培養瓶內的混合液。加入培養基,用移液管輕輕吹打瓶壁細胞制成細胞懸液,以1×106個/ml 接種于60 mm 培養皿,待細胞達80%以上融合時,吸除原有培養基,加入無菌子宮內膜誘導培養液,放入培養箱內繼續培養,每3 天換1 次液,連續14 d,對照組DMEM 培養基培養。每天倒置顯微鏡下觀察細胞生長情況,當細胞基本長滿培養皿底時,吸除舊的培養液,加入消化酶少許,以能覆滿瓶底為限,倒置顯微鏡下觀察扁平梭形細胞脫落情況。當觀察到大多數扁平梭形的細胞變圓并開始脫落時,立即加入2 ml 含10%胎牛血清的培養基終止消化。用移液管緩慢輕輕地吹打細胞后棄去培養皿內液體;再用少許培養基沖洗2 次,加入培養基后繼續培養3 d,再次觀察細胞情況。若鏡下仍見扁平梭形細胞,可再重復1 次上述胰酶消化法,將扁平梭形細胞去除。
1.2.5 免疫熒光化學法檢測細胞中波形蛋白和角蛋白的表達將第3 代PMSCs 以5×104個/ml 接種于24 孔培養板中,培養液為含5%FBS 的DMEM/F12,分為實驗組和對照組,實驗組使用含有20%的子宮內膜誘導培養液,對照組使用含有5%的FBS 的培養基進行培養。倒置顯微鏡下觀察細胞的形態和增殖情況,培養5 d 后,棄去培養基,使用PBS清洗3 次,5 min/次,棄去PBS,將蓋玻片取出,擺放于鋪有蠟膜的150 mm×150 mm 的培養皿中,細胞面朝上并做標記。用4%的多聚甲醛固定15 min,再用PBS 清洗2 次,3 min/次,加入5%的BSA 在室溫下封閉處理30 min。將兔抗大鼠波形蛋白抗體、小鼠抗大鼠角蛋白抗體按1∶50 在封閉液中稀釋,40 μl/蓋玻片,在室溫下孵育1 h。將一抗吸除,使用PBS 清洗3 次,5 min/次,加入5%的BSA 在室溫下封閉處理30 min,吸除封閉液,用PBS 清洗3 次,5 min/次。分別加入1∶500 稀釋的FITC 標記的抗兔IgG、抗小鼠IgG,40 μl/蓋玻片,在室溫下孵育1 h。吸除二抗,用PBS 清洗3 次,每次10 min。滴加0.5 μg/ml 的DAPI 進行染核處理,40 μl/蓋玻片,在室溫下孵育2 min,用PBS 清洗3 次,5 min/次。用蒸餾水漂洗1 次,將蓋玻片夾起,吸水紙吸干,將細胞面朝下,封邊處理,做標記。在熒光顯微鏡下閱片,拍照。
1.2.6 實時熒光定量PCR(qRT-PCR)檢查CK7、CK18、CK19、EMA mRNA 相對表達量將第3代PMSCs 以5×104個/ml 接種于6 孔培養板中,培養液為含5% FBS 的DMEM/F12,分為實驗組和對照組,實驗組使用含有20%的子宮內膜誘導培養液,1×10-7β-雌二醇,對照組使用含有5%的FBS 的培養基。培養5 d 后,用PBS 清洗PMSCs6 孔培養板,加入Trizol 0.6 ml/孔,輕輕吹打,收集細胞,置于1.5 ml的離心管中,室溫下靜置5 min,再加入120 μl 的氯仿(約為RNAiso 的1/5 體積量),劇烈震蕩30 s,室溫下靜置5 min,4℃下12 000 r/min,離心15 min,取其上清液,移入400 μl 的異丙醇,震蕩處理,搖勻,室溫下靜置5 min,4℃下12 000 r/min,離心10 min,棄除上清液,將75% 1 ml 的乙醇加入至離心管中清洗沉淀,4℃下12 000 r/min,離心5 min,棄除上清液,留取RNA 沉淀,重復上述步驟,徹底清洗RNA 沉淀,在室溫環境下進行干燥沉淀處理,加入20 μl DEPC 水溶解RNA 沉淀,輕輕吹打,取20 μl 的RNA,加入198 μl 樣品稀釋液,測定OD值、濃度,進行逆轉錄反應,依次加入反應物2.5 μl稀釋10 倍的PCR 緩沖液,1.5 μl MgCl2溶液,0.5 μl正向引物和反向引物,最后加水配成總體積為25 μl的反應體系。CK-7 正向引物:5'-GTTCCATTTGCA AAGGCTGT-3';反向引物:5'-CAGGTGGTTATCCC GAAAGA-3'。CK-18 正向引物:5'-GCTCTGCCAGG CGCCCAGCTACGG-3';反向引物:5'-CAGGCGGTC GTTCAGGCTTTGCATG-3'。CK-19 正向引物:5'-TCGCCAAGATCCTGAGTGA-3'; 反向引物:5'-TCCGTTTCTGCCAGTGTGT-3'。EMA 正向引物:5'-GTACCTCCTCTCACCTCCTCCAA-3';反向引物:5'-CGTCGTGGACATTGATGGTACC-3'。GAPDH 正向引物:5'-AGCGGGAAATCGTGCGTG-3';反向引物:5'-CAGGGTACAGGTGGTGCC-3'。PCR 反應條件為:94℃預變性1 min;55℃變性1 min;72℃退火1 min,進行35 個循環,72℃延伸5 min,重復最少3 次,GAPDH 作為內參照,采用2-△△Ct法計算CK-7、CK-18、CK-19、EMA mRNA 相對表達量。
1.2.7 Western blotting 檢測波形蛋白和角蛋白相對表達量將第3 代PMSCs 以5×104個/ml 接種于24 孔培養板中,培養液為含5%FBS 的DMEM/F12,分為實驗組和對照組,實驗組使用含有20%的子宮內膜誘導培養液,1×10-7β-雌二醇,對照組使用含有5%的FBS 的培養基。培養5 d 后,每1×106個細胞加入500 μl 的細胞裂解液,細胞裂解后提取總蛋白,BAC 法檢測蛋白濃度,取等量的蛋白樣本25 μg,進行5% 的SDS-PAGE,將蛋白轉移至PVDF 膜,10%的脫脂奶粉封閉2 h,分別加入兔抗大鼠波形蛋白抗體、小鼠抗大鼠角蛋白抗體和β-actin 抗體,在4℃環境下孵育過夜,TBST 清洗3 次,加入ECL 熒光底物顯色,在暗室使用高敏感的X 射線膠片進行曝光顯影。檢測波形蛋白、角蛋白條帶和β-actin 蛋白條帶的灰度值,目的蛋白相對表達量=目的蛋白條帶灰度值/內參條帶灰度值。
1.3 統計學方法
數據分析采用SPSS 20.0 統計軟件。計量資料采用均數±標準差(±s)表示,比較用t檢驗。P<0.05 為差異有統計學意義。
2 結果
2.1 大鼠PMSCs 的形態特點
原代細胞剛接種至培養瓶時可見大量懸浮圓形細胞(見圖1A),接種7 d 后倒置顯微鏡下看到細胞貼著培養瓶的壁生長,圓形細胞開始延伸,變成梭形或不規則形,輪廓清晰,仍有部分細胞呈圓形(見圖1B),培養14 d 后細胞幾乎鋪滿瓶,細胞的形態為漩渦狀排列的均一長梭形細胞,可傳代(見圖1C);一般傳代后細胞7~8 d 即可擴增至再次傳代。
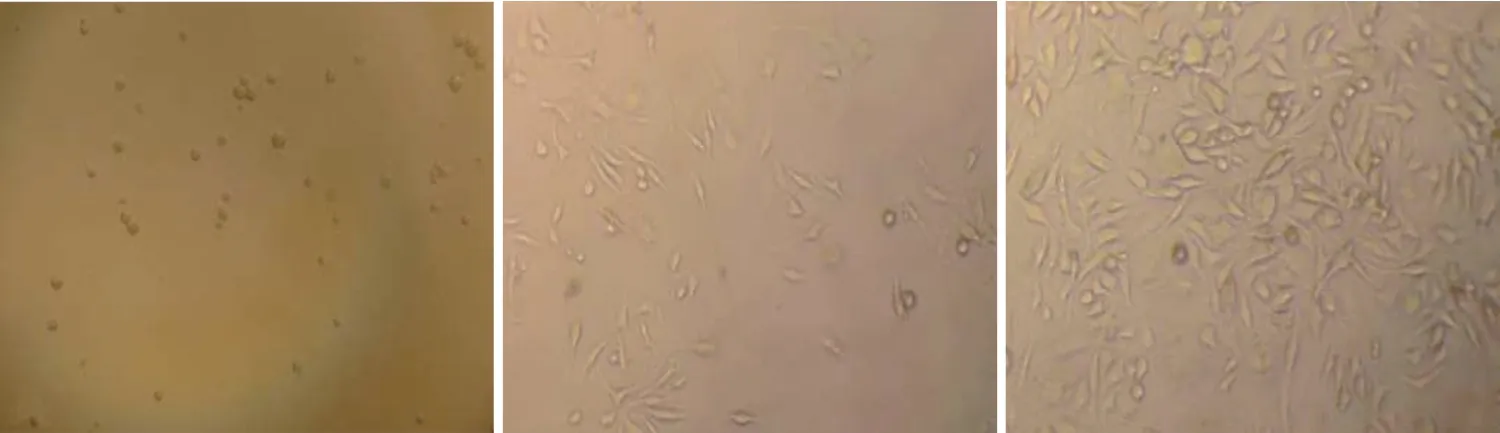
圖1 大鼠PMSCs的形態特點
2.2 細胞生長曲線
細胞隨著培養時間的延長,數量逐漸增加。見圖2。
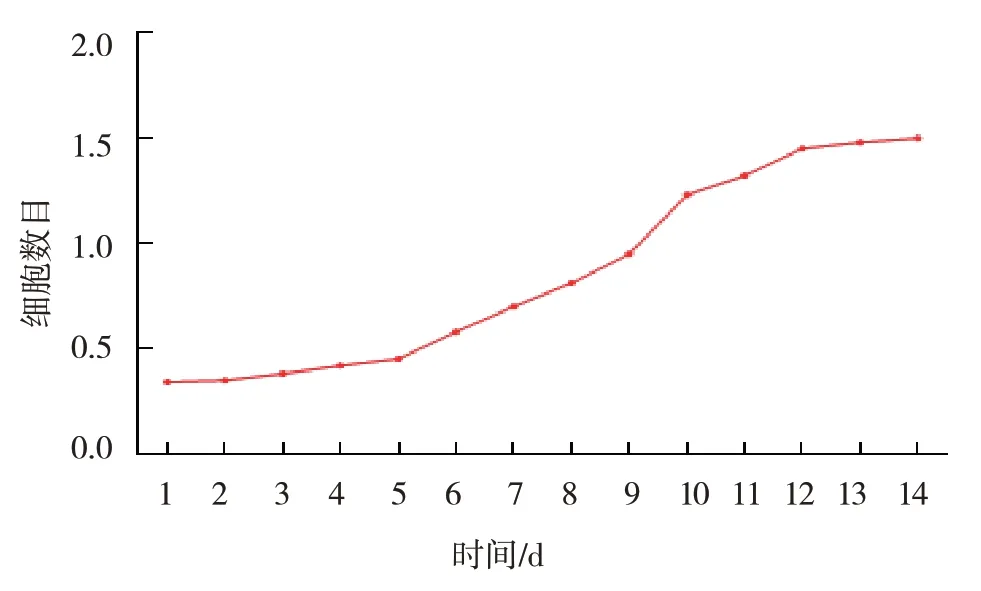
圖2 細胞生長曲線圖
2.3 大鼠PMSCs 向子宮內膜細胞誘導分化特征及角蛋白、波形蛋白表達情況
誘導14 d 后,顯維鏡下觀察部分細胞呈基質細胞改變,較扁平,呈梭形,核不明顯,排列無規律;部分其他細胞多角形,排列成團,核比較圓而大,呈現出上皮樣細胞的改變。用胰酶消化法獲得較高純度的上皮樣細胞。HE 染色可見上皮樣細胞均呈多角形,胞漿呈淡紅色,胞核呈淡藍色(見圖3)。細胞免疫熒光檢測角蛋白結果顯示,實驗組大部分細胞出現綠色熒光,即為角蛋白表達呈陽性,對照組只有胞核為藍色熒光。說明PMSCs 不表達角蛋白,誘導后的角蛋白為陽性,即呈現上皮樣細胞改變(見圖4A、4B)。細胞免疫熒光檢測波形蛋白結果顯示,實驗組細胞出現大量綠色熒光,對照組只有胞核為藍色熒光。說明PMSCs 不表達波形蛋白,誘導后的波形蛋白為陽性,即呈現上皮樣細胞改變(見圖4C、4D)。
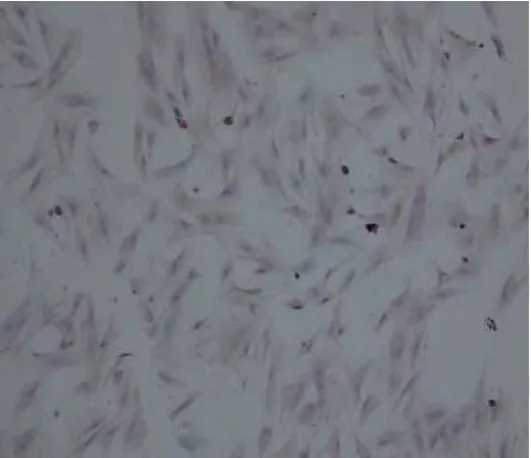
圖3 上皮樣細胞改變(HE染色×50)
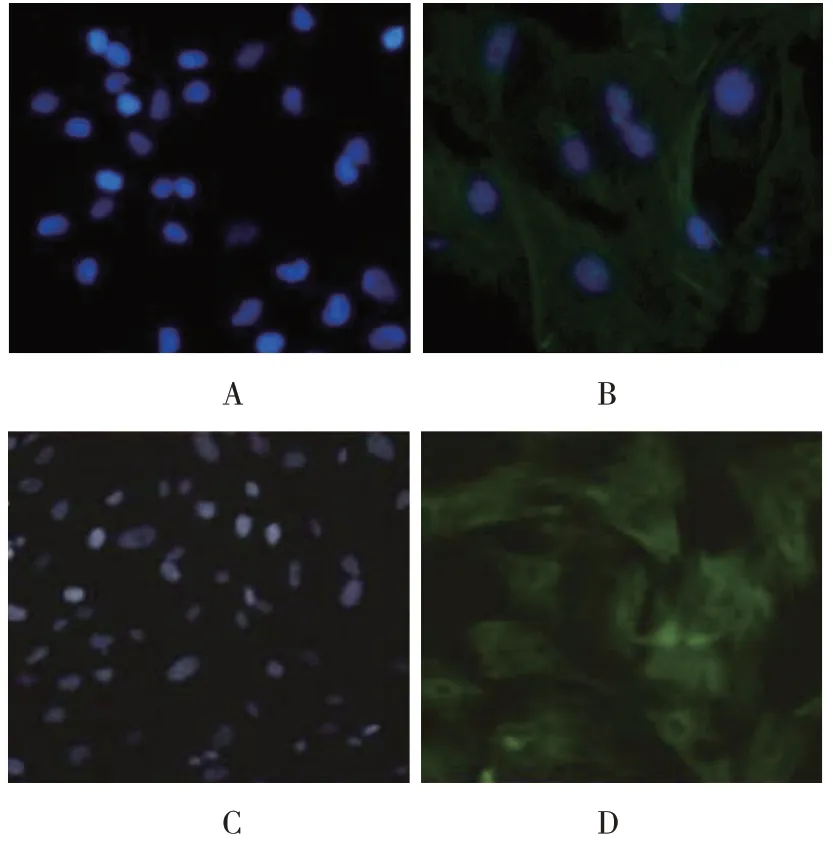
圖4 角蛋白、波形蛋白表達情況(免疫熒光法×100)
2.4 兩組CK-7、CK-18、CK-19、EMA mRNA 相對表達量比較
兩組CK-7、CK-18、CK-19、EMA mRNA 相對表達量比較,差異有統計學意義(P<0.05)。實驗組高于對照組。見表1。
表1 兩組CK-7、CK-18、CK-19、EMA mRNA相對表達量比較(±s)
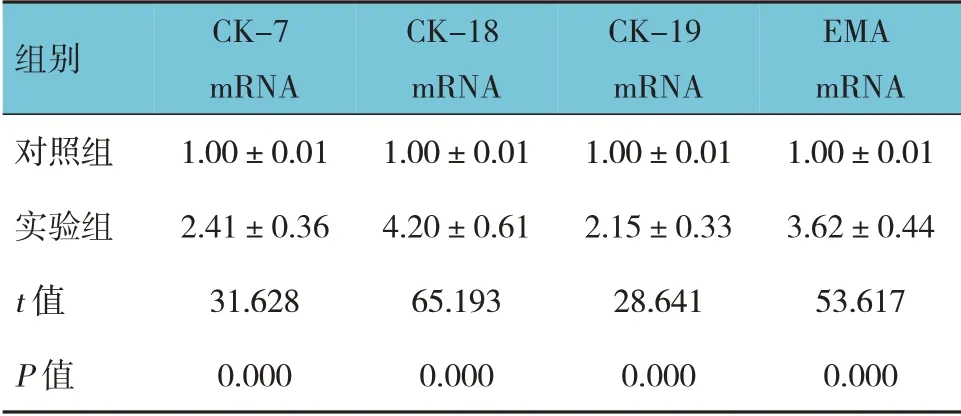
表1 兩組CK-7、CK-18、CK-19、EMA mRNA相對表達量比較(±s)
組別對照組實驗組t 值P 值CK-7 mRNA 1.00±0.01 2.41±0.36 31.628 0.000 CK-18 mRNA 1.00±0.01 4.20±0.61 65.193 0.000 CK-19 mRNA 1.00±0.01 2.15±0.33 28.641 0.000 EMA mRNA 1.00±0.01 3.62±0.44 53.617 0.000
2.5 兩組波形蛋白和角蛋白的相對表達量比較
兩組波形蛋白和角蛋白相對表達量比較,差異有統計學意義(P<0.05),實驗組高于對照組。見圖5和表2。

圖5 波形蛋白和角蛋白的相對表達量比較
表2 兩組波形蛋白和角蛋白相對表達量比較(±s)
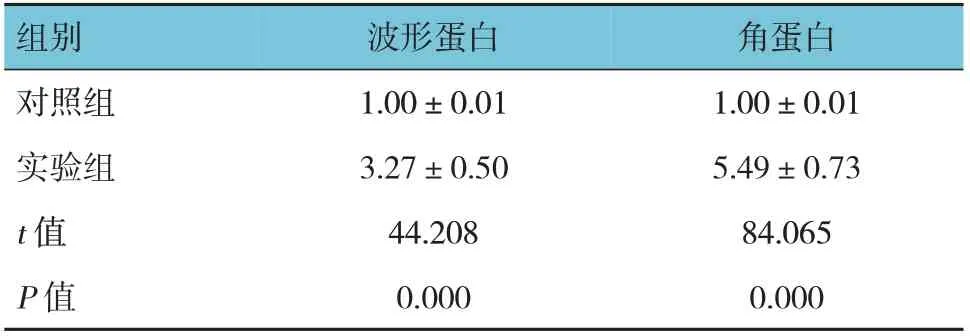
表2 兩組波形蛋白和角蛋白相對表達量比較(±s)
組別對照組實驗組t 值P 值波形蛋白1.00±0.01 3.27±0.50 44.208 0.000角蛋白1.00±0.01 5.49±0.73 84.065 0.000
3 討論
間充質干細胞屬于一類多能干細胞,能夠在多類組織中提取,例數胎盤、骨髓及脂肪組織中,在一定條件下間充質干細胞會被誘導分化為子宮內膜上皮細胞[9]。間充質干細胞具有較高的免疫調節能力和較低的免疫原性,因此使用干細胞對不孕患者進行治療得到了廣泛的關注[10]。PMSCs 是從胎盤中提取出來的,其具備多向分化的潛能和自我更新增殖的能力,能夠通過誘導分化為不同種類的細胞,如成骨細胞、子宮內膜上皮細胞等[11-13]。子宮維持著女性的生殖能力,其中子宮內膜分為基底層和功能層,基底層是由疏松結締組織組成,而功能層更新、脫落和再生與月經周期有關[14]。子宮內膜受到損傷會導致閉經、不孕等疾病的發生,對女性的健康和生殖能力產生較大的影響[15]。PMSCs 和骨髓間充質干細胞相似,培養條件相同,且胎盤來源廣泛,取材方便,因此本文模擬子宮微環境誘導大鼠PMSCs 向子宮內膜上皮細胞樣方向進行分化。
本研究提取大鼠PMSCs,并制備子宮內膜誘導培養液,進行大鼠PMSCs 體外誘導分化子宮內膜細胞實驗。有研究實驗發現人和大鼠的子宮內膜的微環境中,PMSCs 可有效分化為子宮內膜上皮細胞[16]。另有研究表明[17],通過移植PMSCs 和雌激素對宮腔粘連患者的治療效果顯著,且治愈性較高,并在后續的治療和體外受精胚胎移入中成功受孕。PMSCs 在子宮微環境中通過誘導可能會向子宮內膜上皮細胞分化,通過對PMSCs 的移植能夠治療子宮內膜干細胞缺失類疾病,能夠作為子宮外干細胞的來源,將子宮內膜組織進行重建,起到治療的作用[18-20]。本實驗中,通過制備子宮內膜條件培養液,誘導PMSCs 向子宮內膜上皮細胞進行分化,結果顯示實驗組PMSCs 向子宮內膜上皮細胞分化成功。亦有實驗[21]通過不同的培養方式誘導PMSCs 向子宮內膜上皮細胞分化,結果顯示在含有20%的子宮內膜誘導培養液,1×10-7β-雌二醇培養液中的PMSCs 向子宮內膜上皮細胞分化成功,與本文結果一致。
細胞角蛋白是一種主要在上皮細胞的骨架上表達的蛋白,能夠有效維持上皮細胞的形態完整性[22]。波形蛋白主要在非表皮細胞和間葉細胞中存在,也在骨骼肌和心肌Z 盤中的Ⅲ型中間纖絲內存在,作為一種纖絲蛋白,能夠維持細胞器和細胞核之間的特定空間。波形蛋白和角蛋白常被應用于間充質干細胞和上皮細胞的表達[23-24]。本實驗通過細胞免疫熒光法檢測細胞中波形蛋白和角蛋白的表達,結果顯示,實驗組大部分細胞出現綠色熒光,即為角蛋白表達呈陽性,對照組只有胞核為藍色熒光。說明PMSCs 不表達角蛋白,誘導后的細胞角蛋白陽性,即呈現上皮細胞改變。實驗組細胞出現大量綠色熒光,對照組只有胞核為藍色熒光。說明PMSCs 不表達波形蛋白,誘導后的細胞波形蛋白陽性,即呈現上皮細胞改變。此結果說明在誘導后PMSCs 成功向子宮內膜上皮細胞分化。有研究[25]提取PMSCs 并制備子宮內膜條件培養液,誘導PMSCs 向子宮內膜上皮細胞進行分化,使用免疫熒光法對波形蛋白和角蛋白進行檢測,結果顯示,誘導后波形蛋白和角蛋白均表達,說明其模擬子宮微環境將PMSCs 誘導至子宮內膜上皮細胞分化成功,與本文研究結果一致。另外本文還對兩組CK-7、CK-18、CK-19、EMA mRNA 相對表達量進行檢測,結果顯示實驗組CK-7、CK-18、CK-19、EMA mRNA 的相對表達量均高于對照組,說明實驗組模擬子宮微環境誘導PMSCs 向子宮內膜上皮細胞分化成功。有研究[26-27]使用RT-PCR 對模擬子宮微環境誘導PMSCs 向子宮內膜上皮細胞分化和單純PMSCs 向子宮內膜上皮細胞分化的CK-7、CK-18、CK-19、EMA 表達情況進行檢測,結果顯示,模擬微環境下的PMSCs 向子宮內膜上皮細胞分化成功,與本文研究結果一致。
綜上所述,PMSCs 在一定的誘導條件下能夠向子宮內膜上皮細胞方向分化,且在內源性間充質干細胞和外源性因素的作用下,誘導PMSCs 向子宮內膜上皮細胞方向分化作用更顯著,為臨床不孕患者使用PMSCs 治療提供依據。

