兩種測定微生物生長速率的實驗方法比較
趙 旎,龍 燕
武漢大學:1.實驗室與設備管理處;2.武漢大學生命科學學院,湖北武漢 430072
檢測微生物生長速率是微生物學和微生物檢驗實驗教學中的重要內容,其在實際應用中也非常廣泛,如耐藥菌株的鑒定、抗菌藥物的篩選等[1-2]。盡管目前實驗教學中有多種檢測微生物生長速率的實驗方法[3],如克隆形成法、比色法、MTT法,但是在實際運用中均存在測定精度不高、實驗成本高、實驗時間冗長、容易造成樣本污染等缺點[4-6]。因此,結合實驗室的實際條件,找到一種適合所在實驗室開展實驗研究,既能提高實驗精度,又能鍛煉學生實驗技能的可行性方案是非常有必要的。筆者在微生物檢驗實驗教學實踐中,結合本實驗室實際情況,以釀酒酵母為實驗材料,比較全自動生長曲線分析儀和多功能酶標儀兩種檢測釀酒酵母生長速率的實驗方法,為本科生和研究生微生物檢驗實驗教學提供借鑒。
1 材料與方法
1.1材料 野生型酵母菌株和對照組酵母菌株(對衣霉素敏感菌株)為本實驗室保存,酵母膏胨葡萄糖(YPD)平板和YPD液體培養基按照文獻[3]制備。
1.2儀器與試劑 全自動生長曲線分析儀(Bioscreen C,美國),多功能酶標儀(BioTek SYNERGY H1,美國),恒溫搖床(博訊,中國)。
1.3方法
1.3.1實驗材料準備 提前2 d把低溫凍存的野生型酵母菌株、對照組酵母菌株通過劃線的方法接種在YPD平板上。實驗前1天晚上再分別挑取單克隆劃線于新的YPD平板上。
1.3.2實驗步驟 (1)在1.5 mL離心管中加入200 μL無菌雙蒸水。(2)用無菌槍頭在YPD平板上分別刮取適量酵母菌,放入步驟(1)的EP管中,充分混勻。(3)吸取50 μL步驟(2)中的酵母菌懸液,用1 mL無菌雙蒸水稀釋,分別取500 μL用酶標儀測定吸光度(A)600值。(4)用含有1.5 μmol衣霉素的液體YPD培養基把步驟(3)中的野生型酵母菌株、對照組酵母菌株分別稀釋成A600為0.1。(5)吸取步驟(4)中的酵母懸液分別放置于100孔培養板(用于全自動生長曲線分析儀,液體體積為400 μL)和48孔培養板中(用于多功能酶標儀,液體體積為600 μL)。(6)100孔培養板放置于全自動生長曲線分析儀中,全自動生長曲線分析儀的設定程序為:30 ℃,振蕩培養,每2 h自動測定一次A600值,持續48 h[7-8]。(7)48孔培養板放置于30 ℃恒溫的水平搖床內,轉速為100 r/min,每間隔2 h將48孔培養板取出,放置于多功能酶標儀中,測定A600值(每次充分搖勻),測定時設定光程校正(自動轉化為標準1 cm的光程)。每次測定完畢,立刻放回恒溫水平搖床內繼續培養。(8)記錄、分析數據,在Excel中繪制生長曲線。
2 結 果
2.1全自動生長曲線分析儀檢測結果 以時間為橫坐標,以A600值為縱坐標,在Excel中繪制出生長曲線,見圖1。野生型酵母菌株與對照組酵母菌株的生長速率呈現出典型的S型趨勢[9]。兩種菌株都在25 h左右進入對數生長期,在35 h左右達到平臺期。整體結果和預期一致,對照組酵母菌株的生長速率低于野生型酵母菌株,表明實驗結果準確無誤。
2.2多功能酶標儀檢測結果 以時間為橫坐標,以A600值為縱坐標,在Excel中繪制出生長曲線圖,見圖2。野生型酵母菌株和對照組酵母菌株在15 h左右進入對數生長期,盡管總體看來對照組酵母菌株的生長速率低于野生型酵母菌株,但是兩條曲線的波動較大,沒有呈現出典型的S型趨勢。特別是A600到達1.0之后,曲線呈現出波浪形,表明此時檢測結果不穩定。
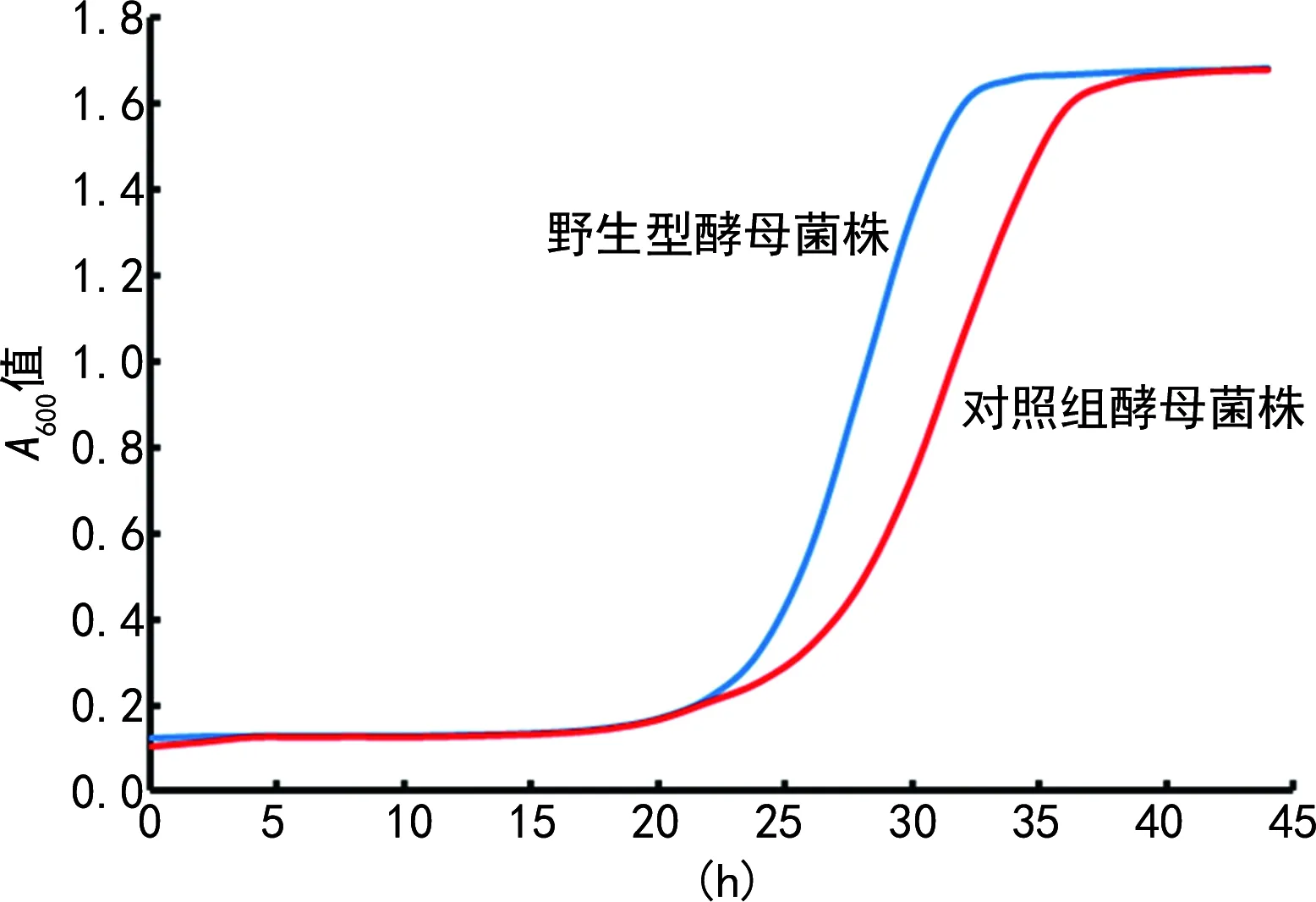
圖1 全自動生長曲線分析儀檢測生長曲線圖
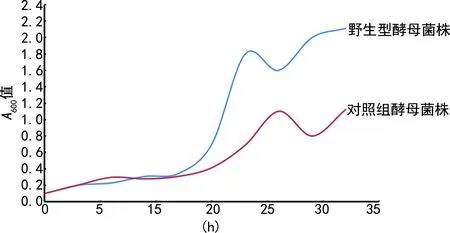
圖2 多功能酶標儀檢測生長曲線圖
3 討 論
檢測微生物生長速率是微生物學和微生物檢驗實驗教學中重要的實驗內容,廣泛應用于基礎醫學和臨床微生物檢驗。涉及的實驗方法主要為平板克隆形成法和生長曲線法,但是這兩種方法均存在一定的不足[10-11]。如平板克隆形成法需要的時間較長,以釀酒酵母實驗為例,需要3 d,實驗前期也需要實驗者經過復雜的細胞濃度計算,如果細胞濃度測定、計算、稀釋出現偏差,經常會出現培養板上克隆太密的情況,無法計數。且平板克隆形成法很難以生長曲線的結果展示。生長曲線法是目前實驗教學中比較常用的方法。在實驗過程中,通常把微生物培養在搖菌管中,每間隔一定時間,在無菌超凈工作臺中取出等量的菌液,轉入比色皿中進行A600值測定。此實驗操作過程較繁瑣,由于需要多次取樣,很容易造成樣本污染。
筆者在指導學生實驗時,采用全自動生長曲線分析儀法和多功能酶標儀2種實驗方法對酵母菌株的生長速率進行檢測,這兩種方法均可以一次性檢測大量的實驗樣本。結果顯示,全自動生長曲線分析儀得出的生長曲線非常完美,是典型的S型趨勢,可以觀察到遲緩期、對數生長期、穩定期,沒有出現異常的數據波動,實驗結果與預期一致。
多功能酶標儀的實驗結果盡管總體看來和預期一致,但是兩條曲線的波動較大,特別是A600值到達1.0之后,曲線呈現出波浪形。導致這種波動的原因可能是因為酵母直接培養在48孔培養板中,隨著時間的延長,酵母菌液的濃度逐漸增大,酵母菌無法均勻分布在液體中,甚至出現不均一的沉淀,盡管每次用酶標儀測定之前都會盡量搖勻48孔板,但是仍然無法保證菌液的均一性,導致A600值無法精確測出。筆者也發現,在實驗進行到大約20 h的時候,48孔板中的菌液已經變得非常濃稠,孔的底部聚集大量沉淀,不得不終止實驗。而全自動生長曲線分析儀中的菌液在實驗進行到40 h之后,還比較均一,這可能與全自動生長曲線分析儀的振蕩培養方式有關。在繪制生長曲線的時候發現,全自動生長曲線分析儀整體數值要比多功能酶標儀的數值偏低,這是因為全自動生長曲線分析儀在測量A600值的時候,不能設定光程校正,無法轉化為標準的1 cm光程,因此,測出的數值要低于多功能酶標儀,但是這并不影響實驗數據的可靠性。
為了盡可能減輕多功能酶標儀的實驗誤差,建議:(1)菌液的初始濃度可以相對降低,這樣酵母菌生長的不會太快,不會在短時間內形成大量的菌液沉淀。(2)在實驗條件允許的情況下,可以采用24孔板培養菌液,因為在孔徑大的實驗條件下,菌液在用酶標儀測定之前比較容易混勻。(3)在搖勻培養板的時候,沿著“十”字的方向,水平均勻搖動,幅度要小,避免菌液濺到培養板蓋子上。(4)培養板的空白孔里要添加無菌水,保持一定濕度,避免菌液蒸發。
本實驗是結合實驗室的實際情況,找到一種簡單快捷測定微生物生長速率的方法,特別是實時監控液體培養微生物的生長速率。全自動生長曲線分析儀檢測精度更高,無需專人值守,但是由于需要專業的設備,所以更適合于研究生開展比較精密的創新性和探索性實驗項目。多功能酶標儀則適合本科生開展相對簡單的定性實驗,因為多功能酶標儀法需要每間隔2~3 h用酶標儀測量一次A值,需要耗費相對較多的人工時間,因此可以同時進行其他的實驗,讓學生在連續的數據觀察和測定中,合理安排實驗時間,打下良好的科研實驗基礎。