轉錄因子NRF3結構、功能及其表達調控的研究進展*
吳宇財, 錢金欽, 何宇輝, 李學松, 鞏艷青
[北京大學第一醫院泌尿外科,北京大學泌尿外科研究所,國家泌尿男生殖系腫瘤研究中心,泌尿生殖系疾病(男)分子診治北京市重點實驗室,北京100034]
“ 帽 領 ”(Cap'n'collar,CNC)家 族 包 括 果 蠅CNC1,線蟲Skn-1,脊椎動物核因子E2樣蛋白1(nu?clear factor E2-like protein 1,NFE2L1)/核因子E2相關因子1(nuclear factor E2-related factor 1,NRF1)、NFE2L2/NRF2和NFE2L3/NRF3,以及相似性較低的BACH1和BACH2蛋白[1]。在信號傳遞過程中,CNC因子與小Maf家族蛋白形成異源二聚體,以進一步識別并結合多種反應元件如NFE2、Maf識別元件(Maf recognition element,MARE)、抗氧化反應元件(antioxidant response element,ARE)、應激反應元件(stress response element,STRE)和親電子反應元件(electrophile response element,EpRE),進而調控靶基因的表達[2]。其中研究最為廣泛的是NRF2,其在細胞氧化應激、合成代謝以及腫瘤預防與治療等方面發揮重要作用[3-4]。NRF3作為NRF2的同源基因,其蛋白的功能和調控目前還未得到深入的闡明;明確NRF3表達的調控因子及其調控的靶基因,尋找調控其轉錄因子活性的通路分子,對于全面了解它的功能和調節機制至關重要。
1 NRF3蛋白結構和表達
脊椎動物NRF轉錄因子家族由3個密切相關的因子NRF1、NRF2和NRF3組成,三者的結構見圖1。它們在C端區域都具有CNC結構域和堿性亮氨酸拉鏈(basic leucine zipper,bZIP)結構域,中間含有1~2個調節轉錄激活的酸性區域(AD1、AD2或AD2L);NRF1和NRF3的N末端結構域(N-terminal domain,NTD)帶有跨膜區域,可以將蛋白錨定到內質網膜上,此外兩者還都包含一個富含Asn/Ser/Thr(NST)的可發生N-糖基化的結構域[5]。不同物種之間的生物信息學分析表明,NRF3結構中的NTD、CNC和bZIP等重要結構域在進化上具有高度保守性。人類NRF3基因位于染色體7p14~15,編碼的蛋白質分子量為73 kD,包含7個結構域,即NTD、PEST、TAD、Neh6L、CNC、bZIP和Neh3L,其中NTD區可進一步細分為N末端同源盒1(N-terminal homology box 1,NHB1)和NHB2,兩者對NRF3的翻譯后修飾起重要作用[1,6]。NRF3通過NHB1信號序列靶向輸送到內質網中進行糖基化修飾,NHB2可能參與控制NRF3活性以及其在內質網內的翻譯后加工過程[7]。分子生物學研究表明,NRF3有A、B、C三種形式:B形式主要存在于細胞質中,可被靶向運輸到內質網并進行N-糖基化修飾而轉化為A形式;而C形式主要存在于細胞核中,與sMaf蛋白形成異二聚體,通過與特異性DNA結合位點結合而激活靶基因的轉錄[1]。Nouhi等[8]的研究表明,C形式可能是NRF3的截短形式,因其N端缺乏NHB1結構域。
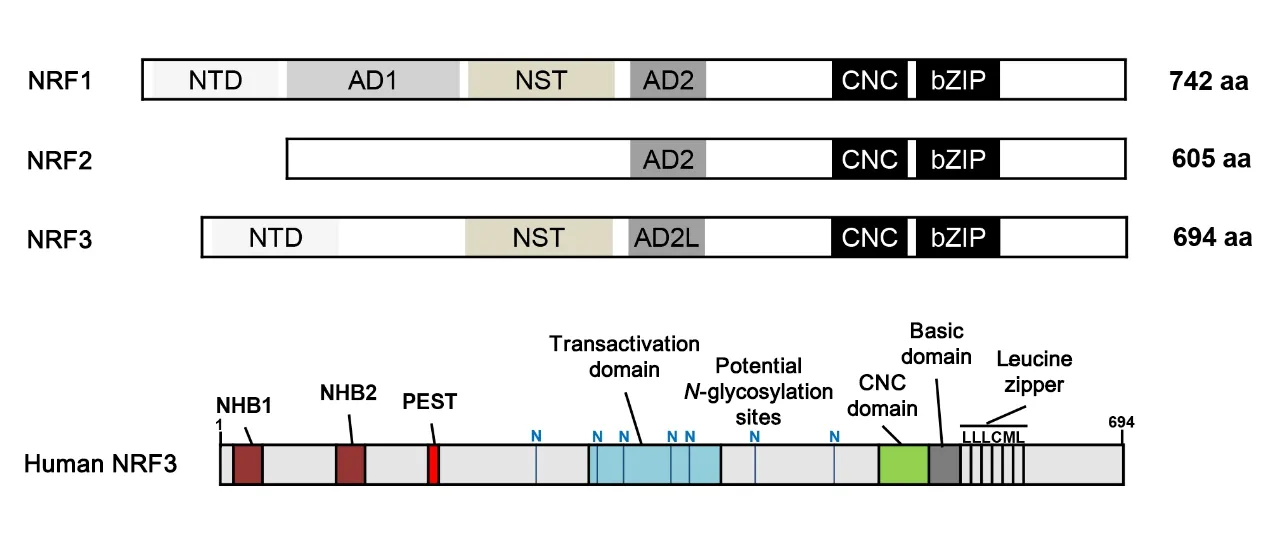
Figure 1.Schematic structures of NRF1,NRF2 and NRF3.These proteins share Cap'n'collar(CNC)and a basic leucine zipper(bZIP)domains in their C-terminus region.They contain one or two acidic domains(AD1,AD2 or AD2L)that regulate the transcriptional activation.The N-terminal domain(NTD)of NRF1 and NRF3 has a transmembrane region that can an?chor proteins to the endoplasmic reticulum membrane.In addition,both of them contain an Asn/Ser/Thr-rich(NST)do?main,which isa target for N-glycosylation.圖1 NRF1、NRF2和NRF3的結構示意圖
NRF3在組織和細胞中的表達水平已有研究。人類NRF3轉錄本從妊娠第12周至足月期間存在于胎盤絨毛中,特別是在滋養層細胞中高度表達,但在成纖維細胞中不表達。與組織中一致,NRF3轉錄本和蛋白在來源于人胎盤滋養層腫瘤的BeWo和JAR細胞系中高表達。細胞因子TNF-α能促進胎盤細胞中NRF3的mRNA和蛋白表達,提示NRF3可能參與TNF-α介導的信號通路[9]。NRF3在人其他組織中的表達程度不同,如在心臟、腦、肺、腎臟、胰腺、結腸、胸腺和脾臟有表達,而在睪丸、前列腺、骨骼肌和卵巢內幾乎不表達。
2 NRF3的表達調節機制
2.1 NRF3的翻譯后修飾 在生理條件下NRF3表達受到嚴格的調控,其在細胞內主要是通過泛素-蛋白酶體途徑降解,以維持穩定的水平,此過程可能涉及多個信號分子參與[8]。Kannan等[10]的研究首次提出含F框/WD重復域蛋白7(F-box/WD repeat-con?taining protein 7,FBW7)和糖原合成酶激酶3(glyco?gen synthase kinase 3,GSK3)共同介導NRF3的降解。FBW7基因編碼的蛋白屬于F-box蛋白家族的一員,為SCF型泛素連接酶識別目標蛋白的關鍵組分,可介導包括癌蛋白在內的許多重要蛋白質的泛素化,如cyclin E、c-Myc、Mcl-1、mTOR等,進而經26S蛋白酶體降解[10]。GSK3是一種絲氨酸蛋白激酶,可通過磷酸化FBW7的結合位點而增加FBW7與其底物之間的親和力。此外,有學者提出NRF3在細胞質和細胞核中通過不同的途徑降解[11]。生理條件下NRF3在胞質內是通過羥甲基戊二酰輔酶A還原酶降解蛋白1(3-hydroxy-3-methylglutaryl-coenzyme A reductase degra?dation protein 1,HRD1;定位于內質網膜上的泛素連接酶,介導內質網中底物的跨膜轉位[12])和含纈酪肽蛋白(valosin-containing protein,VCP;也稱為p97,是一種高度保守的ATP酶,通過水解ATP將多肽從膜上分離出來)進行降解,在細胞核中則通過含β-轉導蛋白重復域蛋白(β-transducin repeat-containing pro?tein,β-TrCP;F-box蛋白家族的成員,是SCF泛素連接酶E3的關鍵組分[13])促進其泛素化降解[11]。
2.2 NRF3的核轉位 研究表明,NRF2對于機體抵抗氧化應激具有重要作用,生理情況下細胞質中的NRF2不斷被Cul3-Keap1泛素連接酶復合體泛素化,并經蛋白酶體途徑迅速降解,氧化應激會抑制NRF2在胞質中的降解,促使未降解的NRF2轉位進入細胞核結合ARE而調控靶基因的表達[14-15]。當抑制NRF3胞質降解關鍵基因HRD1和VCP的表達時,NRF3在細胞質積聚,但細胞核內NRF3的含量卻未見增加,顯示NRF3入核與其細胞質內泛素化降解無關,其核轉位機制不同于NRF2[11]。有研究表明,天冬氨酰蛋白酶DDI2(DNA-damage inducible 1 homolog 2)的N末端含有泛素樣(ubiquitin-like,UBL)結構域,能以較弱的親和力結合泛素,已知人體內DDI2的UBL結構域參與NRF1核轉位前的加工,DDI2的表達下調抑制了NRF1的核轉位,并伴有胞質內NRF1的增加[5,16-17]。Chowdhury等[11]證實NRF3進入細胞核內的過程與此相似,DDI2識別多聚泛素化的NRF3并對其N末端NHB2結構域中的AWLVH基序進行切割,從而促進NRF3的核轉位;而對于NRF3哪些位點的泛素化介導了DDI2的識別切割,目前未有報道。
2.3 NRF3調控的靶基因 鑒定NRF3調控的靶基因有助于深入了解其在生物體內所發揮的功能。在氧化應激環境下,NRF2進入細胞核內與ARE相互作用,啟動下游編碼抗氧化蛋白和II相解毒酶的基因表達,發揮細胞保護功能[18]。盡管NRF3的生物學特征在很多方面與NRF2類似,但研究發現其調控作用與NRF2相反:體外細胞實驗的結果表明,在氧化劑叔丁基對苯二酚(tert-butylhydroquinone,t-BHQ)的誘導下,NRF3負性調控其下游基因NQO1的表達,使細胞難以抵抗氧化應激損傷[19]。此外,NRF3還可通過結合Prdx6啟動子區域內的ARE,進而實現對Prdx6基因的負性調控[20]。有學者初步分析了NRF1、NRF2和NRF3所調控基因的異同,發現了31個共同調控的基因,其中27個基因的調控機制相似;同時也發現了22個僅由NRF3調控的基因[21]。葡萄糖轉運蛋白1(glucose transporter 1,GLUT1;由SLC2A1基因編碼)受NRF3的正向調控,這可能與癌細胞的代謝重編程過程相關[22]。盡管有報道稱UHMK1(U2AF homology motif kinase 1)是NRF3的靶基因[11],但是UHMK1上不含有功能的ARE位點,故其可能是被NRF3間接調節[23]。
近來在干細胞分化研究領域發現,NRF3可通過直接結合到平滑肌細胞特異性基因啟動子區域內的CArG盒,來調節平滑肌細胞特異性基因SMαA(smooth muscleα-actin)和SM22α(smooth muscle pro?tein 22α)的表達[24]。體外實驗研究表明,NRF3還可以直接與Pla2g7(phospholipase A2group VII)基因啟動子結合,激活Pla2g7基因表達,進而促進干細胞向平滑肌細胞分化[25]。
此外,有學者認為NRF3可以負調控NRF2的表達,NRF2啟動子的近端區域有一個近似于ARE的功能序列,NRF3通過結合此序列來調控NRF2基因的表達[26-27]。目前對于NRF3調控的靶基因尚不十分明確,這也是NRF3的功能復雜、多樣,且不同于NRF2的原因之一。
3 NRF3的生物學功能
3.1 NRF3在腫瘤發生發展中的作用 人類癌癥基因組計劃已經將NRF3歸入127個顯著突變基因譜中,認為NRF3其能顯著誘導癌癥的發生[28]。基因芯片數據分析發現NRF3在霍奇金淋巴瘤和套細胞淋巴瘤等多種淋巴腫瘤中高表達[29-30]。除血液系統惡性腫瘤外,NRF3在結直腸癌、乳腺癌、甲狀腺癌、肝癌和睪丸癌等腫瘤組織中均有報道出現高表達[31-36]。NRF3的表達量可能與某些腫瘤的預后相關。Wang等[37]的一項回顧性研究表明,與癌旁組織相比,胰腺癌組織中NRF3的mRNA和蛋白表達量均顯著增加,NRF3表達量高的患者更易發生淋巴結轉移,且腫瘤TNM分期更高,預后更差;多變量分析表明NRF3和腫瘤病理分級可作為胰腺癌患者總體生存率的獨立預測因子。近來有研究顯示NRF2可通過結合ARE誘導多種抗氧化蛋白和II相解毒酶的合成,從而增強尿路上皮癌細胞對順鉑的耐藥性[38]。ARE也是NRF3的結合位點,關于NRF3是否在腫瘤患者發生化療耐藥過程中起作用目前則尚未有相關報道。
NRF3在不同腫瘤發生中的作用有所差別。例如,NRF3表達與肝癌的腫瘤分級和病理T分期呈顯著正相關,敲減NRF3可以抑制肝癌細胞的侵襲和轉移[36]。然而Chevillard等[39]的動物實驗通過管飼法讓小鼠暴露在化學致癌物苯并芘下,與野生型小鼠相比,NRF3缺失型小鼠對苯并芘更加敏感,30周后死亡率顯著增加(死亡率分別是6%和32%),組織病理學分析顯示NRF3缺失型小鼠更易患T淋巴母細胞性淋巴瘤(67%),這個結果表明NRF3能抑制某些血液系統惡性腫瘤的發生。Sun等[33]觀察到NRF3的表達在乳腺癌中被顯著抑制,并與腫瘤的轉移與分期呈現負相關;過表達NRF3能顯著抑制腫瘤惡性增殖能力并延緩上皮-間充質轉化過程。Zhou等[40]發現NRF3在結直腸癌中處于低表達狀態,且NRF3的低表達與更差的預后顯著相關;過表達NRF3后結直腸癌細胞的增殖、轉移和侵襲能力均顯著降低。因此,NRF3對腫瘤發生(促進或抑制)的作用可能與腫瘤的類型及腫瘤所處的微環境有關。
目前NRF3在腫瘤發生過程中的確切機制尚未完全闡明,此過程可能涉及多種信號通路參與。UHMK1是一種絲氨酸/蘇氨酸蛋白激酶,在有絲分裂原的激活下其表達上調并使細胞周期蛋白依賴性激酶抑制劑p27Kip1磷酸化,磷酸化的p27Kip1從核內遷移到細胞質中,使細胞周期正常進行,UHMK1活性異常增高能促進腫瘤的發展[41]。Chowdhury等[11]通過敲減NRF3后觀察到UHMK1的mRNA和蛋白表達降低,證實了NRF3通過誘導UHMK1的表達來促進結腸癌細胞增殖。此外,NRF3可降低下游抗氧化基因的表達,使細胞代謝過程產生的活性氧增加,繼而改變和破壞細胞內生物大分子結構,從而促進腫瘤發生[42]。NRF3還可以通過調節細胞內血管內皮生長因子A(vascular endothelial growth factor A,VEGFA;腫瘤血管生成的關鍵因子)的水平來促進腫瘤進展[37]。Aono等[22]則提出了β-catenin/T細胞因子(T-cell factor,TCF)-NRF3軸促進腫瘤生成,其中APC(adenomatous polyposis coli)基因缺失是重要的第一步,其缺失導致β-catenin及TCF4介導的相關基因的激活及表達,如NRF3,進而上調GLUT1基因表達水平和促進腫瘤細胞增殖。Sun等[33]探究了NRF3抗乳腺癌的潛在機制,結果表明NRF3通過抑制AKT的磷酸化繼而影響ID3(inhibitor of DNA binding 3,HLH protein)的表達,從而發揮抗癌作用。Zhou等[40]在結直腸癌中觀察到NRF3的缺失促進表皮生長因子受體(epidermal growth factor receptor,EGFR)和p38的磷酸化激活及表達增加,同時促進EGFR和p38下游分子(AKT、ATF2、CHOP等)的表達,進而增強細胞的增殖能力,促進結直腸癌發生發展。Waku等[43]觀察到腫瘤對NRF3的依賴性,并提出了NRF3-蛋白酶體成熟蛋白(proteasome maturation protein,POMP)-20S蛋白酶體軸介導的非泛素依賴蛋白質降解;NRF3通過誘導POMP分子伴侶的表達,激活非泛素依賴的20S蛋白酶體裝配,降解腫瘤抑制因子p53和Rb,從而促進腫瘤的生長及惡性進展。
3.2 NRF3抑制炎癥的發生 已有研究表明NRF3可能與炎癥發生有關。Kitaya等[44]在研究人子宮微血管內皮細胞內干擾素γ(interferon-γ,IFN-γ)調節的靶基因時發現IFN-γ處理能上調NRF3基因的表達,發揮抗炎作用;動物實驗研究也表明NRF3能抑制炎癥的發生。有研究用酚類抗氧化劑丁羥甲苯處理野生型和NRF3缺陷型小鼠,可引起小鼠廣泛肺泡損傷和血管周圍炎癥細胞浸潤,主要表現為呼吸困難和體重下降;與野生型小鼠相比,NRF3缺陷型小鼠體重下降更加顯著,且處理后的野生型小鼠肺組織中NRF3的表達量降低[45]。Braun等[46]研究了NRF2敲除小鼠的創傷修復過程,發現在創傷修復早期,參與創面愈合的各種關鍵分子的表達明顯減少,修復后期炎癥持續時間延長,然而NRF2敲除小鼠并沒有表現出明顯的組織學異常;與野生型小鼠相比,NRF2敲除小鼠在受傷前及傷后1 d的皮膚中NRF3的mRNA表達上調,其可能是NRF2無表達的代償機制,且NRF2和NRF3均可在角質細胞生長因子(ke?ratinocyte growth factor,KGF)的作用下表達上調。
3.3 NRF3促進干細胞分化 近年來的研究還發現NRF3在胚胎干細胞向平滑肌細胞分化過程中起重要作用[24]。在平滑肌細胞分化過程中NRF3的mRNA和蛋白表達上調,到分化第4天時達到高峰,在干細胞分化過程中NRF3易位到細胞核內,通過募集SRF/心肌素復合物,或直接結合平滑肌特異性基因的啟動子區域,啟動α-SMA和SM22α基因的表達[24]。此外,NRF3通過增加NADPH氧化酶4(NADPH oxidase 4,NOX4)、下調抗氧化酶的表達,使超氧化物的產生增加,促進平滑肌分化[24]。因此,NRF3是干細胞分化的重要調節器。Xiao等[25]在探索Pla2g7與干細胞分化的關系時,發現NRF3是Pla2g7的上游調控基因,NRF3被內質網應激激活后,通過轉錄激活調節Pla2g7基因表達,使Pla2g7表達上調,產生超氧化物,進而介導血清應答因子(serum response factor,SRF)與平滑肌特異性基因啟動子的結合,促進平滑肌特異性基因表達。目前,NRF3在干細胞分化中的調控機制尚未完全明確,現有的研究大多來自體外實驗,需要后續更多的體內研究進行驗證。
4 結語與展望
NRF3是一種受嚴格調控和轉錄翻譯后修飾的轉錄因子。糖基化修飾是其重要的修飾方式,但NRF3蛋白是否存在其他轉錄后修飾對其功能的調節,如磷酸化、類泛素化和棕櫚酰化修飾等尚待研究。NRF3作為干性標志基因在干細胞分化早期上調,但是其具體作用尚未明確。雖然有研究報道了NRF3可能調控的靶基因,如Prdx6、Nqo1、α-SMA、SM22α、NOX4等,但仍缺乏它們體內相關性的足夠證據。基因表達譜芯片研究顯示NRF3轉錄本在人類多種癌癥中表達上調,但僅反映了其mRNA表達水平;對這些組織中誘導表達的轉錄本是編碼有功能還是突變的轉錄因子,以及亞細胞內調控和在腫瘤發生中的具體作用機制尚未十分明確;NRF3及其相關通路將可能成為癌癥患者治療的新的潛在靶點。作為一直被忽視的CNC家族轉錄因子,NRF3的研究正逐步進入公眾視野,因此明確NRF3表達的調控因子及其調控的靶基因,以及調控其轉錄因子活性的相關通路和機制,對于全面了解其在人類生理活動或疾病中的功能和調節具有重要研究意義。

