中性粒細胞對非小細胞肺癌自噬和凋亡的影響及機制
王保明 馬冬春 閔旭紅 陳曉宇 朱學應
(安徽省胸科醫(yī)院 1胸外科,安徽 合肥 230022;2腫瘤放療科;3安徽醫(yī)科大學基礎醫(yī)學院)
中性粒細胞(PMN)是一類重要的免疫細胞。在急性炎癥反應中,PMN過趨化運動的方式被募集到感染或組織損傷部位,進而通過吞噬、脫顆粒作用殺死病原體〔1〕。此外,PMN也被發(fā)現(xiàn)存在于多種癌癥的腫瘤微環(huán)境中,被稱為腫瘤相關PMN(TANs)〔2〕,已有研究表明,TANs的在腫瘤發(fā)生中功能非常復雜,并受到多種細胞因子、信號通路的調控,在腫瘤的發(fā)展進程中,不同亞群的TANs發(fā)揮的生理功能也不盡相同,有的TANs可以通過釋放蛋白酶和細胞因子促進腫瘤的侵襲和腫瘤血管新生〔3,4〕,也有的TANs也發(fā)揮了抑制腫瘤生長的作用〔5,6〕。非小細胞肺癌(NSCLC)是最常見的肺部惡性腫瘤之一〔7〕。在NSCLC組織中,也發(fā)現(xiàn)了PMN的浸潤〔8〕。然而,PMN浸潤在PMN疾病進展中的功能及其作用機制還缺少深入的研究。PMN間接接觸共培養(yǎng)法,即使用培養(yǎng)過PMN的培養(yǎng)基繼續(xù)培養(yǎng)腫瘤細胞,能夠避免細胞直接接觸造成的干擾,是研究PMN分泌蛋白對腫瘤細胞作用的常用方法〔9,10〕。本研究采用體外分離小鼠骨髓PMN條件培養(yǎng)基與PMN細胞系A549共培養(yǎng),探究了PMN對A549細胞凋亡和自噬的調控作用。
1 材料和方法
1.1試劑和材料 主要試劑:RPMI1640培養(yǎng)基、磷酸鹽緩沖液(PBS)、胎牛血清(FBS)、Lipofectamine 3000、膜聯(lián)蛋白(Annexin)V凋亡檢測試劑盒購自美國ThermoFisher Scientific公司;人淋巴細胞分離液(Histopaque 1077/1119)購自美國Sigma公司;抗(Anti)-微管相關蛋白1輕鏈(LC)3抗體、Anti-p62抗體、Anti-蛋白激酶B(AKT)抗體、Anti-磷酸化(p)-AKT抗體購自美國Cell Signaling Tech公司;Anti-p-哺乳動物雷帕霉素靶蛋白(mTOR)抗體購自美國Abcam公司。主要材料:NSCLC細胞系購自中國科學院上海細胞庫;野生型C57BL/6小鼠購自維通利華公司。
1.2分離小鼠骨髓PMN并獲取PMN條件培養(yǎng)基 引頸處死8周齡健康小鼠,取小鼠股骨和脛骨,剝離肌肉組織后放置在PBS中。剪去股骨和脛骨兩端,用PBS沖洗骨髓細胞,得到骨髓細胞懸液。使用密度梯度離心的方法,將骨髓細胞懸液放置在Histopaque-1077/1119密度梯度分離液上,室溫1 200 r/min離心30 min,分離得到的PMN用PBS洗1次,培養(yǎng)在RPMI1640培養(yǎng)基中,培養(yǎng)24 h后,收集培養(yǎng)基,1 200 r/min 離心10 min,取上清即為PMN條件培養(yǎng)基。
1.3細胞增殖實驗 將A549細胞消化并重懸得到細胞密度為1×105個/ml的細胞懸液,取100 μl接種于96孔培養(yǎng)版中,實驗組使用PMN條件培養(yǎng)基,對照組使用正常培養(yǎng)基(90% RMPI1640+10% FBS)。在指定時間點每空加入10 μl CCK-8溶液,放置于 37℃二氧化碳培養(yǎng)箱中孵育4 h,隨后用酶標儀測度450 nm吸光值。
1.4細胞凋亡實驗 胰酶消化收集單細胞懸液,并用PBS清洗1次。加入 Annexin V 結合緩沖液重懸細胞,取100 μl細胞懸液加入5 μl Annexin V-FITC,5 μl PI 染色液混勻,室溫避光放置15 min。隨后加入400 μl Annexin V結合緩沖液,上流式細胞儀檢測。
1.5蛋白質免疫印跡實驗 胰酶消化收集單細胞懸液,離心去除上清培養(yǎng)基后,加入200 μl細胞裂解液,放置于冰上裂解20 min。加入5×十二烷基硫酸鈉(SDS)上樣緩沖液,100℃水浴加熱10 min,得到變性的蛋白質樣品。蛋白樣品經過SDS聚丙烯酰胺凝膠電泳分離,并轉移到聚偏氟乙烯(PVDF)膜上經脫脂奶粉封閉后,加入一抗稀釋液室溫孵育1 h,隨后加入辣根過氧化物酶耦聯(lián)的二抗稀釋液室溫孵育45 min,最后加入顯色底物,使用凝膠成像儀拍攝發(fā)光信號。
1.6免疫熒光實驗 貼壁培養(yǎng)的A549細胞用4%多聚甲醛室溫固定10 min,用PBS清洗1次,加入0.1 % Triton X-100孵育10 min,再次用PBS清洗1次,加入2% 牛血清白蛋白(BSA)封閉30 min。隨后用鼠源抗LC3抗體室溫孵育45 min,再用FITC耦聯(lián)的羊抗鼠IgG熒光二抗孵育30 min,用PBS清洗3次后,加入DAPI對核酸進行染色標記。最后使用正置熒光顯微鏡拍照。
1.7統(tǒng)計學分析 采用Graphpad Prism7.0軟件進行t檢驗。
2 結 果
2.1PMN條件培養(yǎng)基抑制A549細胞增殖 實驗組72 h時,A549細胞的增殖活性與對照組相比明顯降低(P<0.05)。見表1。

表1 各組A549細胞增殖活性
2.2PMN條件培養(yǎng)基促進A549細胞凋亡 與對照組〔(6.21±1.20)%〕相比,實驗組〔(10.84±2.47)%〕細胞凋亡水平顯著上升(t=2.92,P=0.043 2)。
2.3PMN條件培養(yǎng)基促進A549細胞自噬活性 對照組中,LC3主要呈彌散狀分布在細胞質中,較少呈現(xiàn)點狀定位,表明細胞自噬活性較弱,而實驗組細胞中,LC3大多出現(xiàn)點狀聚集定位,表明細胞自噬活性較高。見圖1。

圖1 免疫熒光染色法檢測LC3蛋白(×1 000)
2.4PMN條件培養(yǎng)基抑制A549細胞AKT-mTOR信號通路 見圖2、表2。與對照組相比,實驗組LC3-Ⅱ/LC3-Ⅰ的表達水平明顯上升,p-AKT的表達水平也明顯提升,p-mTOR的表達水平明顯下降(P<0.05),總AKT蛋白的表達水平沒有明顯變化。
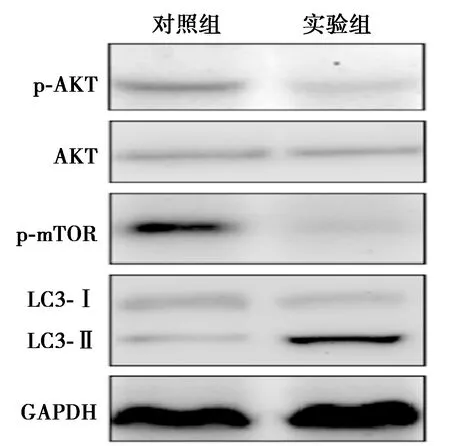
圖2 蛋白質免疫印跡實驗檢測AKT-mTOR信號通路

表2 各組蛋白相對表達水平
3 討 論
PMN在NSCLC腫瘤組織中的浸潤很早就被發(fā)現(xiàn),但其對NSCLC疾病進展的作用還不是很清楚〔8〕。韓露露等〔11〕發(fā)現(xiàn)二甲基亞砜(DMSO)誘導HL-60細胞分化成的PMN樣細胞條件培養(yǎng)基會抑制NSCLC血管新生能力,但其對細胞活性的影響還沒有深入研究。本研究結果說明PMN條件培養(yǎng)基可以抑制NSCLC細胞的增殖,促進細胞凋亡。LC3是常用的檢測細胞自噬活性的標記蛋白。在正常生理條件下,LC3定位在細胞質中,稱為胞質型LC3(LC3-Ⅰ),在細胞自噬被激活后,LC3-Ⅰ能夠結合磷脂酰乙醇胺(PE),轉變成為LC3-Ⅱ,定位在自噬小體的膜上〔12〕。因此,A549細胞中LC3呈現(xiàn)點狀定位及LC3-Ⅱ水平升高均能表明PMN條件培養(yǎng)基促進了細胞的自噬活性。
正常細胞通常會通過一定水平的自噬活性來清除蛋白和受損細胞器,維持細胞內穩(wěn)態(tài)。腫瘤細胞中常常出現(xiàn)自噬被抑制,激活腫瘤細胞的自噬活性可以促進細胞凋亡〔13〕。在KRASG120D突變引起的NSCLC模型小鼠中,如果同時缺失自噬關鍵蛋白p62,腫瘤的生長會被抑制〔14,15〕。然而,也有報道發(fā)現(xiàn)激活自噬也可以促進腫瘤的發(fā)生〔13,16〕,這表明細胞自噬可能通過不同的機制調控腫瘤的發(fā)生發(fā)展。腫瘤細胞的自噬除了被細胞內的信號轉導通路調控,同樣也受到缺氧、營養(yǎng)不足及細胞外基質等腫瘤微環(huán)境的影響。研究表明,免疫反應產生的許多細胞因子如干擾素(IFN)-γ〔17〕、腫瘤壞死因子(TNF)-α〔18〕等促進細胞的自噬活性,這些細胞因子對NSCLC細胞自噬活性的調控是通過活化核轉錄因子(NF)-κB信號通路實現(xiàn)的。此外,本研究還發(fā)現(xiàn)PMN條件培養(yǎng)基可以抑制A549細胞的AKT-mTOR信號通路。AKT-mTOR是調控細胞自噬反應的重要信號通路,AKT的活性抑制會引起mTOR活性的下降,而mTOR可以直接調控自噬相關蛋白ATG13的磷酸化水平調控細胞自噬活性〔19〕。
腫瘤部位浸潤的PMN也可以分泌多種細胞因子、活性氧和顆粒酶等,參與調控腫瘤的生長〔20〕,然而具體是哪些細胞因子或蛋白促進了NSCLC細胞的自噬和凋亡還需要進一步的研究。

