一株秸稈纖維素降解菌株的篩選及其降解特性
吳 潔,楊 梅
(吉林化工學院 生物與食品工程學院,吉林 吉林 132022)
吉林省的玉米秸稈纖維素資源非常可觀,然而很大一部分的秸稈沒有得到合理化的利用,反而被大量的棄置、焚燒.進而引發很嚴重的高消耗、高污染、低產出的狀況.如今,怎樣實現可再生植物纖維資源的高效利用與轉化,對于我國的能源、環境以及循環經濟的實現是一個重大的機遇和轉折點[1].因此將纖維素水解成葡萄糖等物質,繼而應用到食品制造、飼料加工、酒精發酵等眾多領域,使纖維素可以得到重復利用,對緩解人類能源緊缺以及環境污染等問題具有重要意義.
秸稈中的主要成分是纖維素、半纖維素和木質素,目前較為常見的纖維素降解方法為物理、化學、生物降解這3個方面.微生物降解處理纖維素是一種相對更為安全、無公害的方法,也是目前國內外的研究熱點[2].利用微生物生產纖維素酶普遍存在活力低、成本高等問題,制約著纖維素資源利用的進一步發展.因此,開發纖維素酶高產菌種并加強菌株選育等基礎研究,是纖維素資源高效利用的關鍵所在.本文從多年種植玉米地土壤中分離出1株高效纖維素降解菌,該菌命名為J-N3,并初步考察其酶學性質以及秸稈的降解效果.
1 實驗部分
1.1 試劑與儀器
1.1.1 樣品來源
土壤樣品采集:吉林市郊區多年種植玉米田地,去除表層土5 cm,取距地表5~10 cm的土壤樣品,置于無菌袋中.將樣品帶回實驗室,后過40目篩,置于4 ℃冰箱保存.
1.1.2 培養基
PDA液體(固體)培養基:馬鈴薯200 g、葡萄糖 20 g,瓊脂20 g,自來水1 000 mL,自然pH.
富集培養基:羧甲基纖維素鈉(CMC-Na)5.0 g、秸稈粉 5.0 g、K2HPO41.0 g、MgSO40.5 g、(NH4)2SO42.0 g、NaCl 0.5 g、牛肉膏0.5 g、胰蛋白胨1.0 g、蒸餾水1 000 mL,pH自然.
羧甲基纖維素鈉培養基:分別稱取羧甲基纖維素鈉15 g、NaCl 0.5 g、蛋白胨2 g、MgSO40.5 g、K2HPO41 g、酵母膏0.5 g、蒸餾水1 000 mL,pH 7.0.
赫奇遜(Hutchison)無機鹽培養基(g·L-1) :KH2PO41.0 g、NaCl 0.1 g、MgSO4·7H2O 0.3 g、NaNO32.5、FeCl30.01、CaCl20.01、瓊脂粉18 g,pH 7.2左右.
發酵培養基:KH2PO41.0 g、NaCl 0.1 g、MgSO4·7H2O 0.3 g、NaNO32.5 g、FeCl30.01 g、CaCl20.1 g、玉米秸稈粉20 g,pH 7.0.
1.1.3 主要儀器
滅菌鍋滅菌鍋(YXQ-LS上海博迅實業有限公司醫療設備廠);干燥箱(DHG-9240A上海一恒科技有限公司);無菌操作臺(JHL-1500北京萊博特瑞科技有限公司);紫外可見分光光度計(UV2600貴州賽蘭博科學儀器有限責任公司);恒溫振蕩器(HZQ-X300上海一恒科學儀器有限公司);生化培養箱LRH-70/70F上海一恒科學儀器有限公司).
1.2 方法
1.2.1 菌種的分離篩選
稱取1 g土樣置于含有100 mL富集培養基的三角瓶中,并放入玻璃珠充分打散混勻,在30 ℃、150 r/min條件下在恒溫振蕩培養箱中培養3 d,將純化后的菌株,用接種環挑取單菌落,于羧甲基纖維素(CMC)固體培養基平板上點種3個點,放入恒溫培養箱中30 ℃倒置培養3 d[3].等待菌落長出,此時用1 mg·mL-1剛果紅染液對其進行染色30 min,之后棄掉所用剛果紅染液,其次吸取1 mol·L-1NaCl溶液進行脫色30 min.稍后呈現出明顯的透明圈,測其透明圈直徑(D)與菌落直徑(d)大小,選取D/d值較大(D/d值越大,產酶能力越強)的進行復篩.
1.2.2 濾紙降解實驗
將上述實驗所得菌株,置于液體培養基中以30 ℃,150 r/min于恒溫震蕩培養箱中培養制備菌液[4].在100 mL赫奇遜無機鹽培養基中加入1 cm×6 cm的濾紙條,接入5 mL菌液之后進行恒溫震蕩,為避免震蕩導致濾紙斷裂,同時滿足該菌株生長所需的有氧條件,本實驗采用的搖床轉速為80 r/min,培養20 d,觀察濾紙條的斷裂情況判斷降解效果[5-6].
1.2.3 纖維素酶活測定
粗酶液的制備:將初篩得到的單菌株制成菌懸液,以5%的接種量接種到液體產酶培養基中,35 ℃,150 r/min搖床中培養.在8 000 r/min條件下,將培養液離心10 min,取其上清液作為粗酶液.
CMCase活力的測定[7]:取0.5 mL 稀釋的酶液和1.5 mL的1%CMC-Na溶液,放入50 ℃恒溫水浴中反應30 min,加入3.0 mL的DNS 試劑,沸水浴10 min,冷卻后定容至25.0 mL.在540 nm處測OD值,并根據葡萄糖標準曲線,求出酶解所得葡萄糖含量,換算成酶活力值.
濾紙酶活力的測定[8]:取新華濾紙50 mg放入試管中,加入 0.5 mL粗酶液和1.5 mL檸檬酸緩沖液,在 50 ℃恒溫水浴中反應30 min,加入3.0 mL DNS溶液,沸水浴10 min,冷卻后定容至25.0 mL.在540 nm處測OD值,根據葡萄糖標準曲線求出酶活力值.
1.2.4 秸稈降解率測定
接種篩選菌株到液體發酵培養基中制備菌液,按接種量5%制備好的菌液到含有秸稈的液體發酵培養基中,進行恒溫震蕩培養[9].秸稈降解過程中,于5、10、15、20 d 取各組秸稈并用自來水清洗干凈后,置于 85 ℃烘箱中烘干至恒重,用減重法測定秸稈失重率,同時,每組分別取秸稈粉(將秸稈粉碎后過40目篩)1 g,按照Van Soest 法[10]測定秸稈降解過程中纖維素分解率.
1.2.5 菌株鑒定
觀察菌落及菌體形態特征,參照《真菌鑒定手冊》[11]和《中國真菌志》[12]對菌株進行形態學鑒定.
分子生物學鑒定提取細菌基因組總DNA,擴增16S rDNA和5.8S rDNA之間的保守序列,PCR引物為27F:(AGAGTTTGATCMTGGCTCAG),1492R:(TACGGYTACCTTGTTACGACTT).PCR反應體系為 25 μL,反應條件為94 ℃ 4 min,94 ℃ 45 s,55 ℃ 45 s,72 ℃ 1 min;循環30次;72 ℃ 10 min.擴增產物測序,進行比較分析.
2 結果與討論
2.1 菌株的分離篩選
將有分解纖維素能力的菌株和篩選到菌株點接于鑒別培養基培養,經0.1%剛果紅染色和1 mol·L-1NaCl 溶液脫色后,有4個菌株形成的透明降解圈較大.隨后,對這4個菌株進行濾紙降解實驗,其結果如表1所示.最后對其進行液體發酵培養并測定其發酵上清液酶活,見表2.其中,菌株J-N3發酵上清液的羧甲基纖維素酶酶活為64.92±0.11 U·mL-1,FPA為39.75±0.10 U·mL-1,其中第3種酶活力較其他3個菌株高,故以此菌株為研究對象開展后續試驗.
表1 剛果紅染色實驗結果

表2 各菌株發酵上清液纖維素酶酶活
2.2 菌株的鑒定
菌落較大,顏色呈現灰白且略帶些黃色,其表面粗糙且無規則,并伴有隆起、皺褶等,如圖1所示.
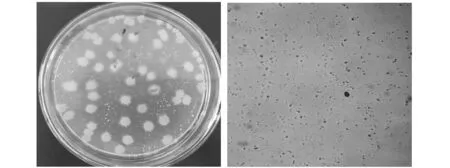
圖1 菌株J-N3菌落形態特征
僅通過對菌落的形態觀察尚不能確定菌株的具體種屬,還需通過分子生物學方法進行進一步 鑒定.提取菌株J-N3的基因組DNA進行PCR擴增并測序,測得其ITS序列長度為531bp,于NCBI 數據庫進行 BLAST 比對后發現,ITS 序列與J-N3相似性最高的菌株屬于芽孢桿菌,如表3所示.

表3 纖維素降解菌株的相似菌種及相似度

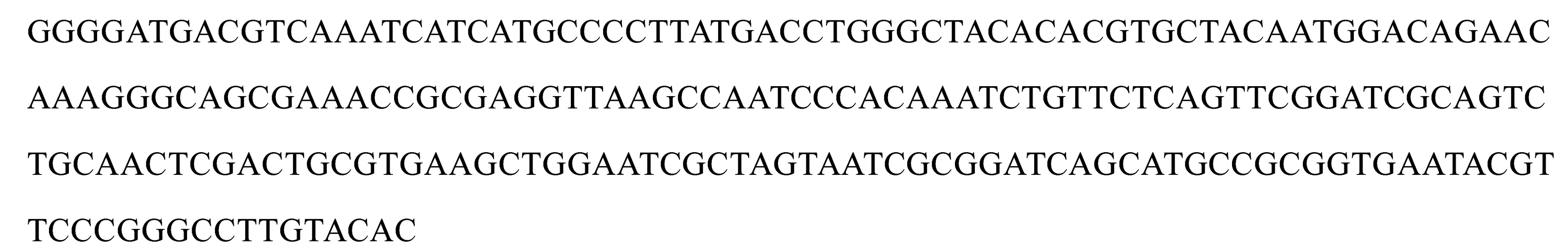
2.3 菌株J-N3所產纖維素酶的測定結果
2.3.1 培養時間對酶活力的影響
取活化后的菌種,按5%接種量于250 mL液體產酶培養基,35 ℃、150 rmp震蕩培養7 d,每培養24 h取樣1次,連續測定纖維素酶活力,如圖2研究培養時間對菌株發酵液酶活力的影響.
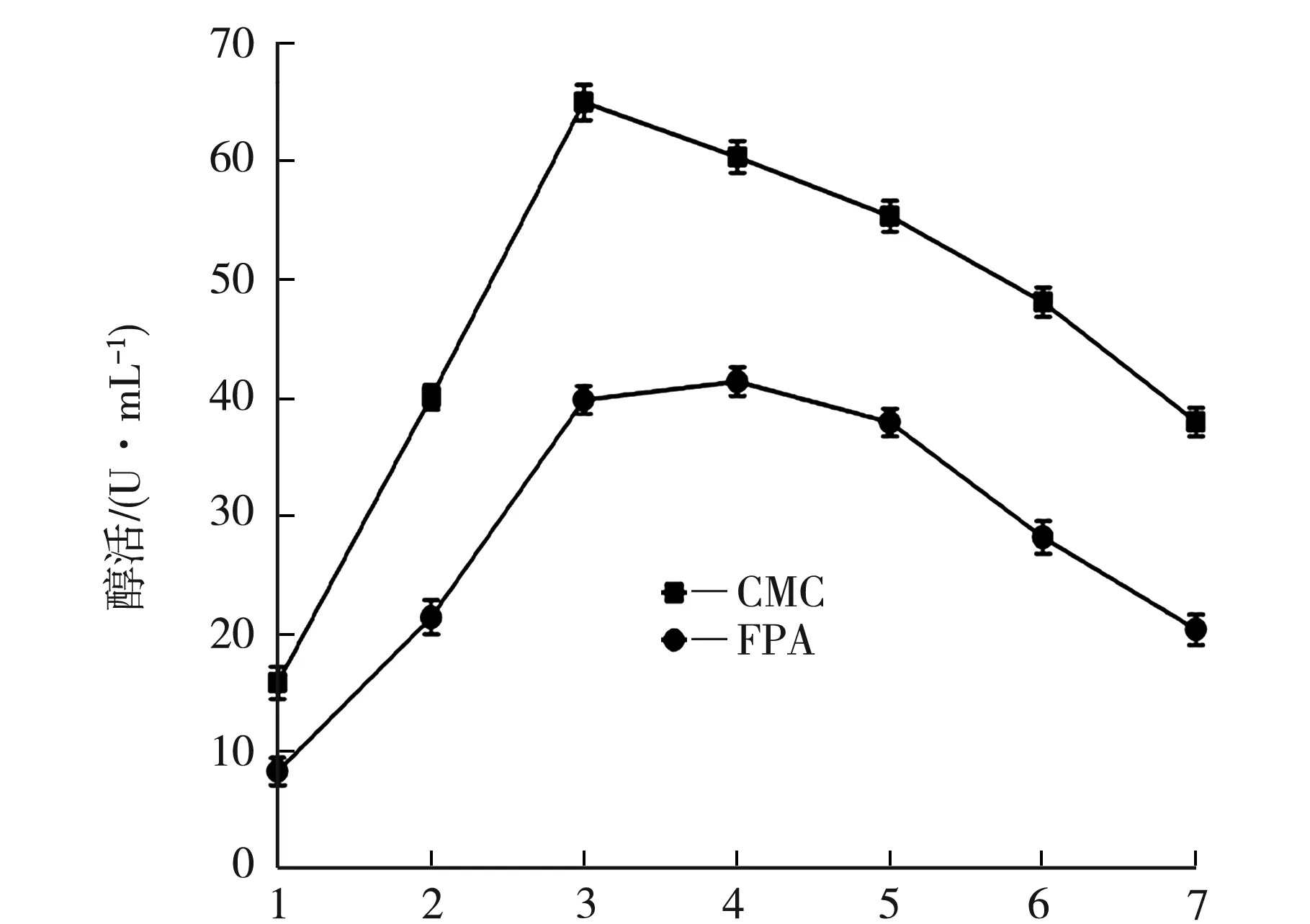
t/d圖2 時間對酶活的影響
2.3.2 酶的最適反應pH
在50 ℃條件下,分別在pH為4.0、5.0、6.0、7.0、8.0、9.0的Na2HPO4-檸檬酸緩沖溶液體系中,測定該纖維素酶活力.由圖3可知,該纖維素酶的最適反應pH為6.0.在pH 4.0~6.0之間,纖維素酶活力逐漸升高;在pH 6.0~8.0之間,纖維素酶活力有小幅降低.

pH圖3 pH對酶活的影響
2.3.3 酶的最適反應溫度
在pH 6.0體系中,分別在30、40、50、60、70、80 ℃下,測定該纖維素酶活力.由圖4可知,該酶的最適反應溫度為50 ℃;其對溫度的適應性較強,在 30~50 ℃之間,酶活力都維持在較高增長水平;當溫度高于 50 ℃ 時,纖維素酶活力迅速下降.

T/℃圖4 溫度對酶活的影響
2.4 菌株J-N3對玉米秸稈的降解效果
對同一取樣時間段的數據進行分析,20 d 時,菌株J-N3處理組秸稈失重率為26.22%,每組取秸稈粉1 g,用于測定秸稈中的纖維素含量,并計算纖維素分解率,此時菌株處理組纖維素分解率達到31.01%.綜合玉米秸稈失重率和纖維素分解率的測定結果,表明菌株對玉米秸稈具有良好的降解功能.
3 結 論
近年來對纖維素降解菌的研究越來越關注,農作物秸稈是自然界中最豐富的可再生資源,如何有效利用秸稈纖維素是普遍關注的研究熱點.本研究篩選獲得 1 株高產纖維素酶的菌株J-N3.結合形態學特征與分子生物學鑒定結果可知,菌株 J-N3為芽孢桿菌屬.并對其所產纖維素酶的酶學性質進行了初步研究,該酶在發酵第3 d時CMC酶活最高,最適反應pH為 6.0,最適反應溫度為50 ℃,并且菌株對玉米秸稈具有良好的降解功能.玉米秸稈經菌株 J-N3處理20d 時,秸稈失重率及纖維素分解率分別達到26.22%和31.01%.

