黃精多糖對脛骨骨折大鼠骨折愈合的作用機制
王一飛 薛鋒
(上海市奉賢區中心醫院骨科,上海 201400)
骨折愈合的過程是骨再生的過程,需要適合的生物力學環境,還要通過多種組織和細胞因子之間相互作用,促進骨折愈合〔1〕。研究數據顯示,我國近幾年高能量損傷和開放性損傷的患者人數增多,骨折不愈合的患者人數也有所增加〔2〕。骨折不愈合仍是治療的難題,引起專家和學者的高度重視。研究數據顯示,黃精多糖有降血脂、抗病毒、提高免疫功能、延緩衰老的功效〔3,4〕。本研究旨在探討黃精多糖對脛骨骨折模型大鼠骨折愈合的作用機制。
1 材料與方法
1.1研究對象 選擇23只SD健康雄性大鼠,由三峽大學實驗動物中心提供。大鼠年齡為6~9周齡,平均(7.5±0.5)周齡,體重為210~220 g,平均(214.4±3.5)g,飼養溫度為22~25℃,室內濕度35%~40%,飼養室定時進行紫外線照射消毒。統一喂給標準飼料,允許自由活動,飼養時間為1 w。本研究獲得醫院倫理委員會批準。
1.2方法
1.2.1脛骨骨折模型建立及分組 參考劉建軍等〔5〕建模標準,并進行適當修改,選取18只大鼠使用5%水合氯醛進行腹腔麻醉,選取大鼠右后肢進行脫毛處理,消毒,在小腿1/3處行前正中切口,長度約1.5 cm,將大鼠皮膚、皮下組織和筋膜切開后,脛前肌扒開,在脛骨結節下1.0 cm處,將脛骨橫行切斷。采用1.0 mm的克氏針經過遠端的髓腔穿出后,復位,采取逆行方式打入骨折的近端。之后使用生理鹽水清洗干凈,將切口逐層關閉。手術后對大鼠進行肌注青霉素8萬U/100 g,1次/d,連續肌注3 d。建模過程中,死亡3只,建模成功15只。將15只大鼠隨機分為模型組、低、高劑量黃精多糖組,各5只,正常組大鼠5只。黃精多糖溶入10 ml的生理鹽水中,進行灌胃治療,低劑量黃精多糖組大鼠服用劑量為100 mg/kg,高劑量黃精多糖組大鼠服用劑量為350 mg/kg,1次/d,正常組和模型組大鼠給予等體積的生理鹽水治療,連續治療30 d。
1.2.2大鼠骨痂體積和脛骨濕重 大鼠處死前采集血清,抽取股動脈血,保存在肝素鈉抗凝管中,每管2 ml,-20℃環境下保存,待測。大鼠處死后采用自制的照相模板將大鼠的下肢進行固定,正側位拍攝X射線片,曝光參數設置:電壓60 kV,電流7 mA,0.035 s,52 cm。觀察大鼠的骨痂形成情況。取大鼠全長的脛骨,在進行標本采集的過程中,保護骨折周圍組織,防止對骨痂造成破壞。將固定物去除后,使用天平稱取全長脛骨濕重。
1.2.3觀察大鼠脛骨近端骨形態 大鼠處死后采用Micro-CT骨形態計量學進行分析,將大鼠脛骨的肌肉、軟組織剔除后,使用生理鹽水將血液沖洗干凈,做好標記后凍存。使用100 g/L的多聚甲醛將大鼠脛骨固定,使用Micro-Ct掃描,分辨率為18 μm。數據參數設置電壓50 kV,電流500 μA,銅質濾片為0.5 mm進行掃描,主要檢測指標包括:骨體積分數、骨小梁數量、骨小梁厚度。
1.2.4脛骨骨折骨組織形態學觀察 所有大鼠處死后取出骨組織,在10%的甲醛固定保持48 h,脫水、浸蠟、包埋、切片、脫蠟處理后,采用蘇木素-伊紅(HE)進行染色,在顯微鏡下(×100)觀察大鼠脛骨骨折骨組織形態學特征。
1.2.5酶聯免疫吸附試驗測定篾這內皮生長因子(VEGF)、骨鈣素及血清生化指標水平 采用50 mmol/L碳酸鹽包被緩沖液將抗原進行溶解,濃度為10~20 μg/ml,在96孔酶標板中加入100 μl/孔,4℃過夜保存。第2天舍棄包被液,采用磷酸鹽吐溫緩沖液(PBST)洗滌3次,沒孔中加入1%的150 μl 牛血清白蛋白(BSA),在37℃環境中封閉1 h。之后采用PBST洗滌3次,在每孔中加入100 μl不同倍比稀釋度的血清,加入對照樣品,37℃孵育2 h。采用PBST洗滌5次,加入100 μl,稀釋后的辣根過氧化物酶(HRP)標記的二抗,37℃孵育1 h。PBST洗滌5次,之后,使用顯色劑顯色20 min后,在酶標儀上讀取A405吸收值,從而測定VEGF、骨鈣素、鈣、磷、堿性磷酸酶水平。
1.2.6Western印跡檢測Col1a1、抗酒石酸酸性磷酸酶(ACP)5、組織蛋白酶(CTS)K蛋白表達 將采集到的標本,使用PBS緩沖液清洗3遍以上,分離緩沖液,加入IP細胞裂解液,裂解處理35 min,提取總蛋白,二喹啉甲酸(BCA)測定蛋白濃度。取20 μg/孔蛋白質,進行10%的十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE),加入適量濃縮的SDS-PAGE蛋白緩沖液15 min;100 V,電泳10 min,結束之后,將電轉膜浸泡在10%的牛奶中,在37℃環境下的搖床上封閉1.5 h;與一抗結合,加入TBST稀釋按(1∶1 000)稀釋一抗Tubulin(內參照),在4℃的環境下孵育24 h;之后TBST緩沖液清洗處理,與二抗結合在室溫下孵育1 h,使用TBST緩沖液反復清洗。加入顯影劑將其浸在底物溶液中進行顯色,嚴格按照顯影定影試劑盒操作說明書進行。
1.3統計學方法 采用SPSS19.0軟件進行方差分析、獨立樣本t檢驗。
2 結 果
2.1各組術后脛骨濕重和骨痂體積比較 低、高劑量黃精多糖組術后脛骨濕重和骨痂體積均顯著高于模型組,且高劑量黃精多糖組顯著高于低劑量黃精多糖組(均P<0.05)。見圖1,表1。

圖1 各組大鼠術后脛骨濕重和骨痂體積X線比較

表1 各組大鼠脛骨濕重和骨痂體積比較
2.2各組大鼠脛骨近端骨形態比較 各組骨小梁厚度比較無顯著差異(P>0.05)。正常組、低、高劑量黃精多糖組骨體積分數、骨小梁數量均顯著高于模型組(均P<0.05);低、高劑量黃精多糖組骨體積分數、骨小梁數量均顯著低于正常組(均P<0.05);高劑量黃精多糖組骨體積分數、骨小梁數量顯著高于低劑量黃精多糖組(P<0.05)。見圖2,表2。
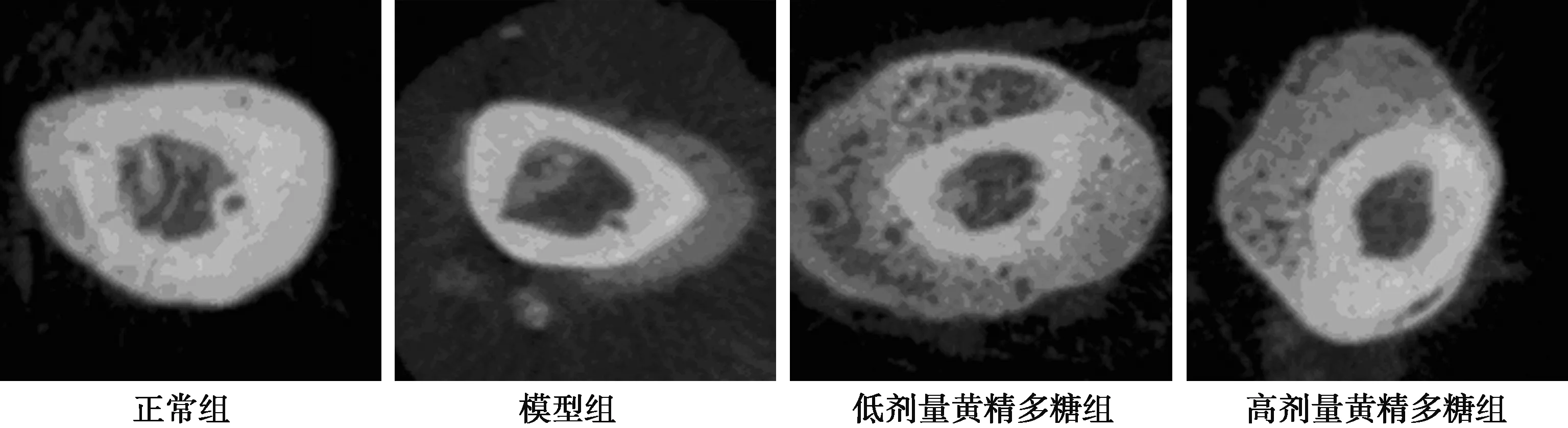
圖2 4組大鼠脛骨近端骨Micro-Ct比較
表2 各組脛骨濕重、骨痂體積及近端骨形態及VEGF、骨鈣素及血清生化指標水平比較
2.3各組大鼠脛骨骨折骨組織形態學觀察 正常組骨組織清晰,可觀察到骨板;模型組骨組織破壞嚴重,骨細胞數量顯著減少;低劑量黃精多糖組骨組織中有少量的成骨細胞聚集;高劑量黃精多糖組骨組織中有大量的成骨細胞。見圖3。
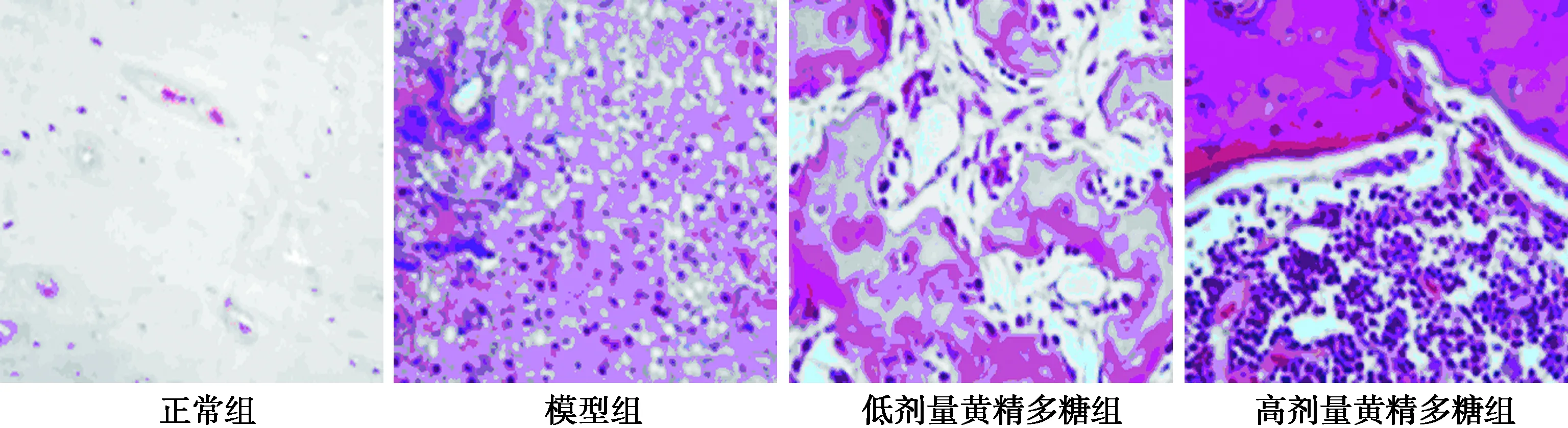
圖3 4組大鼠脛骨骨折骨組織形態學觀察(HE,×100)
2.4各組VEGF、骨鈣素及血清生化指標水平比較 正常組、低、高劑量黃精多糖組VEGF、骨鈣素、鈣、磷、堿性磷酸酶水平均顯著高于模型組(均P<0.05);低、高劑量黃精多糖組VEGF、骨鈣素、鈣、磷、堿性磷酸酶水平均顯著低于正常組大鼠(均P<0.05);高劑量黃精多糖組VEGF、骨鈣素、鈣、磷、堿性磷酸酶水平均顯著高于低劑量黃精多糖組大鼠(均P<0.05)。見表2。
2.5各組Col1a1、ACP5、CTSK蛋白表達比較 正常組、低、高劑量黃精多糖組Col1a1、ACP5、CTSK蛋白表達水平均顯著低于模型組(均P<0.05);低、高劑量黃精多糖組Col1a1、ACP5、CTSK蛋白表達水平顯著高于正常組(P<0.05);高劑量黃精多糖組Col1a1、ACP5、CTSK蛋白表達水平顯著低于低劑量黃精多糖組(P<0.05)。見表3。

表3 4組Col1a1、ACP5、CTSK蛋白表達比較
3 討 論
骨折愈合的過程包含多個階段,同時受機體中多因素調控,翁文玉等〔6〕研究指出,骨折愈合過程中有多種細胞因子參與,通過細胞外基質的重建作用,一些血清因子在骨形成的過程中發揮著重要作用。在正常的骨組織中有大量的神經分布,相關數據顯示,在骨膜和骨質中也存在大量的神經纖維〔7,8〕。在骨新陳代謝中,大量的神經肽物質參與,主要通過骨膜和骨髓血流和血管的改變,對骨細胞和破骨細胞的活性產生顯著的影響〔9〕。
本研究結果說明黃精多糖對大鼠脛骨骨折愈合有一定的積極作用。研究顯示成骨細胞影響骨形成,破骨細胞影響骨吸收,是骨重建過程中重要的細胞因子,當破骨細胞活性提高,成骨細胞的活性降低時,破骨細胞影響舊骨的吸收速度,其影響強度大于成骨細胞對新骨的影響〔10,11〕。張磊等〔12〕研究結果顯示,黃精多糖在治療絕經后骨質疏松模型大鼠中骨密度水平升高,控制了骨丟失,改善了骨微環境。
VEGF在血管生成過程中發揮著關鍵性的作用,對內皮細胞有激活作用,促進聚集,有助于細胞之間的整合和成熟〔13〕。武永娟等〔14〕研究顯示成骨細胞因子和血管細胞因子之間相互作用,在骨愈合中得到釋放,可提高骨愈合的速度。孫成群等〔15〕研究指出,經過治療后,骨痂中的血管因子顯著表達,軟骨細胞的數量增加,骨痂形成,促進鈣化,縮短了骨髓腔再通時間。本研究結果說明黃精多糖能改善骨鈣素、鈣、磷、堿性磷酸酶水平。何基琛等〔16〕研究指出,黃精多糖能抑制巨噬細胞向破骨細胞分化,但其干擾機制有待進一步的研究。ACP5屬于一種單體金屬蛋白酶,主要在哺乳動物糖基化中表達,在活化的破骨細胞中顯示高水平,是破骨細胞實現分化的重要標志性因子〔17〕。CTSK是肽酶C1家族的重要成員,集中在破骨細胞中表達,在骨吸收過程中發揮著重要作用〔18〕。破骨細胞主要是由大量的單核巨噬細胞融合形成,主要的作用是分解酸、溶酶體及分解骨基質,在機體中促進血鈣的調節〔19,20〕。本研究說明黃精多糖對骨形成相關蛋白有顯著的抑制作用,通過促進VEGF、骨鈣素水平表達抑制Col1a1、ACP5、CTSK相關蛋白的表達。其中高劑量的黃精多糖作用效果更加明顯。說明黃精多糖在成骨細胞和破骨細胞的分化過程中發揮著關鍵性的作用。
綜上,黃精多糖對脛骨骨折模型大鼠作用顯著,能改善骨微環境,黃精多糖通過促進VEGF、骨鈣素表達抑制Col1a1、ACP5、CTSK蛋白表達,促進骨折愈合。

