lncRNA和miRNA在胃癌中的研究進展
高銘 楊春宇 王彤 樸俊杰 李柏 任香善
(1延邊大學醫學院病理學教研室 腫瘤研究中心,吉林 延吉 133002;2吉林大學第一醫院肛結直腸外科)
胃癌(GC)是消化系統最常見的惡性腫瘤之一〔1〕。幽門螺桿菌感染、年齡、高鹽攝入及飲食中蔬菜水果的攝入量少是誘發GC的重要因素〔2〕。手術被認為是目前唯一的根治性治療方法〔3〕,但是由于缺乏有效的早期診斷標志物,很多患者發現時已為晚期,錯過了最佳手術時間。盡管目前新輔助化療、靶向治療及免疫治療等方法不斷發展和進步,但其治療效果及預后仍不理想〔4〕。近年來,隨著基因組學和分子生物學的發展,長鏈非編碼RNA(lncRNA)和非編碼單鏈RNA(miRNA)被發現與癌癥的發生、發展和轉移密切相關,有望成為GC診斷的重要標志物和新的治療靶點,為GC患者生存期延長及改善預后帶來了希望。本文對lncRNA和miRNA在GC診斷、治療和預后中的作用進行綜述,以期為后續研究提供參考。
1 lncRNA概述
lncRNA是一類長度超過200個核苷酸的非編碼RNA轉錄本,具有有限的蛋白質編碼功能〔5〕。按照它在基因組中的位點可分為反義lncRNA、內含子非編碼RNA、基因間lncRNA、正義lncRNA和雙向lncRNA〔6〕。它在染色質相互作用、轉錄調控、mRNA轉錄后調控和表觀遺傳調控等多種生物學過程中發揮重要作用〔7〕。lncRNA也被認為是近年來促進癌癥起始和進展的新興參與者,作為致癌或抑癌基因在腫瘤的發生發展中發揮重要作用〔8~11〕。有研究表明lncRNA的異常表達、缺失或突變與GC的發生、發展和轉移密切相關〔12〕。lncRNA可能成為GC診斷和預后的重要標志物及新的治療靶點。
2 lncRNA在GC中的作用
2.1lncRNA在GC診斷中的作用 目前臨床上常用的GC診斷標志物主要是癌胚抗原(CEA)、碳水化合物抗原(CA)19-9、CA72-4、CA125、CA24-2和CA50及胃蛋白酶原和甲胎蛋白,但是它們對GC患者的檢出率均低于20%,不足以用于GC早期診斷和患病人群篩查〔13〕。而lncRNA在多種腫瘤中異常表達且具有癌癥特異性,許多lncRNA或其經過處理的片段在體液中十分穩定,在患者的血漿和尿液中均可檢測到。它們的表達水平能顯示出疾病的嚴重程度,對GC患者的檢出率也超過60%,因此lncRNA有作為GC診斷新型生物標志物的潛能〔14〕。向萬平等〔15〕對78例老年GC患者的GC組織和癌旁組織中SLC7A11-AS1的表達水平進行檢測并對比,結果發現SLC7A11-AS1在GC組織中的表達水平(0.857±1.384)明顯低于癌旁正常組織(2.560±3.767)。而且它對GC診斷的特異性和敏感性更強,經研究發現CEA和CA 19-9對GC的檢出率分別為19.23%和15.8%,兩種聯合時的檢出率為24.35%,明顯低于lncRNA SLC7A11-AS對GC的檢出率66.67%。現有的診斷標志物主要來自血清,對胃液標志物的研究較少。而胃液是GC腫瘤微環境的重要組成部分,胃液中某些lncRNA能夠快速地診斷GC。LINC00152是GC中一種異常表達的基因間lncRNA〔16〕。它可在胃液中檢測到,能幫助區分GC患者與良性胃病患者〔17〕。Ba等〔18〕研究發現 lncRNA AC093818.1在轉移性GC組織中的表達顯著提高,ROC曲線分析結果表明它對轉移性和非轉移性GC的診斷靈敏度為78.8%,特異性為100%,因此它可用于判斷GC是否已經發生轉移,進而確定治療策略。
以上研究均證明lncRNA能夠成為無創的、特異性和靈敏度更強的GC診斷標志物。然而,要想把lncRNA用于GC的臨床診斷,還需要在提取、定量、探針富集和評價方法等方面進行深入的研究和改進〔14〕。
2.2lncRNA在GC治療中的作用 目前,手術是唯一的根治性治療方法,而對于不能手術的患者化療、靶向治療及免疫治療是常用的治療手段。但是往往因為毒副作用大、脫靶等原因其治療效果未能達到預期,因此找到新的有效的治療方法對于提高GC患者生存質量具有重要意義〔3,19〕。lncRNA中存在大量調控相互作用的位點,能為新型抗癌藥物的研發提供廣闊的平臺。MT1JP是GC組織中表達下調的一種lncRNA,與腫瘤表型和患者生存期密切相關。有研究顯示,它作為一種競爭性內源性RNA,介導miR-92a-3p對F-box與WD重復域包含(FBXW)7進行調控,進而抑制GC細胞增殖、遷移和侵襲,促進GC細胞凋亡,因此它能作為GC治療的新靶點〔20〕。此外,lncRNA還參與多種與癌癥進展相關的信號通路并在癌癥組織中特異性表達〔21〕。lncRNA MEG3通過p53信號通路抑制GC細胞的增殖和轉移〔22〕。AK023391通過激活磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶(Akt)信號通路發揮致癌作用〔23〕。AOC4P通過促分裂原活化蛋白激酶(MAPK)信號通路影響GC細胞的生物學行為〔24〕。因此,靶向lncRNA進而調控GC的發生和發展成為GC治療的新策略。由于表觀遺傳的改變,化療耐藥是目前GC治療的最大障礙。Zhu等〔25〕研究發現ARHGAP5-AS1是一種在GC化療耐藥細胞中表達上調的lncRNA,其表達下調能逆轉化療耐藥,增加藥物誘導的細胞凋亡。因此,靶向ARHGAP5-as1 /ARHGAP5軸可能成為克服GC化療耐藥的一種治療策略。綜上,lncRNA能夠成為GC治療的新靶點。但大多數lncRNA的結構和功能信息尚未確定,而且它在不同物種間的保守性較差,因此,利用體外實驗和動物模型實驗開發出的治療方法無法直接應用于人類,仍需要進行更詳細的臨床前研究。
2.3lncRNA在GC預后中的作用 GC是一種常見的預后不良的胃腸道腫瘤。傳統的預后指標如TNM分期,病理分級和Ki67指數等無法準確預測GC患者的預后。因此,仍有必要確定新的預測指標來改善預后。Zheng等〔26〕研究顯示lncRNA UCA11的高表達與GC分化程度、腫瘤大小、浸潤深度和TNM分期相關。Kaplan-Meier分析結果顯示,UCA1的高表達導致GC患者總生存期和無病生存期較差。進一步通過多因素生存分析也得出UCA1是一個獨立的預后指標。LINC01133是miR-106a-3p的競爭性內源性RNA,通過調控腺瘤性結腸息肉病(APC)表達和Wnt/β-catenin通路來抑制GC的發展和轉移。LINC01133的低表達與GC患者預后不良顯著相關,因此它能夠成為預測GC預后的lncRNA〔27〕。許多lncRNA 在腫瘤中差異表達且與腫瘤的大小、TNM分期和生存期相關,能有效的反映患者的預后情況。Miao等〔28〕通過對TCGA數據庫中379例老年GC患者差異lncRNAs表達數據進行單因素和多因素Cox比例風險回歸分析后發現了4個lncRNA (LINC01018、LOC553137、MIR4435-2HG和TTTY14)與GC患者總生存率相關,能夠作為老年GC預后監測的生物標志物(圖1)。
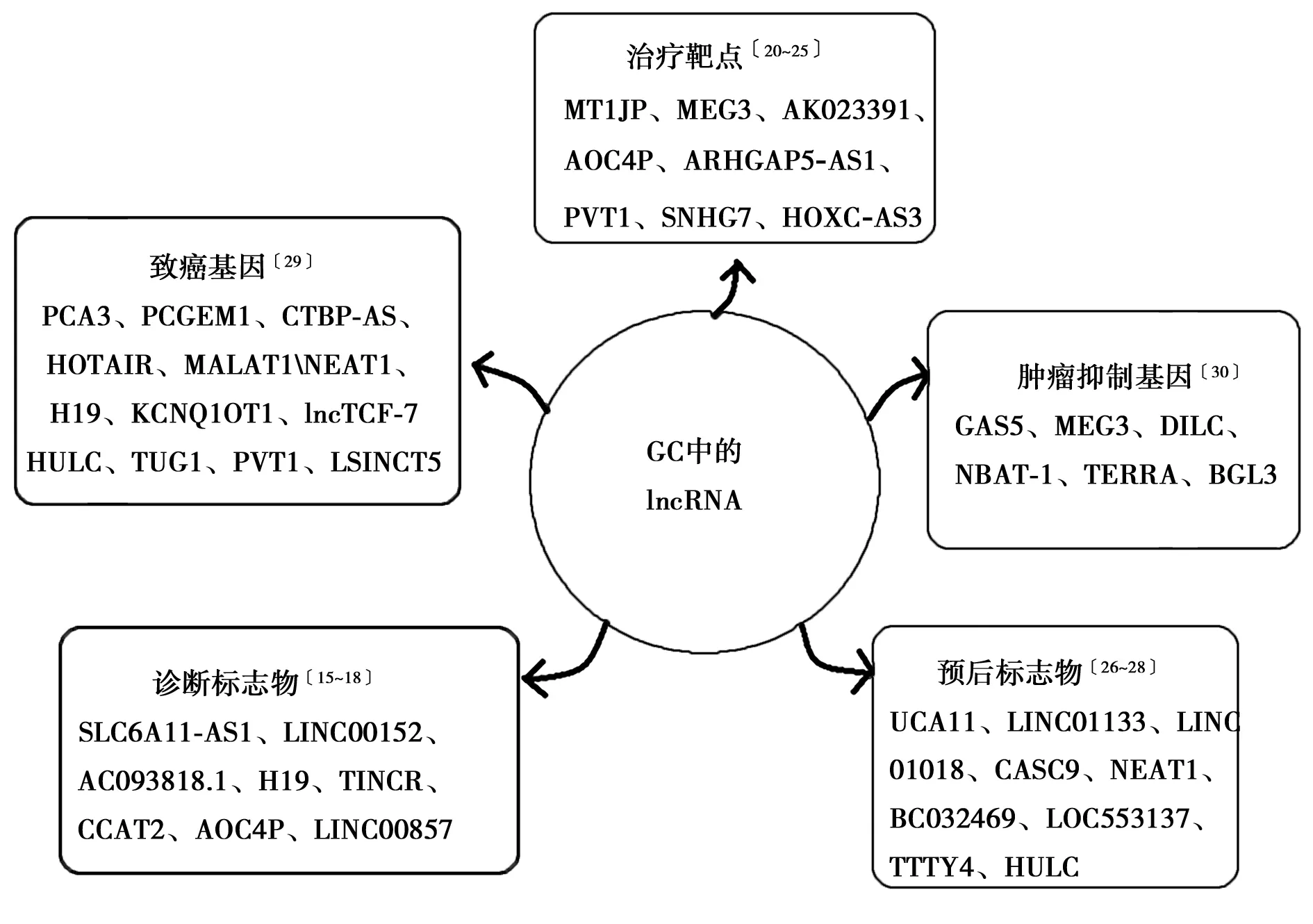
圖1 lncRNA在GC中的作用
上述研究表明lncRNA能夠成為判斷GC預后的標志物。但是,目前對于lncRNA在GC發生、發展中的功能和作用機制研究有限,而且lncRNA數量龐大,只有小部分的功能和機制被闡明。因此仍需探索更多的、準確度更高的生物標志物作為GC預后指標。
3 miRNA的概述
miRNA是一組內源性、保守的非編碼單鏈RNA分子,長度為18~22個堿基〔31〕。它是關鍵的轉錄后負調控因子,能完全或部分結合靶mRNA3′-非翻譯區的互補位點〔32〕,通過調控單個mRNA的表達或同時調控多個mRNA分子的表達,抑制mRNA的翻譯或降解mRNA,進而影響與細胞代謝相關的功能〔33〕。miRNA作為腫瘤抑制因子或致癌基因發揮作用,其表達失調能夠影響腫瘤細胞的增殖、遷移、侵襲、分化和腫瘤復發等多種功能,與腫瘤發生和癌癥進展密切相關〔34~36〕。大量研究表明〔37~41〕,它的異常表達在GC的發生和發展過程中發揮關鍵作用。miRNA參與GC細胞的增殖、分化和凋亡等多個過程,能夠成為GC早期診斷和預后監測的有效指標并被認為是很有前景的治療靶點。
4 miRNA在GC中的作用
4.1miRNA在GC診斷中的作用 miRNA性質穩定,且容易從組織、血液和腹水中獲得,具有成為GC診斷生物標志物的潛能〔42,43〕。許多miRNA的異常表達在GC的發生發展過程中具有重要作用。一項研究發現GC患者血清和外周血單核細胞中miRNA-21的水平明顯升高且陽性預測率在90%左右,而CA19-9和癌胚抗原(CEA)的陽性預測率在50%左右。此外,miR-21的水平也可用于區分I期和IV期GC〔44〕。Hung等〔45〕研究發現miR-376c在GC患者組織、血漿和尿液中表達上調且從GC早期就開始上調。而且它的高表達與GC細胞的增殖、遷移和非錨定生長相關。因此miR-376c可用于GC的早期診斷,便于盡早治療從而提高患者生存率。Li等〔46〕比較了miRNA-381與目前常用的血清腫瘤標志物CA19-9,CA72-4和CEA在GC診斷中的特異性和敏感性,結果發現在早期GC組與進展期GC組中,CA19-9的特異性和敏感性分別為60.0%和80.0%;CA72-4的特異性和敏感性分別為87.5%和65.0%;CEA的特異性和敏感性分別為77.5%和68.75%,均低于miRNA-381的特異性和敏感性97.5%和83.75%。因此,miRNA-381能夠成為高特異性和敏感性的GC診斷標志物。
臨床上常用的GC診斷方法是內窺鏡檢查和活檢,但是這種方法依賴于操作者的技能,是創傷性的,且費用昂貴,容易引起患者的不適和焦慮〔47〕。而miRNA在GC早期診斷方面具有無創性、穩定性及高特異性和敏感性等優點,有很大的應用前景,值得深入研究。
4.2miRNA在GC治療中的作用 目前,GC的治療主要是通過內鏡或者手術切除惡性組織,但是這種治療方法對患者創傷比較大,且術后容易復發或發生全身轉移。因此需要從分子角度探究GC的發生機制,進而對其進行調控以達到治療目的。有研究發現許多miRNA作為致癌基因在GC的發生發展中發揮重要作用,因此將它們作為治療靶點并抑制其表達有助于GC的治療。如miR-532是在GC組織和細胞中高表達的一種miRNA,通過激活Wnt/β-catenin通路發揮致癌作用,能成為GC治療的新靶點〔48〕。化療或放射耐藥是目前GC治療的主要挑戰,嚴重影響了治療效果及患者的預后。Zhang等〔49〕研究表明化療耐藥與miR-132在GC患者中的高表達有關。Kaplan-Meier生存曲線顯示,低miR-132表達的患者生存時間明顯延長。而進一步研究顯示,miR-132通過調控沉默信息調節因子(SIRT)1/環磷腺苷效應元件結合蛋白(CREB)/三磷酸腺苷結合轉運蛋白G超家族成員2抗體(ABCG2)信號通路促進體內外Lgr5+GC干細胞對順鉑的耐藥性,因此它能成為順鉑耐藥GC患者一種很有前景的治療方法。晚期GC患者無法通過手術切除腫瘤,且只能接受姑息性治療,但因個體差異治療效果因人而異,因此需要尋找一種精準的療效預測因子,建立針對患者的個體化治療方案對提高患者生存質量和改善預后具有重要意義。Smid等〔50〕對54例姑息性化療患者的GC組織標本進行研究后發現了6個與癌癥進展和總生存期相關的miRNA(miR-150、miR-181、miR-221、miR-224、miR-342-p和miR-520h),它們可作為GC患者姑息治療有效性的預測因子來幫助確定最合適的治療方案。
miRNA為GC的治療帶來了新希望,但是它長度較小且數量眾多,研究起來較為困難。因此要想將它作為GC治療的靶點仍需深入研究并進行臨床試驗。
4.3miRNA在GC預后中的作用 miRNA對GC患者的預后有良好的臨床評估價值,能有效地預測癌癥的進展和生存時間。腫瘤大小、TNM分期及有無淋巴結轉移被認為是目前評估癌癥預后的常用指標。有研究發現許多miRNA的異常表達與GC的分期和生存期相關,能成為GC的預后標志物。Zhou等〔51〕研究顯示,GC組織中miR-145-5p的表達水平明顯低于癌旁正常組織且它的低表達與淋巴結轉移顯著相關。miR-145-5p低表達的患者總生存時間明顯短于高表達的患者。進一步的單因素和多因素Cox分析也顯示它是GC的獨立預后指標〔51〕。與癌旁正常組織相比,GC組織中miR-92a的表達升高了81.1%且它的高表達與較短的生存期相關。單因素分析也顯示,高miR-92a表達、腫瘤分期、腫瘤狀態、淋巴結狀態和腫瘤大小是GC患者預后不良的預測因子〔52〕。Chen等〔53〕在GC患者中發現了6個與預后生存相關的miRNA,其中包括miRNA-100、miRNA-374a、miRNA-509-3、miRNA-668、miRNA-549和miRNA-653。其在GC中異常表達且能夠有效地預測GC患者的死亡風險及3年和5年總生存期,因此能夠成為判斷GC預后的生物標志物(表1)。上述研究均證明miRNA在GC的預后判斷中具有良好的應用價值,值得深入研究。
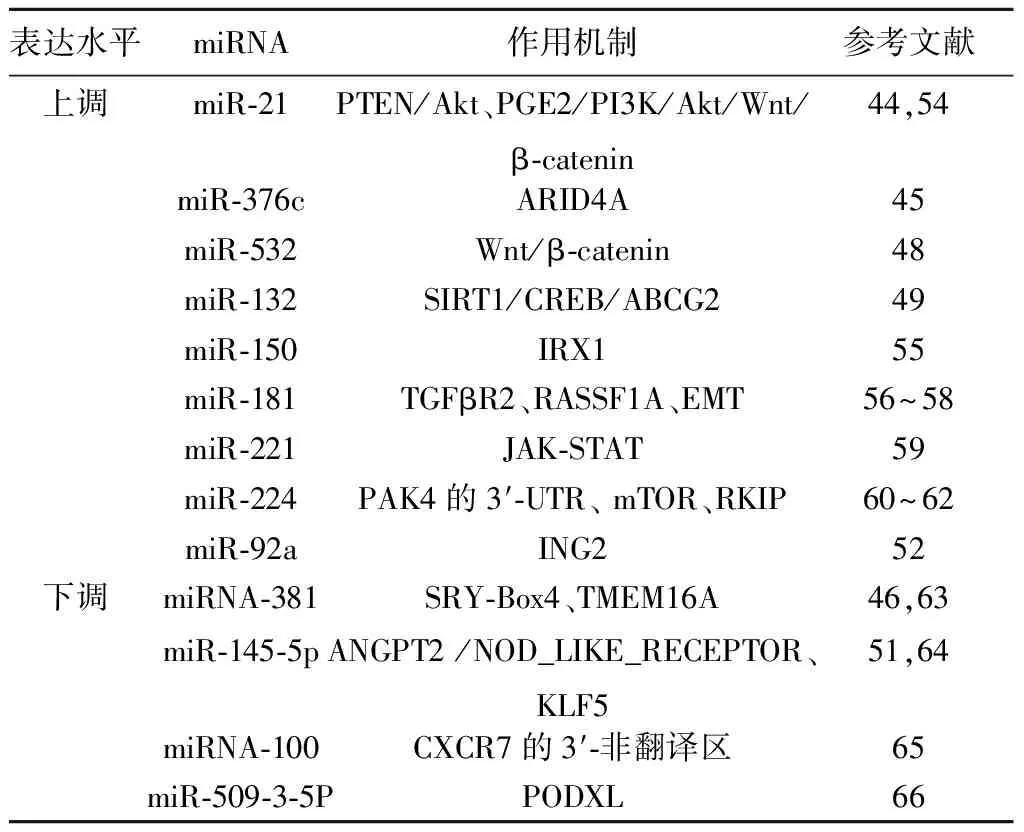
表1 miRNA在GC中的作用
綜上,GC是世界上常見且致命的惡性腫瘤之一〔67〕。該病患者預后差,可選擇的治療方法有限。目前用于胃癌診斷和預后監測的生物標志物敏感性和特異性較低〔68〕。非編碼RNAs在胃癌發生、發展和轉移過程中發揮重要作用,其中研究最多的是lncRNA和miRNA〔69〕。其在胃癌中表達異常、性質穩定、容易獲得且特異性和敏感性更高,作為新型生物標志物和治療靶點具有很強的應用前景,但其臨床應用仍面臨許多困難和挑戰,需要繼續深入研究。而且目前結構和功能明確的lncRNA和miRNA非常有限,因此仍需尋找更多在胃癌組織和細胞中異常表達的非編碼RNAs,并要探究其在胃癌中的作用及具體機制,從而幫助診斷及治療胃癌〔70〕。

