不同藥物方案治療難治性川崎病有效性和安全性的網狀Meta分析
劉瑩 張獻 趙榮生


中圖分類號 R725 文獻標志碼 A 文章編號 1001-0408(2021)16-2025-10
DOI 10.6039/j.issn.1001-0408.2021.16.18
摘 要 目的:系統評價不同藥物方案治療難治性川崎病的療效和安全性,為臨床治療提供循證參考。方法:計算機檢索 PubMed、Embase、Cochrane圖書館、中國知網、維普網、萬方數據等,收集不同藥物治療方案用于難治性川崎病的隨機對照研究(RCT)和隊列研究,檢索時限均為建庫起至2021年3月。篩選文獻,提取資料后采用改良版Jadad量表對RCT進行質量評價,采用紐卡斯爾-渥太華量表對隊列研究進行質量評價。采用Stata 16.0軟件進行網狀Meta分析。結果:共納入29篇文獻,其中15項為RCT、14項為隊列研究;共計3 112例患兒,涉及12種藥物治療方案,分別為2次靜脈注射免疫球蛋白(IVIG)、2次IVIG+激素、2次IVIG+烏司他丁、首次IVIG、首次IVIG+激素、首次IVIG+環孢素、首次IVIG+依那西普、激素、激素+烏司他丁、烏司他丁、英夫利昔單抗、安慰劑。網狀Meta分析結果顯示,在冠狀動脈損傷(CAL)發生率方面,使用2次IVIG+激素顯著低于激素,首次IVIG+依那西普顯著低于首次IVIG(P<0.05);網狀Meta排序結果顯示,CAL發生率的累積排序曲線下面積從低到高依次為激素<烏司他丁<2次IVIG<首次IVIG<首次IVIG+激素<2次IVIG+激素<英夫利昔單抗<首次IVIG+環孢素<首次IVIG+依那西普。不良反應發生率方面,與2次IVIG+激素和激素比較,2次IVIG、首次IVIG+依那西普均顯著降低,英夫利昔單抗顯著低于激素(P<0.05);網狀Meta排序結果顯示,不良反應發生率的累積排序曲線下面積由低到高依次為激素<2次IVIG+激素<首次IVIG+激素<首次IVIG+環孢素<首次IVIG<2次IVIG<首次IVIG+依那西普<英夫利昔單抗。治療后血清C反應蛋白(CRP)水平方面,與2次IVIG比較,2次IVIG+激素、2次IVIG+烏司他丁、激素均顯著降低,2次IVIG+激素顯著低于首次IVIG,2次IVIG+烏司他丁顯著低于2次IVIG+激素、激素、激素+烏司他丁、首次IVIG、首次IVIG+激素、烏司他丁(P<0.05);網狀Meta排序結果顯示,治療后血清CRP水平的累積排序曲線下面積由低到高依次為首次IVIG<首次IVIG+激素<2次IVIG<激素+烏司他丁<烏司他丁<英夫利昔單抗<激素<2次IVIG+激素<2次IVIG+烏司他丁。改善持續發熱時間方面,各治療措施兩兩比較差異均無統計學意義(P>0.05);網狀Meta排序結果顯示,持續發熱時間的累積排序曲線下面積由低到高依次為首次IVIG<安慰劑<首次IVIG+環孢素<激素<2次IVIG+激素<2次IVIG<烏司他丁<英夫利昔單抗。結論:首次IVIG聯合依那西普在降低CAL發生率方面效果較好;英夫利昔單抗的不良反應發生率相對較低、退熱效果較好;2次IVIG聯合烏司他丁的抗炎效果較好。
關鍵詞 難治性川崎病;藥物治療方案;網狀Meta分析;有效性;安全性
Network Meta-analysis of the Efficacy and Safety of Different Regimens in the Treatment of Refractory Kawasaki Disease
LIU Ying1,2,3,ZHANG Xian4,ZHAO Rongsheng1(1. Dept. of Pharmacy, Peking University Third Hospital, Beijing 100191, China; 2. Dept. of Pharmaceutical Administration and Clinical Pharmacy, School of Pharmaceutical Sciences, Peking University, Beijing 100191, China; 3. Dept. of Pharmacy, China-Japan Friendship Hospital, Beijing 100029, China; 4. Dept. of Pharmaceutical Administration, Beijing Obstetrics and Gynecology Hospital, Capital Medical University, Beijing 100026, China)
ABSTRACT? ?OBJECTIVE: To systematically evaluate the efficacy and safety of different regimens in the treatment of refractory Kawasaki disease, and to provide evidence-based reference for clinical treatment. METHODS: Retrieved from PubMed, Embase, Cochrane Library, CNKI, VIP, Wanfang database, randomized controlled trials (RCTs) and cohort studies about different therapeutic regimens in the treatment of refractory Kawasaki disease were collected during the inception to March 2021. After selecting the literature and extracting the data, the quality of RCT was evaluated by modified Jadad scale, and the quality of cohort study was evaluated by NOS scale. Network Meta-analysis was performed by using Stata 16.0 software. RESULTS: A total of 29 literatures were included, involving 15 RCTs and 14 cohort studies. A total of 3 112 patients and 12 therapeutic regimens were involved, including twice IVIG, twice IVIG+hormone, twice IVIG+ulinastatin, first IVIG, first time IVIG+hormone, first time IVIG+cyclosporine, first time IVIG+etanercept, hormone, hormone+ulinastatin, ulinastatin, infliximab and placebo. The results of network Meta-analysis showed that in terms of the incidence of coronary artery injury (CAL), twice IVIG+hormone was significant lower than hormone, and first time IVIG+etanercept was significant lower than first time IVIG (P<0.05). The sorting results of network Meta-analysis showed that area under cumulative ranking curve of CAL incidence in ascending order was hormone
KEYWORDS? ?Refractory Kawasaki disease; Drug therapeutic regimen; Network Meta-analysis; Efficacy; Safety
川崎病(Kawasaki disease,KD)也稱為黏膜皮膚淋巴結綜合征,是兒童期常見的血管炎之一。該病為自限性疾病,常伴有發熱和急性炎癥表現,其發病率與地域、種族有關,且在東亞地區兒童和世界其他地區的亞裔兒童中較高[1]。據相關數據顯示,2018年日本5歲以下兒童KD的發病率為0.359%[2]。韓國5歲以下兒童KD的發病率由2012年的0.170%上升至2014年的0.194%[3]。我國臺灣地區2010年5歲以下兒童KD的年發病率為0.082%[4]。一項基于北京市45家醫院的流行病學調查數據顯示,北京市5歲以下兒童KD的發病率從2000年的0.041%增長至2004年的0.051%[5]。
在未經治療的KD兒童中,約20%的患兒會發生冠狀動脈瘤等心血管并發癥,從而有可能引發冠狀動脈閉塞和心臟缺血等不良結局[6]。目前,國內外KD的治療均遵從美國心臟協會(AHA)和美國兒科學會(AAP)的《川崎病的診斷/治療及遠期管理的科學聲明》(以下簡稱“《科學聲明》”),該申明將阿司匹林聯合大劑量靜脈注射免疫球蛋白(IVIG)作為KD初始治療的主要方案[7]。《川崎病冠狀動脈病變的臨床處理建議(2020年修訂版)》推薦,在KD冠狀動脈損傷(CAL)的抗凝治療中,阿司匹林的劑量為3~5 mg/(kg·d)[8]。雖然,IVIG可顯著降低KD患兒嚴重后遺癥的發生風險,但仍有約10%~20%的患兒在接受阿司匹林聯合IVIG治療的36 h后出現持續或反復發熱(這稱為IVIG無反應型KD或難治性KD),因此針對這部分患兒第2次給予IVIG(2 g/kg)已成為大多數醫療機構的常規選擇方案[9-10]。但臨床實踐顯示,仍約有一半接受第2次IVIG的KD患兒發熱,使得這些患兒發生CAL的風險更高[11]。《科學聲明》推薦,難治性KD的輔助治療方案主要包括第2劑IVIG、類固醇激素、英夫利昔單抗、依那西普等[7]。本研究前期對難治性KD治療藥物進行檢索后發現,環孢素、烏司他丁、甲氨蝶呤、環磷酰胺等也在臨床中有所應用[9,12]。然而,難治性KD治療方案的循證證據較少,國內外也未有統一的標準治療方案,現有藥物治療方案的有效性和安全性不一致[13-14],且相關Meta分析多為兩種治療方案的直接比較[15-16]。網狀Meta分析結合了基于臨床研究的直接和間接證據,對干預措施優勢的評價具有較高的參考價值,可為臨床治療決策提供最優的證據[17]。基于此,本研究采用網狀Meta分析的方法對《科學聲明》中建議的以及既往報道的IVIG、類固醇激素、腫瘤壞死因子α拮抗劑(如英夫利昔單抗、依那西普)、鈣調磷酸酶抑制劑(如環孢素)、蛋白酶抑制劑(如烏司他汀)、氮芥類衍生物(如環磷酰胺)等不同藥物方案治療難治性KD的有效性和安全性進行評價,旨在為臨床實踐提供循證醫學證據。
1 資料與方法
1.1 納入標準
1.1.1 研究類型 國內外公開發表的隨機對照試驗(RCT)、隊列研究;語種限定為中文和英文。
1.1.2 研究人群 難治性KD患兒,均符合《科學聲明》中的相關診斷標準[7];年齡<18歲,性別不限。
1.1.3 干預措施 試驗組患兒接受IVIG、類固醇激素、依那西普、環孢素、英夫利昔單抗、環磷酰胺、烏司他丁、甲氨蝶呤等藥物治療,對照組患兒接受與試驗組不同的藥物治療。
1.1.4 結局指標 主要指標包括:①CAL發生率,②不良反應發生率;次要指標包括:③治療后血清C反應蛋白(CRP)水平,④持續發熱時間。
1.1.5 排除標準 ①結果未完全統計或相關資料不全的文獻;②重復發表的文獻;③研究中的干預措施為非藥物治療的文獻;④會議論文、Meta分析及綜述。
1.2 文獻檢索策略
計算機檢索PubMed 、Embase、Cochrane圖書館、中國知網、維普網、萬方數據等。中文檢索詞為“難治性”“IVIG無反應”“IVIG耐藥”“IVIG非敏感”“川崎病”“黏膜皮膚淋巴結綜合征”“類固醇激素”“靜脈注射免疫球蛋白”“依那西普”“英夫利昔單抗”“環孢素”“環磷酰胺”“烏司他丁”“甲氨蝶呤”;英文檢索詞為“resistant”“insensitive”“unresponsive”“intractable”“failure”“refractory”“intravenous immunoglobulin resistant”“mucocutaneous lymph node syndrome”“kawasaki syndrome”“glucocorticoid”“IVIG”“intravenous immunoglobulin”“etanercept”“infliximab”“cyclosporine”“cyclophosphamide”“ulinastatin”“methotrexate”;同時對納入文獻的參考文獻進行手工檢索。檢索時限均為各數據庫建庫起至2021年3月。
中文檢索式為(川崎病 OR 黏膜皮膚淋巴結綜合征)and(難治性 OR IVIG無反應 OR IVIG耐藥 OR IVIG非敏感)and(激素OR英夫利昔單抗OR靜脈注射免疫球蛋白 OR 依那西普 OR 環孢素 OR 環磷酰胺 OR 烏司他丁 OR 甲氨蝶呤 OR IVIG)。 英文檢索式為(((((Mucocutaneous lymph node syndrome[Mesh])OR(Kawasaki syndrome))OR(Lymph node syndrome,Mucocutaneous))OR(Kawasaki disease))AND((((((((Refractory[Title/Abstract])OR(IVIG non-responsive[Title/Abs- tract]))OR(IVIG resistant[Title/Abstract]))OR(IVIG non-sensitive[Title/Abstract]))OR(Intravenous immunoglobulin resistan[Title/Abstract]))OR(Unresponsive[Title/Abstract]))OR(Intractable[Title/Abstract]))OR(Fai- lure[Title/Abstract])))AND(((((((((Glucocorticoid[Title/Abstract])OR(Infliximab[Title/Abstract]))OR(IVIG
[Title/Abstract]))OR(Intravenous immunoglobulin[Title/Abstract]))OR(Etanercept[Title/Abstract]))OR(Cyclosporine[Title/Abstract]))OR(Cyclophosphamide[Title/Abs- tract]))OR(Ulinastatin[Title/Abstract]))OR(Methotrexate[Title/Abstract]))。
1.3 文獻篩選與資料提取
由2名研究者根據納入與排除標準獨立篩選文獻并交叉核對;如遇分歧,則由第3名研究者(導師)評價后再通過討論統一。提取資料包括第一作者、發表年份、國家、研究類型、患者性別、年齡、例數、干預措施、結局指標等。
1.4 納入研究的質量評價
采用改良版Jadad量表對RCT進行質量評價,評價內容包括隨機序列的產生、隨機化隱藏、盲法及退出與失訪,總分為7分,其中0~3分為低質量、4~7分為高質量[18-19]。采用紐卡斯爾-渥太華量表(NOS)對隊列研究進行質量評價,評價內容包括暴露隊列的代表性、非暴露隊列的選擇、暴露因素的確定方法、確定研究起始時尚無要觀察的結局指標、設計和統計分析時考慮暴露組和未暴露組的可比性、研究對于結果的評價是否充分、結果發生后隨訪時間是否足夠長以及暴露組和非暴露組的隨訪是否完整,總分為9分,其中0~4分為低質量、5~9分為高質量[20]。
1.5 統計學方法
采用Stata 16.0統計軟件繪制網狀關系圖,以呈現不同干預措施間存在的直接比較與間接比較關系。計數資料采用相對危險度(RR)及其95%置信區間(CI)表示,計量資料采用加權均數標準差(WMD)及其95%CI表示。采用Stata 16.0統計軟件進行環不一致性檢驗,計算直接證據與間接證據的絕對差異,當不一致性因子(IF)接近0或95%CI的下限包括0或接近0時,表明直接證據和間接證據一致,采用固定效應模型進行分析;否則認為該閉環存在明顯不一致性,采用隨機效應模型進行分析[21]。采用等級概率排序圖對不同藥物治療方案進行排序,累積排序曲線下面積越大,即等級概率越高、治療方案干預效果越好[21]。采用倒漏斗圖評價干預措施是否存在小樣本效應或發表偏倚。檢驗水準α=0.05。
2 結果
2.1 文獻篩選流程與納入研究基本信息
初檢共得到相關文獻1 001篇,通過閱讀標題、摘要及全文后,最終納入文獻29篇[22-50],其中15篇為RCT[24,27-29,32,34-37,40-42,44,48,50]、14篇為隊列研究[22-23,25-26,30-31,33,38-39,43,45-47,49];共計3 112例患兒,涉及12種藥物治療方案,分別為2次IVIG、2次IVIG+激素、2次IVIG+烏司他丁、首次IVIG、首次IVIG+激素、首次IVIG+環孢素、首次IVIG+依那西普、激素、激素+烏司他丁、烏司他丁、英夫利昔單抗、安慰劑。文獻篩選流程見圖1,納入研究的基本信息見表1(因本研究為不同藥物治療方案的交叉比較,故未固定試驗組與對照組,表1數據未分組展示)。
2.2 納入研究質量評價結果
15項RCT中,有2項研究評分為3分,為低質量文獻[28,35];14項隊列研究中,有2項研究評分為4分,為低質量文獻[23,25];其余文獻均為高質量文獻[22,24,26-27,29-34,36-50]。
2.3 網狀Meta分析結果
2.3.1 環不一致性分析 分別對4個結局指標進行環不一致性分析。結果顯示,4個結局指標均涉及2個閉合環,IF接近0或95%CI的下限包括0或接近0,提示環存在不一致性的可能性較小,詳見表2。
2.3.2 CAL發生率 22項研究報道了CAL發生率[23-28,30-33,35-36,38,40,42-49],共涉及9種干預措施,分別為首次IVIG+依那西普、首次IVIG+激素、首次IVIG+環孢素、首次IVIG、激素、2次IVIG+激素、2次IVIG、英夫利昔單抗、烏司他丁,其證據關系圖見圖2。圖中,各頂點分別表示不同的干預措施,頂點大小與納入研究的樣本量對應,直線表示2種干預措施間存在的直接或間接比較,線條粗細與相關研究的數量呈正比;不同干預措施間均存在直接或間接比較的證據,具備進行網狀Meta分析的基本條件(下同)[21]。
環不一致性分析結果顯示,直接比較和間接比較的結果一致,差異無統計學意義(P>0.05),采用固定效應模型進行分析。網狀Meta分析結果顯示,使用2次IVIG+激素者治療后的CAL發生率顯著低于使用激素者[RR=0.58,95%CI(0.37,0.93),P<0.05],使用首次IVIG+依那西普者治療后的CAL發生率顯著低于使用首次IVIG者[RR=3.88,95%CI(1.25,12.05),P<0.05];其余各組兩兩比較差異均無統計學意義(P>0.05),詳見表3。
網狀Meta排序結果顯示,CAL發生率的累積排序曲線下面積從低到高依次為激素<烏司他丁<2次IVIG<首次IVIG<首次IVIG+激素<2次IVIG+激素<英夫利昔單抗<首次IVIG+環孢素<首次IVIG+依那西普,提示首次IVIG聯合依那西普在降低CAL發生率方面效果較好,詳見表4。
2.3.3 不良反應發生率 11項研究報道了不良反應發生率[23-24,28,38-43,48,50],共涉及8種干預措施,分別為首次IVIG+依那西普、首次IVIG+激素、首次IVIG+環孢素、首次IVIG、激素、2次IVIG+激素、2次IVIG、英夫利昔單抗,其證據關系圖見圖3。
環不一致性分析結果顯示,直接比較和間接比較的結果一致,差異無統計學意義(P>0.05),采用固定效應模型進行分析。網狀Meta分析結果顯示,使用2次IVIG者的不良反應發生率顯著低于使用2次IVIG+激素者[RR=0.17,95%CI(0.03,0.78),P<0.05]和使用激素者[RR=0.06,95%CI(0.01,0.47),P<0.05],使用首次IVIG+依那西普者的不良反應發生率顯著低于使用2次IVIG+激素者[RR=6.53,95%CI(1.06,40.41),P<0.05]和使用激素者[RR=16.92,95%CI(1.08,264.43),P<0.05],使用英夫利昔單抗者的不良反應發生率顯著低于使用激素者[RR=16.64,95%CI(2.24,123.36),P<0.05];其余各組兩兩比較差異均無統計學意義(P>0.05),詳見表5。
網狀Meta排序結果顯示,不良反應發生率的累積排序曲線下面積由低到高依次為激素<2次IVIG+激素<首次IVIG+激素<首次IVIG+環孢素<首次IVIG<2次IVIG<首次IVIG+依那西普<英夫利昔單抗,提示英夫利昔單抗的不良反應發生率相對較低,詳見表4。
2.3.4 治療后血清CRP水平 16項研究報道了治療后血清CRP水平[22-24,28-29,32-36,39,41,43-45,47],共涉及9種干預措施,分別為首次IVIG+激素、首次IVIG、激素+烏司他丁、激素、2次IVIG+烏司他丁、2次IVIG+激素、2次IVIG、英夫利昔單抗、烏司他丁,其證據關系圖見圖4。
環不一致性分析結果顯示,直接比較和間接比較的結果一致,差異無統計學意義(P>0.05),采用固定效應模型進行分析。網狀Meta分析結果顯示,與使用2次IVIG者比較,使用2次IVIG+激素者[WMD=1.81,95%CI(1.02,2.59),P<0.05]、2次IVIG+烏司他丁者[WMD= 4.07,95%CI(1.99,6.16),P<0.05]、激素者[WMD=1.14,95%CI(0.34,1.95),P<0.05]治療后的血清CRP水平均顯著降低;使用2次IVIG+烏司他丁者治療后的血清CRP水平顯著低于使用2次IVIG+激素者[WMD=2.27,95%CI(0.15,4.39),P<0.05],使用2次IVIG+激素者治療后的血清CRP水平顯著低于使用首次IVIG者[WMD=-2.27,95%CI(-4.24,-0.29),P<0.05];使用激素者[WMD=-2.93,95%CI(-4.85,-1.01),P<0.05]、激素+烏司他丁者[WMD=-4.07,95%CI(-6.87, -1.27),P<0.05]、首次IVIG者[WMD=-4.53,95%CI(-7.43,-1.64),P<0.05]、首次IVIG+激素者[WMD=-4.48,95%CI(-7.91,-1.04),P<0.05]、烏司他丁者[WMD=-3.53,95%CI(-6.09,-0.98),P<0.05]治療后的血清CRP水平均顯著高于使用2次IVIG+烏司他丁者;其余各組兩兩比較差異均無統計學意義(P>0.05),詳見表6。
網狀Meta排序結果顯示,治療后血清CRP水平的累積排序曲線下面積由低到高依次為首次IVIG<首次IVIG+激素<2次IVIG<激素+烏司他丁<烏司他丁<英夫利昔單抗<激素<2次IVIG+激素<2次IVIG+烏司他丁,提示2次IVIG聯合烏司他丁的抗炎效果較好,詳見表4。
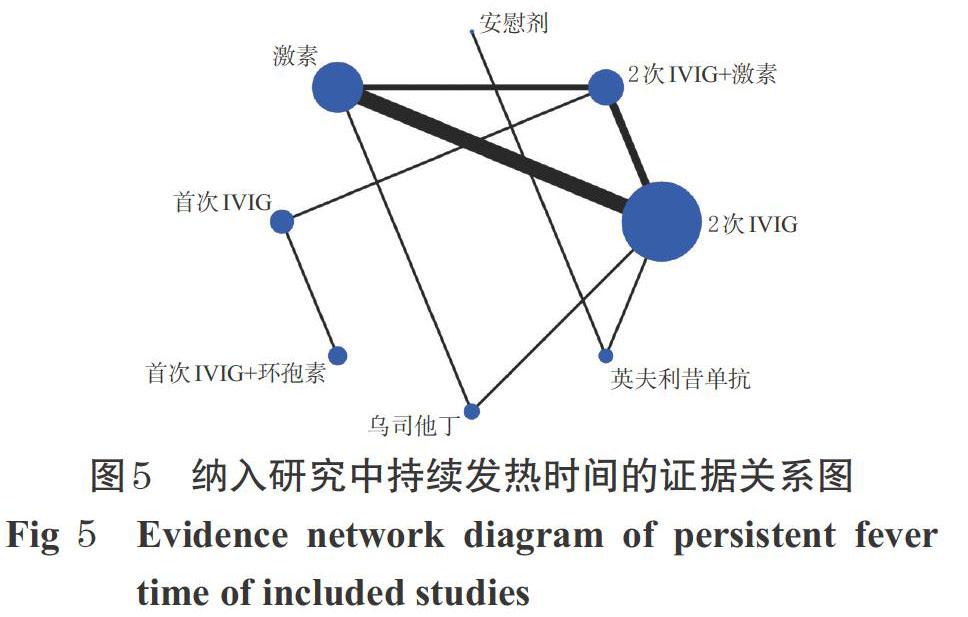
2.3.5 持續發熱時間 12項研究報道了持續發熱時間[23,32,35-39,41,44,46-48],共涉及8種干預措施,分別為首次IVIG+環孢素、首次IVIG、激素、安慰劑、2次IVIG+激素、2次IVIG、英夫利昔單抗、烏司他丁,其證據關系圖見圖5。
環不一致性分析結果顯示,直接比較和間接比較的結果一致,差異無統計學意義(P>0.05),采用固定效應模型進行分析。網狀Meta分析結果顯示,各治療措施兩兩比較差異均無統計學意義(P>0.05),詳見表7。
網狀Meta排序結果顯示,持續發熱時間的累積排序曲線下面積由低到高依次為首次IVIG<安慰劑<首次IVIG+環孢素<激素<2次IVIG+激素<2次IVIG<烏司他丁<英夫利昔單抗,提示英夫利昔單抗的退熱效果較好,詳見表4。
2.3.6 發表偏倚分析和小樣本效應評估 分別以CAL發生率、不良反應發生率、治療后血清CRP水平和持續發熱時間為指標繪制倒漏斗圖。結果,在CAL發生率、治療后血清CRP水平、持續發熱時間的倒漏斗圖中,大部分研究散點位于倒漏斗圖上方且呈偏向分布,提示上述結果存在一定的發表偏倚;同時,有部分散點位于倒漏斗圖的底部,表明上述結果可能受小樣本效應的影響[21]。在不良反應發生率的倒漏斗圖中,各研究散點分布于倒漏斗圖兩側且較為對稱,提示該結果存在發表偏倚的可能性較小;同時,有部分散點位于倒漏斗圖的底部,表明該結果可能受小樣本效應的影響,詳見圖6。
3 討論
難治性KD患兒出現冠狀動脈瘤、心肌缺血、心肌梗死甚至猝死的風險比IVIG敏感性患兒更高,因此臨床更應關注其藥物治療[51]。難治性KD的治療藥物包括IVIG、類固醇激素、英夫利昔單抗、環孢素和烏司他丁等,這些藥物的主要藥理作用機制為抑制細胞免疫作用及改善炎癥反應[52-54]。由于難治性KD治療方案較少,且發病率相對較低,故缺少大樣本的RCT,相關研究多為觀察性研究和病例報告,因此在缺乏足夠數據進行不同治療方案直接比較的情況下,相關治療方案的間接比較對臨床藥物治療方案的選擇具有重要參考意義。
本研究共納入15項RCT、14項隊列研究,均為IVIG無反應或預測為無反應的難治性KD。本研究結果顯示,在降低CAL發生率方面,作用由強到弱依次為首次IVIG+依那西普>首次IVIG+環孢素>英夫利昔單抗>2次IVIG+激素>首次IVIG+激素>首次IVIG>2次IVIG>烏司他丁>激素,提示首次IVIG聯合依那西普在降低CAL發生率方面療效顯著,但本研究僅納入了1篇依那西普的研究且樣本量較小[40],故最終結論應以RR及其95%CI為準[55]。在降低不良反應發生率方面,發生率由低到高依次為英夫利昔單抗<首次IVIG+依那西普<2次IVIG<首次IVIG<首次IVIG+環孢素<首次IVIG+激素<2次IVIG+激素<激素,提示英夫利昔單抗的安全性較好,而3種含激素治療方案(激素、2次IVIG+激素、首次IVIG+激素)的不良反應發生率相對較高,這可能與激素為經典抗炎藥物,用于難治性KD治療的研究相對較多,并報告了相關不良反應,而其他治療方案的研究相對較少,存在報告偏倚有關。在降低治療后血清CRP水平方面,作用由強到弱依次為2次IVIG+烏司他丁>2次IVIG+激素>激素>英夫利昔單抗>烏司他丁>激素+烏司他丁>2次IVIG>首次IVIG+激素>首次IVIG,提示2次IVIG聯合烏司他丁的抗炎效果較好。在改善持續發熱時間方面,發熱時間由短到長依次為英夫利昔單抗<烏司他丁<2次IVIG<2次IVIG+激素<激素<首次IVIG+環孢素<安慰劑<首次IVIG,提示英夫利昔單抗的退熱效果相對較好,這與相關研究結果一致[56-57]。
發表偏倚分析和小樣本效應評估結果顯示,本研究存在一定的發表偏倚,且可能受小樣本效應的影響。
本研究首次采用網狀Meta分析的方法比較了不同治療方案用于難治性KD的療效和安全性,為難治性KD患兒的治療藥物選擇提供了證據支持。本研究的局限性為:(1)部分研究未報告隨機化、盲法和分配隱藏,可能會降低研究結果的有效性;(2)納入的RCT及樣本量較小,可能對研究結果帶來一定的不確定性;(3)藥物治療方案多樣,部分干預措施缺乏直接比較。因此,本文結論有待更多大樣本的RCT進一步驗證。
參考文獻
[ 1 ] UEHARA R,BELAY E D. Epidemiology of Kawasaki di- sease in Asia,Europe,and the United States[J]. J Epidemiol,2012,22(2):79-85.
[ 2 ] AEE R,MAKINO N,KOSAMI K,et al. Epidemiology,treatments,and cardiac complications in patients with Kawasaki disease:the nationwide survey in Japan,2017- 2018[J]. J Pediatr,2020,225:23-29.
[ 3 ] KIM G B,PARK S,EUN L Y,et al. Epidemiology and clinical features of Kawasaki disease in South Korea,2012-2014[J]. Pediatr Infect Dis J,2017,36(5):482-485.
[ 4 ] LIN M C,LAI M S,JAN S L,et al. Epidemiologic features of Kawasaki disease in acute stages in Taiwan,1997-2010:effect of different case definitions in claims data analysis[J]. J Chin Med Assoc,2015,78(2):121-126.
[ 5 ] DU Z D,ZHAO D,DU J,et al. Epidemiologic study on Kawasaki disease in Beijing from 2000 through 2004[J]. Pediatr Infect Dis J,2007,26(5):449-451.
[ 6 ] CURTIS N,LEVIN M. Kawasaki disease thirty years on[J]. Curr Opin Pediatr,1998,10(1):24-33.
[ 7 ] MCCRINDLE B W,ROWLEY A H,NEWBURGER J W,et al. Diagnosis,treatment,and long-term management of Kawasaki disease:a scientific statement for health professionals from the American Heart Association[J]. Circulation,2017,135(17):e927-e999.
[ 8 ] 中華醫學會兒科學分會心血管學組,中華兒科雜志編輯委員會.川崎病冠狀動脈病變的臨床處理建議:2020年修訂版[J]. 中華兒科雜志,2020,58(9):718-724.
[ 9 ] PHUONG L K,CURTIS N,GOWDIE P,et al. Treatment options for resistant Kawasaki disease[J]. Paediatr Drugs,2018,20(1):59-80.
[10] NEWBURGER J W,TAKAHASHI M,GERBER M A,? et al. Diagnosis,treatment,and long-term management of Kawasaki disease: a statement for health professionals from the committee on Rheumatic Fever,Endocarditis and Kawasaki Disease,Council on Cardiovascular Di- sease in the Young,American Heart Association[J]. Circulation,2004,114(6):1708-1733.
[11] YOSHIDA M,OANA S,MASUDA H,et al. Recurrence of fever after initial intravenous immunoglobulin treatment in children with Kawasaki disease[J]. Clin Pediatr(Phila),2018,57(2):189-192.
[12] CAMPBELL A J,BURNS J C. Adjunctive therapies for Kawasaki disease[J]. J Infect,2016,72(Suppl):S1-S5.
[13] PATEL R M,SHULMAN S T. Kawasaki disease:a comprehensive review of treatment options[J]. J Clin Pharm Ther,2015,40(6):620-625.
[14] SANEEYMEHRI S,BAKER K,SO T Y. Overview of pharmacological treatment options for pediatric patients with refractory Kawasaki disease[J]. J Pediatr Pharmacol Ther,2015,20(3):163-177.
[15] 張敏.丙種球蛋白無反應型川崎病繼續治療的Meta分析[D].武漢:華中科技大學,2013.
[16] 萬宏,李雪迎,杜軍保.靜脈注射丙種球蛋白無反應型川崎病藥物治療Meta分析[J].中國實用兒科雜志,2010(7):551-556.
[17] 李倫,田金徽,姚亮,等.網狀Meta分析的統計學基礎、假設和證據質量評估[J].循證醫學,2015,15(3):180-183.
[18] BA?ARES R,ALBILLOS A,RINC?N D,et al. Endoscopic treatment versus endoscopic plus pharmacologic treatment for acute variceal bleeding:a meta-analysis[J]. Hepatology,2002,35(3):609-615.
[19] JADAD A R,MOORE R A,CARROLL D,et al. Asses- sing the quality of reports of randomized clinical trials:is blinding necessary?[J]. Control Clin Trials,1996,17(1):1-12.
[20] STANG A. Critical evaluation of the newcastle-ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses[J]. Eur J Epidemiol,2010,25(9):603-605.
[21] 汪徐林,秦正積,陸益花,等. Stata軟件在網狀Meta分析中的應用[J].現代預防醫學,2016,43(19):3461-3464.
[22] 趙冬梅,尹千里,季雪紅,等.腎上腺糖皮質激素聯合烏司他丁治療兒童川崎病的非隨機對照臨床研究[J].中國當代兒科雜志,2015,17(8):780-785.
[23] 楊瑩,張靜.激素與靜脈丙種球蛋白及其聯合應用治療靜脈丙種球蛋白無反應川崎病的回顧性對照研究[J].中國循證兒科雜志,2016,11(4):265-269.
[24] 楊珊,賈文.甲基潑尼松龍治療靜脈丙種球蛋白無反應型川崎病的療效觀察[J].臨床合理用藥雜志,2017,10(2):21-22.
[25] 翁海美,項如蓮,張園海,等.丙種球蛋白無反應型川崎病治療及隨訪分析[J].臨床兒科雜志,2011,29(3):269- 272.
[26] 劉凡,丁艷,尹薇.對靜脈注射丙種球蛋白無反應型川崎病臨床分析[J].實用兒科臨床雜志,2012,27(21):1670- 1671.
[27] 李秀云,黃從付,羅建軍.丙種球蛋白無反應性川崎病的藥物治療情況分析[J].中國醫藥科學,2017,7(21):242-244.
[28] 李丹,馮媛,耿玲玲,等.小劑量甲基潑尼松龍聯合靜脈丙種球蛋白治療靜脈丙種球蛋白無反應型川崎病的療效分析[J].中國全科醫學,2019,22(4):442-446.
[29] 李博,郝京霞,王華,等.甲潑尼龍聯合烏司他丁治療靜脈注射丙種球蛋白無反應型小兒川崎病的臨床療效觀察[J].實用心腦肺血管病雜志,2019,27(3):79-82.
[30] 寇志軍.丙種球蛋白無反應性川崎病藥物治療臨床分析[J].中國現代醫生,2016,54(23):50-52.
[31] 姜凱,馬占敏,王運玉.丙種球蛋白無反應型川崎病再治療的臨床分析[J].醫藥論壇雜志,2015,36(11):38-39.
[32] 華曉星,李結貞,江蓮英.激素治療在丙種球蛋白無反應性川崎病患兒中的應用效果[J].實用臨床醫學,2020,21(12):40-42.
[33] 郭翼紅,俞海國,張雅媛,等.靜脈注射用丙種球蛋白聯合糖皮質激素治療丙種球蛋白無反應型川崎病[J].兒科藥學雜志,2016,22(5):9-11.
[34] 陳穎,曾嶸.甲基潑尼松治療靜脈丙種球蛋白無反應型川崎病的療效觀察[J].兒科藥學雜志,2016,22(8):17-19.
[35] 陳鵬,朱之堯,曾曉輝.丙種球蛋白無反應性川崎病的治療研究[J].中南藥學,2011,9(4):307-309.
[36] WANG Z P,CHEN F Y,WANG Y F,et al. Methylpredni- solone pulse therapy or additional IVIG for patients with IVIG-resistant Kawasaki disease[J]. J Immunol Res,2020(4):1-7.
[37] TREMOULET A H,JAIN S,JAGGI P,et al. Infliximab for intensification of primary therapy for Kawasaki di- sease:a phase 3 randomised,double-blind,placebo-controlled trial[J]. Lancet,2014,383(9930):1731-1738.
[38] TERAGUCHI M,OGINO H,YOSHIMURA K,et al. Steroid pulse therapy for children with intravenous immunoglobulin therapy-resistant Kawasaki disease:a prospective study[J]. Pediatric Cardiology,2012,34(4):959-963.
[39] SON M B,GAUVREAU K,BURNS J C,et al. Infliximab for intravenous immunoglobulin resistance in Kawasaki disease:a retrospective study[J]. J Pediatr,2011,158(4):644-649.
[40] PORTMAN M A,DAHDAH N S,SLEE A,et al. Etanercept with IVIG for acute Kawasaki disease:a randomized controlled trial[J]. Pediatrics,2019,143(6):e20183675.
[41] OGATA S,OGIHARA Y,HONDA T,et al. Corticosteroid pulse combination therapy for refractory Kawasaki disease:a randomized trial[J]. Pediatrics,2012,129(1):e17- e23.
[42] MORI M,HARA T,KIKUCHI M,et al. Infliximab versus intravenous immunoglobulin for refractory Kawasaki disease:a phase 3,randomized,open-label,active-controlled,parallel-group,multicenter trial[J]. Sci Rep,2018,8(1):1994.
[43] MIYATA K,KANEKO T,MORIKAWA Y,et al. Efficacy and safety of intravenous immunoglobulin plus prednisolone therapy in patients with Kawasaki disease(post RAISE):a multicentre,prospective cohort study[J].? ? ?Lancet Child Adolesc Health,2018,2(12):855-862.
[44] MORI M,HARA T,KIKUCHI M,et al. Effects of methylprednisolone pulse on cytokine levels in Kawasaki disease patients unresponsive to intravenous immunoglobulin[J]. Eur J Pediatr,2008,167(10):1119-1123.
[45] KOBAYASHI T,MORIKAWA A. Efficacy of intravenous immunoglobulin combined with prednisolone following resistance to initial intravenous immunoglobulin treatment of acute Kawasaki disease[J]. J Pediatr,2013,163(2):521-526.
[46] JIBIKI T,KATO I,SHIOHAMA T,et al. Intravenous immune globulin plus corticosteroids in refractory Kawasaki disease[J]. Pediatrics International,2011,53(5):729-735.
[47] HASHINO K,ISHII M,IEMURA M,et al. Re-treatment for immune globulin-resistant Kawasaki disease:a comparative study of additional immune globulin and steroid pulse therapy[J]. Pediatr Int,2001,43(3):211-217.
[48] HAMADA H,SUZUKI H,ONOUCH Y,et al. Efficacy of primary treatment with immunoglobulin plus ciclosporin for prevention of coronary artery abnormalities in patients with Kawasaki disease predicted to be at increased risk of non-response to intravenous immunoglobulin(KAICA):a randomised controlled,open-label,blinded-endpoints,phase 3 trial[J]. Lancet,2019,393(10176):1128-1137.
[49] FURUKAWA T,KISHIRO M,AKIMOTO K,et al. Effects of steroid pulse therapy on immunoglobulin-resistant Kawasaki disease[J]. Arch Dis Child,2015,93(2):142- 146.
[50] BURNS J C,BEST B M,MEJIAS A,et al. Infliximab treatment of intravenous immunoglobulin-resistant Kawasaki disease[J]. J Pediatr,2008,153(6):833-838.
[51] 花旺,龔方戚.川崎病丙種球蛋白耐藥的預測和治療[J].中國小兒急救醫學,2020,27(9):650-653.
[52] 王韌健,謝利劍,黃敏.靜脈注射丙種球蛋白無反應型川崎病治療進展[J].臨床兒科雜志,2016,34(1):68-72.
[53] MURATA K,MOTOMURA Y,TANAKA T,et al. Calcineurin inhibitors exacerbate coronary arteritis via the MyD88 signalling pathway in a murine model of Kawasaki disease[J]. Clin Exp Immunol,2017,190(1):54-67.
[54] KAWAMURA Y,KANAI T,TAKESHITA S,et al. Use of the urinary trypsin inhibitor ulinastatin for acute Kawasaki disease[J]. Nihon Rinsho,2014,72(9):1650-1653.
[55] 易躍雄,張蔚,劉小媛,等.網狀Meta分析圖形結果解讀[J].中國循證醫學雜志,2015,15(1):103-109.
[56] CHAN H,CHI H,YOU H,et al. Indirect-comparison meta-analysis of treatment options for patients with refractory Kawasaki disease[J]. BMC Pediatrics,2019,19(1):158.
[57] XUE L J,WU R,DU G L,et al. Effect and Safety of TNF inhibitors in immunoglobulin-resistant Kawasaki disease:a meta-analysis[J]. Clin Rev Allergy Immunol,2017,52(3):389-400.
(收稿日期:2021-04-13 修回日期:2021-07-13)
(編輯:陳 宏)

