含貝達喹啉方案治療耐多藥/廣泛耐藥結核病的近期療效及安全性分析
吳國蘭 高靜韜 陳曉紅 陳力舟 翁麗珍 郭志平 陳秀平 林劍東 陳素霞 高孟秋 劉宇紅
耐多藥結核病(MDR-TB)是指至少同時對異煙肼和利福平2種藥品產(chǎn)生耐藥的結核病[1-2], 廣泛耐藥結核病(XDR-TB)是MDR-TB基礎上至少對一種二線注射類和一種氟喹諾酮類藥物同時耐藥[1],需要使用4~5種或以上的二線抗結核藥品進行治療,總療程長達20個月。MDR-TB的治療時間長、治療難度較大、病死率高等問題備受關注[3]。目前,治療MDR-TB的藥物可選擇范圍越來越小,逐漸面臨無藥可治的困境。貝達喹啉是近50年來第1個上市的抗結核新藥,其作用機制獨特,抗結核分枝桿菌(Mycobacteriumtuberculosis,MTB)活性強,臨床療效較好[4-5]。本研究對16例通過篩選入組的MDR-TB/XDR-TB患者,經(jīng)含貝達喹啉方案治療24周后進行近期療效及安全性分析,以期為MDR-TB/XDR-TB患者的治療提供更多的選擇與參考。
資料和方法
一、研究對象
本研究屬于我國貝達喹啉上市后Ⅳ期臨床研究。2018年9月至2020年1月,根據(jù)納入與排除標準,福建省福州肺科醫(yī)院共納入符合條件的MDR-TB/XDR-TB患者16例。其中,男10例,女6例;年齡26~67歲;XDR-TB患者6例,準廣泛耐藥結核病(pre-XDR-TB)患者6例,MDR-TB患者4例;并發(fā)糖尿病4例,并發(fā)毀損肺4例,并發(fā)支氣管結核6例,并發(fā)塵肺2例,并發(fā)胸壁結核1例,并發(fā)淋巴結結核1例,見表1。
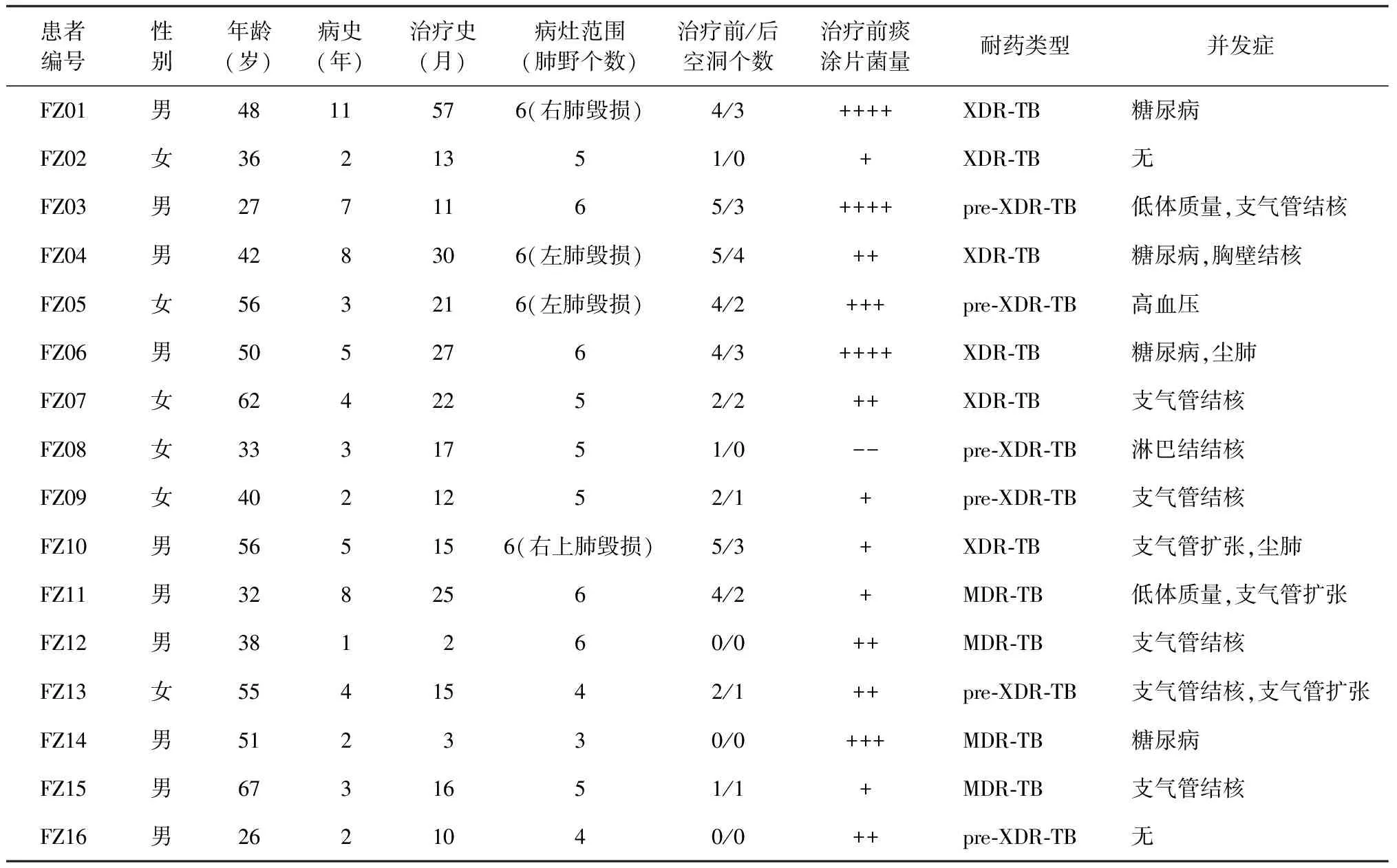
表1 16例MDR/XDR-TB的基本特征
二、 納入和排除標準
1.納入標準:(1)有表型或分子藥物敏感性試驗(drug susceptibility testing,DST)診斷依據(jù)的MDR-TB患者,且目前需要進一步治療;(2)年齡≥18歲;(3)按照WHO發(fā)布的MDR-TB治療原則,需要加入貝達喹啉才能組成有效方案,包括但不僅限于下列患者:XDR-TB、pre-XDR-TB、因其他原因不能使用氟喹諾酮類或注射類藥物的新診斷的耐藥結核病及既往治療失敗的MDR-TB;(4)無明確嚴重心臟病史或心律失常表現(xiàn),心電圖QTc間期≤450 ms;(5)所有研究對象均簽署知情同意書。
2.排除標準:(1)有貝達喹啉過敏史者;(2)有高風險的心臟并發(fā)癥病史(如室性心率失常、近期心肌梗塞等),出現(xiàn)過導致QT間期延長的一種或多種風險因素;(3)近3個月參加其他未上市新藥臨床試驗者。
三、治療方案
1.治療方案制定:(1)根據(jù)患者最近一次DST結果,貝達喹啉與至少3種對患者耐多藥分離菌株敏感的藥品聯(lián)合組成化療方案。在缺乏可靠DST結果時,貝達喹啉與至少4種可能對患者耐多藥分離菌株敏感的藥品聯(lián)合組成化療方案。(2)根據(jù)WHO《耐藥結核病治療整合版指南》[6]及我國《耐藥結核病化學治療指南(2019年簡版)》[7]的選藥原則,并結合患者既往抗結核治療史、耐受性及藥品的可及性制定個體化背景治療方案。16例患者的治療方案具體見表2。

表2 16例MDR/XDR-TB患者含貝達喹啉的個體化方案
2.貝達喹啉用量和用法:劑量100 mg/片,服用劑量400 mg/次(4片),口服,每日1次,用藥2周;2周后200 mg/次(2片),每周3次,用藥22周(每次服藥至少間隔48 h),總療程24周。累計劑量為100 mg×188片。貝達喹啉應用水送下并整片吞服,并與食物同服。
四、觀察與評價
1.療效評定:主要指標為24周痰培養(yǎng)陰轉(zhuǎn)率,開始治療前1周內(nèi)(基線),治療4、8、12、16、20、24周后進行痰培養(yǎng)和菌種鑒定。結核分枝桿菌培養(yǎng)采用BACTEC MGIT 960系統(tǒng)。結核分枝桿菌培養(yǎng)陰轉(zhuǎn)是指基線培養(yǎng)陽性的患者經(jīng)抗結核治療后連續(xù)2次培養(yǎng)結果為陰性,且每次間隔至少4周;陰轉(zhuǎn)時間為患者第一次培養(yǎng)陰性的標本采集時間[7]。在治療前1周內(nèi)(基線)和治療12、24周采用胸部CT掃描,觀察病灶的變化。
2.安全性:分別監(jiān)測入組前1、2、4、8、12、16、20、24周血、尿常規(guī),尿妊娠檢查(育齡期女性),肝腎功能電解質(zhì)檢查,重點監(jiān)測各監(jiān)測時間點的心電圖QTc間期的變化,記錄藥物不良反應及處理情況。
五、統(tǒng)計學處理
采用SPSS 22.0軟件對數(shù)據(jù)進行分析。計量資料呈偏態(tài)分布,以“中位數(shù)(四分位數(shù))[M(Q1,Q3)]”描述;采用秩和檢驗分析治療開始后各監(jiān)測時間QTc值與基線QTc值的差異。以P<0.05為差異有統(tǒng)計學意義。
結 果
一、 治療情況
16例患者均完成強化治療周期24周,1例患者治療第1周出現(xiàn)氣促并呼吸衰竭,考慮可能為對氨基水楊酸鈉所致,停服后并通過呼吸機輔助呼吸后呼吸衰竭糾正,繼續(xù)進行治療及隨訪(背景方案刪除對氨基水楊酸鈉),其余15例24周治療期間均未更改方案。
二、24周治療療效分析
1.痰培養(yǎng)陰轉(zhuǎn)率:16例患者中有15例痰菌陰轉(zhuǎn),中位陰轉(zhuǎn)時間為8(4,12)周,陰轉(zhuǎn)時間2例為4周、10例為8周、3例為12周;1例非結核分枝桿菌(nontuberculous mycobacteria,NTM)陽性1次(FZ06患者),1例患者培養(yǎng)持續(xù)陽性(FZ05患者),DST結果證實為pre-XDR-TB。
2. 病灶和空洞情況:16例患者胸部CT掃描顯示肺部病灶7例顯著吸收,7例部分吸收,2例不變;13例存在肺部空洞患者中,11例空洞縮小和(或)空洞數(shù)減少,2例空洞閉合。
三、安全性分析
1.不良反應及評價:16例患者在24周治療過程中至少出現(xiàn)過一次不良反應,共出現(xiàn)不良反應163例次。不良反應主要集中在QTc間期延長(25.8%,42/163)、可以耐受的胃腸道反應(22.1%,36/163)、肝功能異常(3.7%,6/163)、高尿酸血癥(36.8%,60/163)、白細胞減少(4.3%,7/163)、乏力、關節(jié)肌肉酸痛(3.1%,5/163)、呼吸衰竭(0.6%,1/163)、皮膚紅染(3.7%,6/163),其中1例患者治療第1周出現(xiàn)氣促并呼吸衰竭,考慮可能為對氨基水楊酸鈉所致,停服后并通過呼吸機輔助呼吸后呼吸衰竭糾正,此例不良反應歸為嚴重不良反應,其余不良反應為2級及以下。
2.心電圖QTc間期的變化:16例患者的基線心電圖QTc間期值中位數(shù)為412.50(398.25,420.75) ms;各監(jiān)測時間的QTc間期值見表3。開始治療后2周、4周、8周QTc間期與基線QTc間期值比較,差異無統(tǒng)計學意義(Z=-0.569,P=0.569;Z=-1.242,P=0.214;Z=-0.078,P=0.938);開始治療后12周、16周、20周、24周QTc間期與基線QTc間期值比較,差異有統(tǒng)計學意義(Z=-2.198,P=0.028;Z=-2.096,P=0.036;Z=-1.965,P=0.049;Z=-2.406,P=0.016)。16例患者均未出現(xiàn)QTc間期>500 ms。

表3 16例MDR/XDR-TB患者各監(jiān)測時間QTc間期值與基線QTc間期值的比較
討 論
2018年6月我國首次出版了《抗結核新藥貝達喹啉臨床應用專家共識》,提示貝達喹啉的作用機制與傳統(tǒng)抗結核藥品的作用機制不同,故無交叉耐藥性,并對敏感菌株、多耐藥菌株及休眠菌的抗菌活性較高[8]。2019年WHO發(fā)表的文獻[6]、《耐藥結核病化學治療指南(2019年簡版)》[7]和《中國耐多藥和利福平耐藥結核病治療專家共識(2019年版)》[9]等均將抗結核新藥貝達喹啉作為A組首選藥品使用,另外,貝達喹啉對NTM肺病的治療同樣有效[10]。
對于MDR-TB患者,由于抗結核新藥匱乏,既往方案治療成功率僅為50%左右[8],而貝達喹啉作為多重耐藥結核病治療方案一部分治療痰檢陽性的MDR-TB患者的全球多中心Ⅱ期臨床、開放性試驗研究顯示,含貝達喹啉組第24周痰培養(yǎng)陰轉(zhuǎn)率為78.8%[8]。2012年12月,貝達喹啉獲得美國食品藥品監(jiān)督管理局審批通過,已經(jīng)在美國、歐洲、日本先后上市。2016年12月,我國國家食品藥品監(jiān)督管理總局批準貝達喹啉在中國有條件上市,主要用于成人(≥18歲)MDR-TB的治療,在中國已逐漸真正應用于臨床。本研究納入的16例MDR-TB/XDR-TB患者,均存在高度耐藥或既往藥物不耐受的情況,若不使用貝達喹啉則難以組成有效治療方案,16例MDR-TB/XDR-TB患者在使用含貝達喹啉方案治療24周后,胸部CT掃描顯示肺部病灶7例患者顯著吸收,7例部分吸收,2例不變;13例存在肺部空洞患者中,11例空洞縮小和(或)空洞數(shù)減少,2例空洞閉合,16例患者中15例痰培養(yǎng)陰轉(zhuǎn),中位陰轉(zhuǎn)時間為8(4,12)周,取得了較滿意的近期療效。Gao等[11]研究顯示,使用含貝達喹啉方案治療的中國MDR-TB患者,24周痰培養(yǎng)陰轉(zhuǎn)率為85.3%,其中XDR-TB患者的陰轉(zhuǎn)率也達到了86.6%。一項多中心研究顯示,接受貝達喹啉治療的患者痰培養(yǎng)陰轉(zhuǎn)中位時間為60(33,90) d[12],本研究結果與之相仿(8周)。由此可見,貝達喹啉作為近50年來的第一種新藥,其全新的作用機制及良好的臨床療效為MDR-TB患者帶來了新的希望[8]。
由于涉及到新藥安全性問題,尤其是貝達喹啉的半衰期長,可能影響QTc間期延長等不良反應。本研究16例患者使用含貝達喹啉方案治療24周過程中不良反應主要集中在QTc間期延長、可以耐受的胃腸道反應、肝功能異常、高尿酸血癥、白細胞減少、乏力、關節(jié)肌肉酸痛、呼吸衰竭、皮膚紅染,以上不良反應與很多研究相類似[13-16]。目前患者的不良反應不影響持續(xù)用藥,未對治療結果造成不良影響。以上不良反應經(jīng)評價,考慮QTc間期延長與貝達喹啉可能相關,其余不良反應與背景抗結核治療用藥有關。心電圖QT間期反映心室肌動作電位去極化和復極化的過程,QT間期延長時,左心室更容易受到早搏影響,有發(fā)生尖端扭轉(zhuǎn)型室性心動過速進而導致心源性猝死的風險[17]。本研究和其他多數(shù)研究均采用按Fridericia法校正的QT間期(即QTc間期)來評估QT間期延長的情況[18-19]。當出現(xiàn)QTc間期超過500 ms時要考慮停用貝達喹啉[8]。本研究顯示,開始服用貝達喹啉治療后患者在各監(jiān)測時間的QTc間期較基線均有升高,治療開始后2周、4周、8周QTc間期與基線QTc間期值比較,差異無統(tǒng)計學意義,治療開始后12周、16周、20周、24周QTc間期與基線QTc間期值比較,差異有統(tǒng)計學意義,但16例患者中未出現(xiàn)QTc間期>500 ms,未發(fā)生嚴重心臟事件,沒有患者因為貝達喹啉相關不良反應而中斷治療隨訪。且這些患者都有聯(lián)合服用其他可能導致QTc間期延長的抗結核藥品(如莫西沙星、氯法齊明等)。據(jù)此,若QTc間期小于500 ms,患者無相關臨床癥狀,可在密切監(jiān)測下繼續(xù)用藥。另外,其中1例患者痰培養(yǎng)持續(xù)陽性,該患者治療第1周出現(xiàn)氣促并呼吸衰竭,考慮可能為對氨基水楊酸鈉所致,停服后并通過呼吸機輔助呼吸后呼吸衰竭糾正,后逐漸加服貝達喹啉及背景抗結核藥品繼續(xù)進行治療及隨訪。
總之,貝達喹啉聯(lián)合常規(guī)方案治療MDR-TB/XDR-TB患者獲得了較好的臨床療效且安全性較高,豐富了MDR-TB/XDR-TB患者的臨床藥物種類,為MDR-TB/XDR-TB患者的治療提供了更多的選擇。為進一步發(fā)揮含貝達喹啉的新化療方案治療難治性MDR-TB/XDR-TB患者的療效,使其在治療過程中發(fā)生不良反應和耐藥等問題達到最小化,應規(guī)范推廣使用,嚴格掌握適應證和禁忌證,避免濫用。
本研究因為病例數(shù)少,且為單中心數(shù)據(jù),存在一定的局限性。因此,MDR-TB/XDR-TB患者使用含貝達喹啉方案的療效及安全性評價,仍需要擴大樣本量以進一步觀察;其遠期療效亦待后期進一步隨訪觀察。

