未見原核來源囊胚復蘇移植的臨床價值
任卉, 涂劍
岳陽市婦幼保健院生殖醫學中心(湖南岳陽 414000)
體外受精胚胎移植過程中,通常選擇授精后(17±1)h觀察原核,正常受精卵有2個原核(2PN),由于原核發育不同步或觀察時機局限,12%~20%的受精卵未觀察到原核(0PN)[1]。而國內外有研究報道移植非2PN來源胚胎可獲得健康子代[2-3]。囊胚培養能夠淘汰部分發育潛能差及染色體異常胚胎,為提高妊娠率提供了技術條件。為了提高胚胎的利用率,在IVF新鮮周期中,未獲得2PN來源胚胎,或移植失敗后無2PN來源胚胎的患者,我中心選擇復蘇移植0PN來源囊胚。本文通過對在我中心接受0PN來源囊胚凍融移植患者的臨床妊娠結局進行回顧性分析,評價0PN來源囊胚移植的臨床價值。
1 資料與方法
1.1 一般資料 收集2017年1月至2019年12月在我中心接受體外受精-胚胎移植(IVF-ET)助孕治療,有囊胚培養的848例患者,鮮胚移植失敗或取消移植后,進行凍融囊胚移植患者為研究對象。行0PN來源囊胚解凍移植患者為0PN組,同時期行解凍移植2PN來源囊胚患者為2PN組。0PN來源囊胚移植48例,2PN來源囊胚移植297例,所有周期移植胚胎數目均未超過2枚。
1.2 方法
1.2.1 胚胎觀察時間 本中心常規使用Vitrolife G5系列培養基。授精后(18~19 h)觀察原核 (D1)、(68±1)h觀察卵裂胚(D3)、[(116/140±2)]h觀察囊胚(D5、D6)生長情況。
1.2.2 胚胎的評分和處理 (1)原核觀察:正常受精卵可觀察到2PN,未觀察到原核而后續發育成胚胎的為0PN,觀察到1個原核為單原核受精(1PN),≥3個原核為多PN受精。(2)D3卵裂期胚胎評分標準:根據Veeck等卵裂胚評估辦法,結合我中心實際操作進行評估。Ⅰ級:卵裂球數目為7~9個,卵裂球均勻且碎片≤5%;Ⅱ級:卵裂球數目為7~12個,卵裂球均勻或大致均勻且碎片≤10%;Ⅲ級:卵裂球發育速度大致正常,卵裂球大致均勻或不均勻且碎片≤15%;Ⅳ級:胚胎發育速度異常,卵裂球不均勻且碎片≥20%。D3的Ⅰ~Ⅱ級胚胎為優質胚胎,Ⅲ級胚胎為可移植胚胎,均可用于移植或冷凍。(3)囊胚評分標準:根據Gardner分級標準,根據囊胚擴張狀態和孵出程度進行分期,根據內細胞團(ICM)和滋養層細胞(TE)評分進行分級,本中心以3BC及以上級別囊胚為可利用囊胚,4BB、4BA、4AB和4AA為優質囊胚。(4)在新鮮IVF周期中,我中心常規選擇1~2個2PN來源胚胎移植或冷凍,剩余Ⅲ級及以上級別2PN卵裂胚和全部0PN可用卵裂胚進行囊胚培養(卵裂球數目≥4個且碎片率<20%),根據囊胚評級標準,選擇可利用囊胚及優質囊胚進行移植或冷凍保存,冷凍的囊胚后續在復蘇周期進行移植。
1.2.3 囊胚的冷凍與復蘇 本中心采用玻璃化冷凍技術冷凍胚胎,所用試劑為日本Kitazato公司加藤系列。將需冷凍的胚胎轉移至ES微滴靜置5~10 min;平衡后,轉移胚胎至VS微滴中靜置1 min,胚胎轉移至Cryoleaf上,然后浸入液氮中,整個過程必須<90 s。復蘇方法依照玻璃化解凍復蘇方法進行,在液氮中拔掉Cryoleaf保護套后,將前端直接浸入WS1中1 min,觀察胚胎是否脫落下來;隨后轉移胚胎至WS2中靜置4 min;再轉入WS3中靜置4 min;轉入WS4中靜置4 min,后轉入囊胚G-2 PLUS培養皿中培養。
1.2.4 胚胎移植 解凍后培養2 h,觀察質量評估:囊腔復擴完全,滋養層和內細胞團無退化者視為可移植囊胚,向患者交代風險并簽署知情同意書后,進行移植,移植胚胎數≤2個。
1.3 臨床妊娠確認 移植術后14 d行β-HCG血檢陽性為生化妊娠;28 d后經陰道B超監測,可見孕囊和原始胎心搏動確認臨床妊娠。
1.4 觀察指標計算公式 囊胚形成率=形成囊胚數/培養囊胚數;可利用囊胚形成率=可利用囊胚數/培養囊胚數;優質囊胚率=優質囊胚數/培養囊胚數;種植率=孕囊數/移植胚數;臨床妊娠率=臨床妊娠例數/移植患者例數;流產率=流產例數/臨床妊娠例數;抱嬰率=獲得活產的患者例數/移植患者例數。
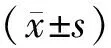
2 結果
2.1 不同原核囊胚培養情況 本研究收集IVF周期中有235個周期共435枚0PN卵裂胚進行囊胚培養,形成優質囊胚118枚,優質囊胚率為27.13%,同時期656個周期共2 891枚2PN卵裂胚進行囊胚培養,形成優質囊胚644枚,優質囊胚率為22.28%。兩者囊胚形成率差異無統計學意義(P>0.05),0PN來源可利用囊胚率和優質囊胚率均高于2PN來源囊胚,差異有統計學意義(P<0.05),見表1。

表1 不同原核囊胚培養情況比較 %(個)
2.2 移植及妊娠情況 48例0PN組移植76枚囊胚,臨床妊娠33例。297例2PN組移植胚胎478枚,臨床妊娠189例。兩組年齡、移植日內膜厚度、移植囊胚數差異無統計學意義(P>0.05),見表2。0PN組的胚胎著床率(59.21 %vs52.72%)、臨床妊娠率(68.75 %vs63.64%)、流產率(18.18 %vs14.29%)、抱嬰率(54.17 %vs53.54%)均高于2PN組,但差異無統計學意義(P>0.05),見表3。
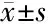
表2 患者移植基本情況比較

表3 不同原核囊胚妊娠情況比較 %(周期)
2.3 妊娠結局 0PN組臨床妊娠33例,早期流產5例,1例中期引產,1例異位妊娠,未發生三胎妊娠。其中26例活產分娩,雙胎9例單胎17例(男19女15),隨訪34個出生嬰兒均健康,未見畸形。
3 討論
精卵結合受精是一個復雜而精細的生理過程。在實際臨床工作中,大部分原核在受精16~20 h可被觀察到,受精提前或延遲而錯過原核觀察時間,受精缺陷、未參與核遺傳物質的形成有可能導致0PN胚胎形成[4]。胚胎8細胞之前的發育主要由卵母細胞質量決定,發育至融合階段后,胚胎基因組激活并決定胚胎的繼續發育。Fancsovits等[5]提出原核提早消失可能提示胚胎具有較高的質量。囊胚培養作為輔助生殖技術的重要組成部分,可以通過自然篩選淘汰部分染色體異常的胚胎[6]。Liao等[7]研究發現囊胚染色體異常率明顯低于卵裂胚。Malcov等[8]通過熒光原位雜交技術鑒定分析,結果表明有57%(13/23)的0PN胚胎為是正常二倍體胚胎,6個有Y染色體,而非孤雌激活。有研究報道發現移植0PN來源的新鮮卵裂期胚胎、凍融卵裂期胚胎和凍融囊胚期胚胎均有可能懷孕和活產[9]。鄒林兵等[10]研究表明復蘇移植0PN來源囊胚獲得了45.0% (18/40)的臨床妊娠率。101例新鮮移植0PN來源胚胎最后獲得9例的臨床妊娠,活產6例健康嬰兒,2例持續妊娠,1例胎停[11]。這些研究充分說明部分0PN來源胚胎存在正常來源二倍體,具有移植可行性。
胚胎發育是一個動態過程,目前常用的胚胎的觀察和篩選大多為傳統形態學觀察法,即在胚胎發育的數天中幾個特定時間點觀察胚胎。我中心IVF周期中0PN發生率為6.9%。時差成像技術(time-lapse imaging,TLI)是一種無創胚胎質量評估系,與傳統觀察法比較,TLI既保證了培養微環境的穩定,也可對胚胎在體外發育過程進行全程監控。通過TLI系統可有效觀察到原核的形成和消失過程,卵裂球分裂模式,幫助胚胎學家更加有效地評價胚胎質量。有文獻表明,使用Time-lapse培養的2PN率要明顯高于常規培養組[12]。Meseguer等[13]大數據回顧性研究結果證明,應用觀察的動態參數挑選胚胎與傳統方法相比臨床妊娠率可提高約20%。
囊胚形成率和可利用囊胚率能較準確地體現胚胎發育潛能。本研究IVF周期有囊胚培養848例,其中0PN胚胎獲得了與2PN胚胎相當的囊胚形成率,甚至0PN來源可利用囊胚和優質囊胚率均高于2PN組,可能與第3天2PN優質胚胎被挑選用于新鮮移植和冷凍有關。囊胚培養結果說明0PN胚胎也具有較好的發育潛能,這大大提高了卵母細胞的利用率。48例復蘇移植0PN來源囊胚的患者獲得了68.75%的臨床妊娠率,與同期復蘇移植2PN來源囊胚患者臨床妊娠(63.64%)結果相當。移植0PN囊胚組共計出生34名嬰兒,體檢均健康未見異常。0PN組流產率雖高于2PN組(18.18%vs14.29%),卻無統計學意義(P>0.05),數據顯示有增加的趨勢,考慮0PN來源囊胚可能存在染色體異常風險而導致的流產。上述結果表明0PN的發生并不一定是受精失敗,0PN胚胎具有良好的發育潛能,可將其培養至囊胚后再冷凍保存。對無2PN胚胎可利用患者來說,0PN來源囊胚可優先作為復蘇移植備選胚胎。
本研究不足之處,雖然移植0PN來源囊胚患者獲得了較好的臨床結局,但存在研究樣本量較少,數據可能有一定偏倚,后期需要進一步擴大樣本量觀察。由于時差系統的高額經濟成本,我中心暫未能引入臨床實際使用。后續考慮患者知情同意和經濟可承擔基礎上,通過增加對0PN來源囊胚的遺傳學檢測篩查再移植,可更好地降低異常子代出生風險。
綜上所述,IVF助孕周期中未獲得正常來源胚胎,或移植失敗后已無2PN來源胚胎的患者,可選擇0PN來源囊胚進行凍融周期移植,從而提高胚胎利用率,改善部分患者的臨床治療結局。隨著時差成像技術、植入前診斷技術等技術快速發展和應用,可進一步為非正常受精胚胎的利用做出有效的臨床指導和更加安全的治療方案。

