乳腺癌細胞系MCF-7中阿霉素的代謝物分析
陳雨蕉,惠人杰,王 敘,朱景宇,賈 磊,金 堅,陳 蘊
(江南大學藥學院藥物設計與分子藥理研究室,江蘇 無錫 214122)
阿霉素(doxorubicin,DOX)是一種傳統的蒽環類化療藥物,乳腺癌是其適應癥之一。阿霉素的作用機制是通過細胞膜并嵌入DNA,導致DNA斷裂和干擾DNA復制[1],從而發揮其抗腫瘤作用。體內藥代動力學表明,約50%的阿霉素以原型藥形式排出人體,蒽環類藥物的體內代謝是通過羥基化、形成半醌或脫氧苷元進行的,從而增強或抑制蒽環類藥物的抗癌活性[2]。已報道代謝產物有阿霉素醇、阿霉素半醌、阿霉素羥基苷元、阿霉素脫氧苷元和阿霉素醇苷元[3]。其中,7-脫氧阿霉素酮和阿霉素醇已被證明與心肌細胞的心臟毒性有關[1]。
經典的藥代動力學可以獲得機體對藥物處置的基本信息,包括藥物在機體內的吸收、分布、代謝和排泄的數據。然而越來越多數據表明,傳統的體內藥代動力學不能完全解釋藥物對腫瘤的藥理作用,一些藥物在靶細胞中無法積蓄導致藥物治療效果差[4]。藥物的細胞內處置過程和結合靶點的濃度是觀察靶器官治療反應的決定因素[5]。基于血漿藥物濃度的經典藥代動力學研究可能不足以預測體內反應,無法從腫瘤靶細胞角度解釋藥物分子作用的行為特征,現有研究缺乏靶細胞對于藥物處置的認識,需要擴大藥代動力學范圍,對其進行進一步研究[6]。
人乳腺癌細胞系MCF-7是阿霉素適應癥乳腺癌公認的成熟的細胞模型,在MCF-7的耐藥研究中發現其耐阿霉素耐藥株MCF-7/DOX相比野生細胞MCF-7/WT能能耐受更高濃度藥物,且代謝阿霉素速率更高[7],有特殊的胞內藥物代謝物,故選擇其作為研究阿霉素靶細胞內處置的靶細胞模型。開發了一套腫瘤靶細胞處置藥物的分析方法,MCF-7/DOX阿霉素耐藥株作為靶細胞模型,使用超高效液相色譜-四級桿串聯飛行時間質譜聯用儀(UPLC-Q-TOF-MS/MS)分析研究阿霉素胞內藥物代謝物,通過高分辨率多級質譜解析推斷未知代謝物結構。
1 材料與方法
1.1 實驗材料
1.1.1細胞 野生型人乳腺癌細胞系MCF-7/WT,購自美國菌種保藏中心ATCC細胞庫;阿霉素耐藥細胞MCF7/DOX為本實驗室由MCF-7/WT構建培養[8]。
1.1.2試劑 鹽酸阿霉素(純度>98%,貨號:MB1087)購自大連美侖生物科技有限公司;色譜級甲醇和甲酸購自美國TEDIA公司;實驗用水為超純水;其余溶劑均為分析純;CellTiter-Blue細胞活力試劑盒購自無錫萊弗斯生物公司。
1.1.3儀器 ACQUITY UPLC超高效液相色譜儀(沃特世,美國);Xevo G2 Q-TOF四級桿串聯飛行時間質譜儀(沃特世,美國)。
1.2 實驗方法
1.2.1細胞培養 配置含阿霉素培養基培養MCF-7/WT,使用CellTiter-Blue試劑盒測定細胞對阿霉素的IC50,從IC50的1/10開始,低濃度誘導其耐藥,待細胞適應且穩定生長后逐步增加藥量。直到多藥耐藥細胞系MCF-7/DOX耐藥倍數穩定在100倍以上,耐藥倍數=IC50(MCF-7/DOX)/IC50(MCF-7/WT)。兩種細胞系都使用添加了10%血清、1%青霉素-鏈霉素抗生素和2 kU·L-1胰島素的DMEM培養基培養,耐藥細胞MCF-7/DOX額外添加2.0 mg·L-1的DOX以維持其耐藥性,并在實驗前撤藥7 d以防止藥物對實驗結果的干擾,生長環境為37 ℃及5% CO2。
1.2.2細胞存活率檢測 用Cell Titer-Blue試劑測定細胞給阿霉素后24 h存活率,按照說明書操作,用酶標儀測量熒光值。未經DOX處理的細胞作為對照,每個濃度設置3個復孔,于EX 560 nm, EM 590 nm 進行熒光檢測,使用軟件GraphPad Prism7計算細胞存活率。
1.2.3液相色譜-串聯質譜樣品的制備 MCF-7/WT野生型細胞和MCF-7/DOX耐藥細胞分別在T75細胞培養瓶中培養至匯合度80%,后更換含阿霉素培養基培養24 h,阿霉素濃度分別為7.7 mmol·L-1和370 mmol·L-1,在此條件下兩種細胞存活率都在70%以上。將細胞用胰酶消化收集后,用PBS緩沖液洗滌離心3次后除盡PBS。使用乙醇:0.3 mol·L-1鹽酸 ∶100%三氯乙酸=2 ∶2 ∶1的提取液提取阿霉素靶細胞代謝物,每3.8×106個細胞用1 mL提取液重懸并用400 W冷水浴超聲1 h破碎細胞壁提高提取效率,后在12 000g,4 ℃下離心30 min后收集上清液過0.22 μm有機濾膜,存放于-80 ℃以待進一步的UPLC-MS/MS分析。
1.2.4UPLC-MS/MS條件
1.2.4.1 UPLC色譜條件 色譜柱使用ACQUITY UPLC BEH C18 Column(1.7 μm,2.1 mm×50 mm),柱溫25 ℃。流動相使用甲醇(A相)和0.1%(V/V)甲酸水(B相)。使用梯度洗脫法,從10% A開始,隨后在9 min內線性增加到95% A,保持到11 min后在11.5 min降回10% A,保持到15 min進行柱平衡,總時間為15 min,流速為0.2 mL·min-1,進樣量為3 μL,二極管陣列檢測器(PDA)檢測波長范圍設置為200-800 nm。
1.2.4.2 Q-TOF-MS/MS質譜條件 電噴霧離子源(ESI),正離子模式掃描:掃描范圍m/z100-1 500,毛細管電壓3.0 kV,錐孔電壓40 V,錐孔氣流速60.0 L·h-1,脫溶劑氣(N2) 流速600 L·h-1。碰撞能量20 eV。
1.2.5分子對接分析 將阿霉素及其代謝物與DNA進行分子對接,以進一步了解阿霉素及其代謝物與DNA之間的作用機制。DNA晶體結構(PDB ID:2DND)取自PDB數據庫(http://www.rcsb.org/);阿霉素三維結構從Pubchem Compound數據庫(https://www.ncbi.nlm.nih.gov/pccompound/term=)檢索并下載;使用Schr dinger2017基于阿霉素結構繪制出m/z=606和m/z=641兩個代謝物的結構。使用Protein preparation wizard模塊對DNA結構進行預處理,然后使用LigPrep模塊優化3個小分子,使用Receptor grid generation模塊以DNA晶體結構中的配體為中心生成格點文件,最后應用Glide模塊進行對接,對接采用Standard precision(SP)精度,其余參數默認。
2 結果
2.1 細胞存活率測定MCF-7/DOX和MCF-7/WT細胞阿霉素處理24 h存活率如Fig 1,其中X軸為阿霉素濃度的對數值、Y軸為細胞存活率,取細胞給阿霉素24 h后存活率約70%作為給藥濃度,MCF-7/WT為7.7 μmol· L-1,MCF-7/DOX為370 μmol·L-1。

Fig 1 Determination of cell survival rate of MCF-7/WT andMCF-7/DOX treated with various concentrations of DOX for 24 h
2.2 UPLC-MS/MS分析MCF-7耐藥型與野生型阿霉素代謝物的差異對MCF-7/WT和MCF-7/DOX細胞裂解物提取液進行UPLC-Q-TOF-MS/MS分析。羥基化的三元醌環是蒽環類化合物紅色至橙色的特征發色團,包括阿霉素在內的蒽環類藥物在可見光范圍內的480 nm處有特征吸收[1],獲得480 nm處色譜圖,如Fig 2所示,阿霉素保留時間為5.64 min。雖然兩種細胞代謝物中阿霉素色譜峰的吸收強度大致相等,但在耐藥細胞色譜中觀察到許多未在野生細胞色譜中發現的代謝物峰。其中,保留時間為6.17 min、6.58 min的兩種物質分別對應m/z574和m/z588,其結構已在前期發表的文獻中進行了報道[9],為阿霉素的結構基礎上的氧化-烷基化修飾結果,修飾位點在10號位,分別加上氧甲基和氧乙基。本研究在此基礎上又發現了兩種新的代謝物(M1和M2),保留時間分別為6.02 min和7.87 min,m/z分別為606和641。其中M1與Wang等[9]研究中的代謝物可能存在結構聯系,而M2可能與細胞中氨基酸代謝相關。
2.3 MCF-7/DOX中的阿霉素代謝物的質譜裂解分析Fig 3顯示了阿霉素標準品和來自耐藥細胞的阿霉素代謝物(M1和M2)的一至四級質譜裂解過程。一級圖譜MS1顯示阿霉素m/z544、阿霉素代謝物M1m/z606及M2m/z641 (Fig 3A、E、I),阿霉素的二、三、四級圖譜(MS2、MS3、MS4)分別通過鎖定m/z544、397、379獲得碎片(Fig 3B、C、D),代謝物M1的二、三、四級圖譜(MS2、MS3、MS4)分別通過鎖定m/z606、441、395獲得碎片(Fig 3F、G、H),代謝物M2的二、三、四級圖譜分別通過鎖定m/z641、494、476獲得碎片(Fig 3J、K、L)。
通過多級質譜分析,推斷阿霉素的質譜裂解途徑為544→397→379→321。阿霉素MS2(Fig 3B)顯示有m/z397和379兩個強峰,對應于其D環上的糖苷基團的掉落(Δm/z=147),以及碎片離子進一步脫水所得的峰(Δm/z=165)。雖然代謝物M1、M2與阿霉素有不同的分子量,但是它們與阿霉素有相同的碎片丟失。分別鎖定母離子m/z606、m/z641進行二級質譜碎裂得到MS2譜圖(Fig 3F、J),顯示兩個代謝物結構碎片中有Δm/z=147或165的丟失,(M1:m/z606→441,Δm/z=165;M2:m/z641→494,Δm/z=147)。這個結果表明阿霉素與M1、M2結構中糖苷基團結構基本一致,這也是其作為阿霉素代謝物的重要證據。
代謝物M1(m/z606)的MS2顯示m/z395和377兩個強峰(Fig 3F),對應阿霉素MS2碎片中m/z397和379有一個不飽和度的差異(Fig 3B),MS3結果顯示,395和377信號很強(Fig 3G),它們很可能與阿霉素的397和379這兩個碎片有相關性。隨后選擇MS3中的碎片m/z395進行碎裂,MS4顯示m/z377強峰,驗證了其來源于碎片m/z395。多級質譜顯示M1離子m/z395的碎裂方式與m/z397(DOX)類似,通過多次脫水都可以得到離子m/z321。
代謝物M2的MS2顯示有碎片m/z641、494、476和458,與阿霉素碎片m/z544、397、379和361比對,都有Δm/z=97的差異,推測代謝物M2與阿霉素主體結構一致,并具備一個穩定的附加基團。m/z494的MS3顯示476和458信號很強(Fig 3K),裂解行為與阿霉素中的379和361碎片離子相似。m/z476的MS4顯示319碎片離子且信號強(Fig 3L)。代謝物M1與Wang等[9]推斷的m/z=574和m/z=588的代謝物結構相當類似,在它們的多級質譜中都觀察到相同的m/z395、377和321,并遵循相同的碎裂過程(606→441→395→377→321)。代謝物M2與阿霉素相差97分子量,并且在多級質譜的碎裂過程中始終保持該質荷比差異(M2/DOX:641/544→494/397→476/379,Δm/z=97),可以判斷其為阿霉素相關代謝產物。
2.4 阿霉素的代謝物的結構推測根據阿霉素和代謝物質量碎裂模式的異同,推導了代謝物的化學結構及其質譜碎裂途徑,如Fig 4所示。
從質量數差異推測代謝物M1為已報道代謝產物m/z588的羥基化產物,其代謝過程同已報道的m/z588過程相似,首先脫去糖苷基團和一分子水,隨后m/z441的碎片離子產生二級離子m/z395,根據高分辨質譜的數據,推斷其為CH4O(m/z=32.03)的丟失。對m/z377的次級碎片離子研究表明,其產生m/z349、321時連續丟失兩次CO(m/z=27.99),發生了類似C=O基團的級聯斷裂。為了保證糖苷基團完整掉落,7、8位置不能被修飾,且氧化及一系列甲基化位置若發生在14位則化合物結構不穩定,故修飾位置只可能在10位。m/z606在m/z588基礎上繼續氧化,增加的氧化修飾位置極大可能在D環側鏈的13位,C=O雙鍵還原后加上羥基。
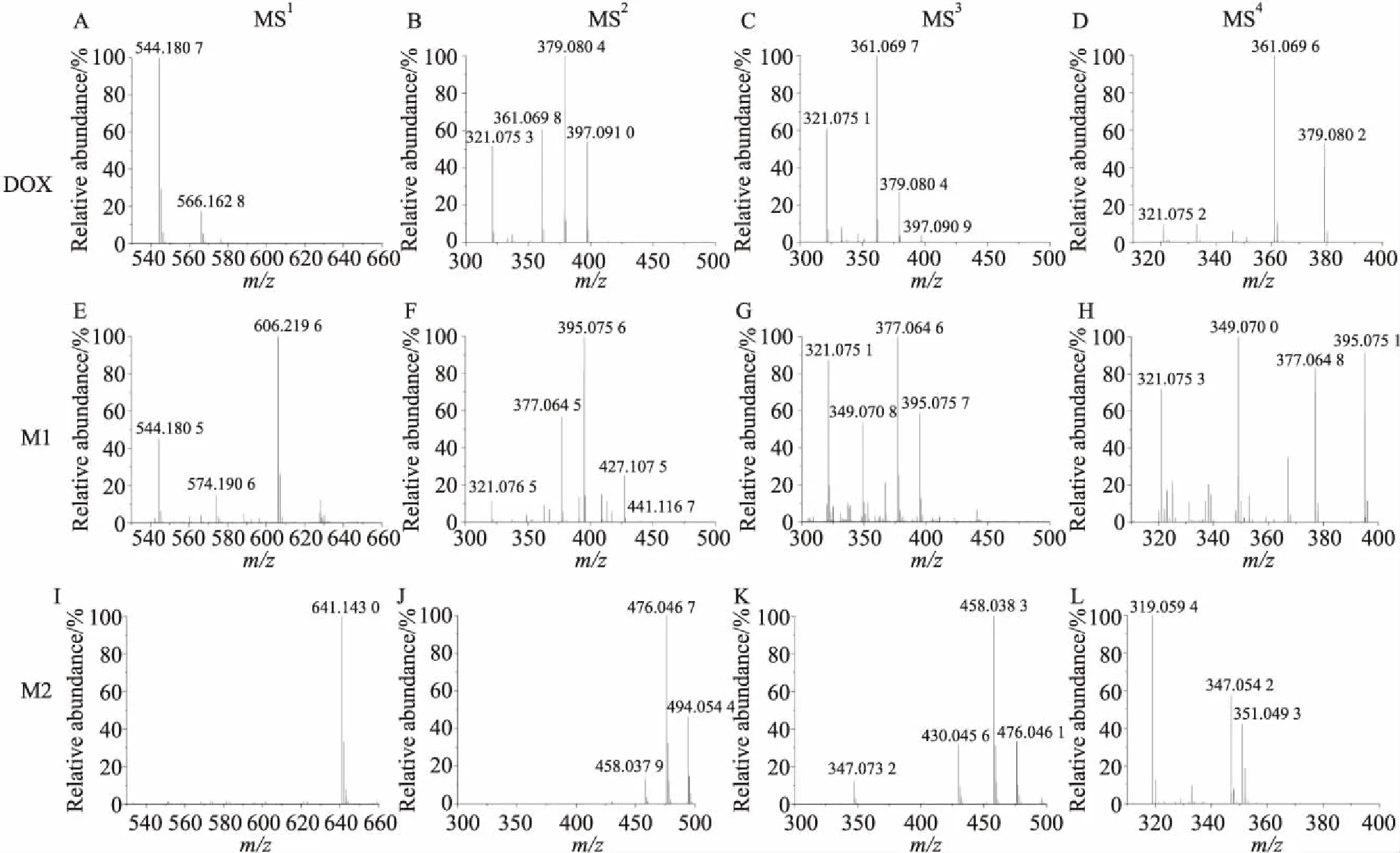
Fig 3 MSn of DOX and its metabolites M1 and M2
而代謝物M2與阿霉素質量數相差97,并在裂解過程中保持該質量差異,最終產生與蒽環基本結構m/z321具有一個不飽和度差異的碎片m/z319。該結果表明,在蒽環的某個活性位點新增了一個質量數為97的化學基團,且結合牢固,但由于未有更多裂解碎片信息,暫時還未獲得更多碎片信息以準確判斷該化學基團結構。
根據分子量推測,很可能為脯氨酸與阿霉素上羥基脫水縮合后的殘基質量(m/z=97.06)。為了保證糖苷基團的完整掉落,修飾位置不可能在糖苷基團上,若在D環側鏈末端羥基位置上,則不可能出現m/z458、430的碎片代謝物,因空間位阻效應也不能在6位羥基,因此脯氨酸修飾位置極大可能在11位羥基。
2.5 分子對接分析阿霉素及其兩種代謝物與DNA的對接打分結果顯示,阿霉素與DNA雙鏈對接打分最好(-9.369 kcal·mol-1),m/z=641稍低(-8.358 kcal·mol-1),m/z=606最低(-7.191 kcal·mol-1),該結果表明相較于其代謝產物,阿霉素與DNA具有更強的親和力。阿霉素與DNA對接的三維結構(Fig 5A)顯示,阿霉素以一種平行于DNA雙鏈結構的結構嵌入DNA雙鏈中,該模擬結果與阿霉素嵌入DNA,導致DNA斷裂和干擾DNA復制的實驗機制相吻合,這種平行的結合方式使得阿霉素能夠更深入的結合進DNA,從而產生較高的結合能力。而代謝物m/z=606及代謝物m/z=641的3D對接結果(Fig 5B、C)顯示,這種平行結合方式在代謝物M1和M2與DNA的結合中丟失,相較阿霉素嵌入DNA的結合位點,代謝物M1和M2與DNA的結合位點均呈現出一定程度偏離,脫離了DNA雙鏈,造成結合能力的下降。二維作用圖表明(Fig 5a,b,c),阿霉素及其代謝物與DNA發生作用的位置主要在9位和14位的羥基,以及糖苷基團的氨基取代基上。3個小分子的糖苷基團都和DNA的堿基發生了作用,而差異之處主要是羥基和堿基發生的作用,m/z=606的代謝物的羥基沒有和堿基發生作用,從而降低了結合能力,因此對接得分最低。而阿霉素的9位、14位以及蒽環結構的羥基分別與堿基發生了作用,而m/z=641的代謝物只有9位和14位羥基與堿基相互作用。綜上所述,阿霉素與DNA具有獨特的平行結合方式,該方式使得阿霉素與DNA較其代謝產物產生了更多的相互作用力,最終造成了阿霉素與DNA的高結合力。
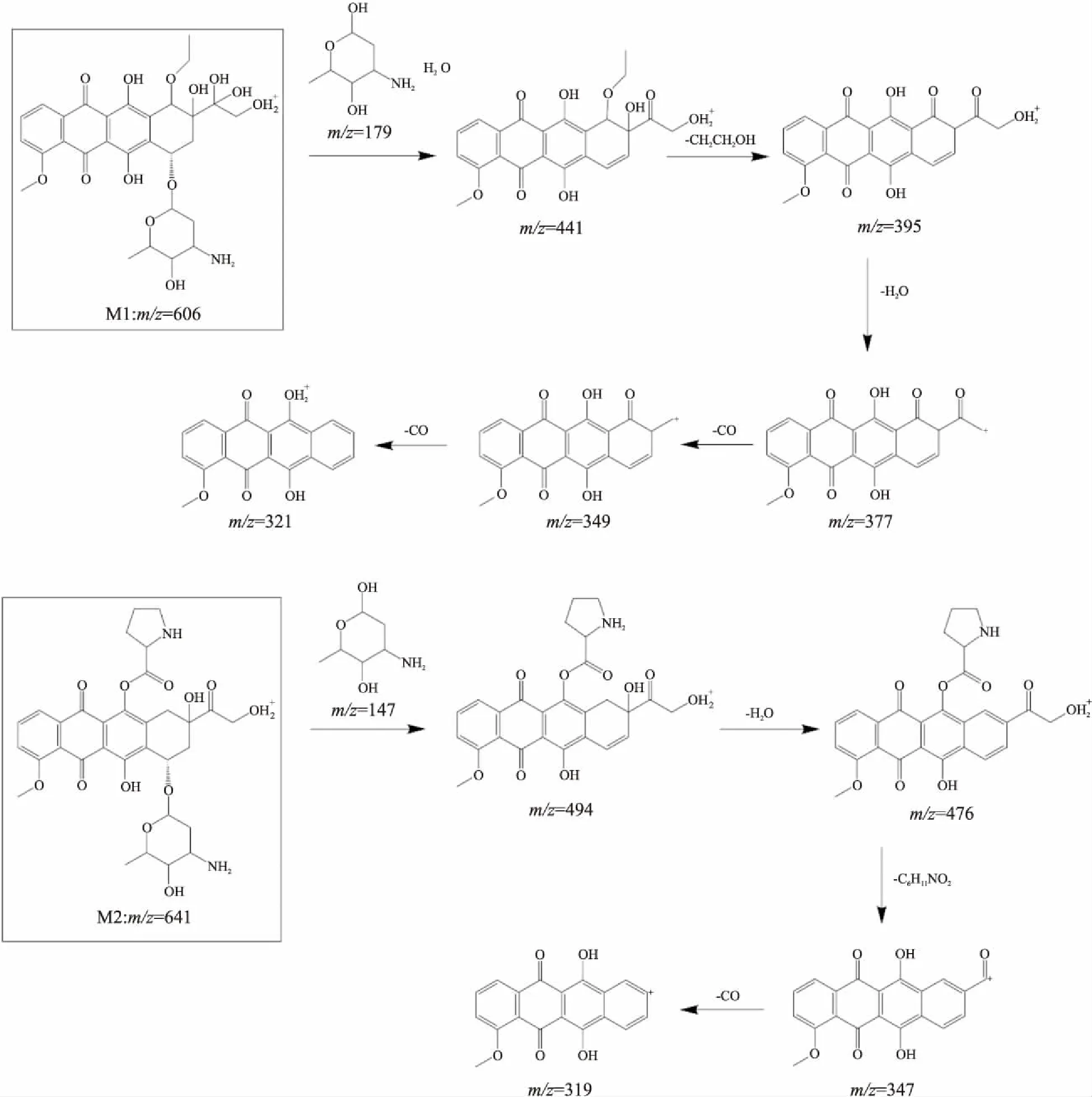
Fig 4 Fragmentation process and structure speculation of DOX and its metabolite M1(m/z=606) and M2(m/z=641)
3 討論
臨床使用中,阿霉素存在腫瘤細胞耐藥以及心臟毒性的問題[10]。有研究發現阿霉素在 MCF7/WT野生型細胞中主要定位于胞核,而在 MCF7/DOX耐藥細胞中則蓄積較少且主要定位于胞質[11]。核積聚的程度與這些細胞對阿霉素細胞毒性效應的敏感性直接相關。過去對阿霉素代謝的研究是基于肝臟的代謝,然而,很少見到靶細胞對阿霉素處置的研究報道。
本研究開發了一種靶細胞內微量代謝物的UPLC-Q-TOF-MS/MS分析方法,以鑒定靶細胞MCF-7耐藥細胞和敏感細胞中的阿霉素代謝物,試驗過程中未發現敏感細胞中的藥物代謝物,對于耐藥細胞中的阿霉素代謝產物,選用高分辨率多級質譜對其進行結構推導,發現了2個新的微量靶細胞阿霉素代謝物。新代謝物結構與體內藥代動力學研究報道不一致,而與Wang等[9]發現的靶細胞阿霉素代謝物相關聯,且質譜裂解過程具有共性,故推測靶細胞內的一系列相關代謝酶對阿霉素進行了修飾,而這些代謝過程與體內代謝途徑有差異。
通過多級質譜對代謝物進行結構解析,計算機模擬分子對接比較了阿霉素與其靶細胞代謝物和DNA的結合能力,相對于阿霉素,這兩個代謝物在DNA結合位點均呈現出一定程度偏離,且與DNA的親和力相比阿霉素有所下降,提示靶細胞可能對阿霉素進行了特殊修飾,使得阿霉素代謝為藥效更低的阿霉素代謝物,說明腫瘤靶細胞有獨特的藥物代謝途徑,尤其存在于阿霉素耐藥細胞中,可能與阿霉素的耐藥機制有關聯。

Fig 5 Molecular docking results of doxorubicin and its metabolites M1 and M2 with DNA
阿霉素體內生物轉化的主要途徑是由NADPH依賴性羰基(CBR)和醛酮(AKR)還原酶家族(統稱為羰基還原酶)介導的,這些酶催化阿霉素代謝物阿霉素醇(DOXOL)的形成[12]。根據目前的質譜推測結果,不同于體內代謝過程,腫瘤靶細胞內阿霉素代謝過程可能有羥甲基酶、羥基化酶及氨基酸代謝相關酶參與。羥基化酶已經在紅細胞、肝臟和腎臟中進行了廣泛的研究[13],但未見其在腫瘤靶細胞中的研究。有研究表明,miR-142-3p的過表達可能抑制自噬靶向高遷移率族蛋白1(HMGB1),增強乳腺癌細胞對阿霉素的化學敏感性[14]。本課題組已有研究利用構建藥物分子示蹤探針,在包含20 000多種人類蛋白的芯片上篩選阿霉素結合蛋白,統計得出401個阿霉素潛在作用靶點[15]。將這些潛在靶點與耐藥靶細胞阿霉素代謝物的代謝途徑相結合,進一步研究阿霉素與這些鑒定的細胞靶標的確切相關性及其藥理作用,就有可能從靶細胞藥物代謝途徑的角度解釋阿霉素耐藥機制,豐富對靶細胞對藥物處置的認識。
由于細胞代謝產物的復雜性、藥物代謝物含量低,很難分析和純化代謝產物。受限于現有UPLC-MS/MS分析技術的靈敏度,MCF-7敏感細胞中是否有類似的阿霉素代謝物產生尚不清楚,阿霉素代謝物的代謝途徑是耐藥細胞特有還是靶細胞固有還有待進一步研究。由于阿霉素的特殊蒽環結構使其和代謝物便于觀察,本研究針對阿霉素的靶細胞代謝物進行了研究,未來,我們還將使用基于阿霉素代謝物開發的方法來檢測其他抗腫瘤藥物的靶細胞代謝物,進一步完善方法學,使其成為可行和質量可控的方法,以補充現有藥理學研究方法。

