新冠肺炎疫苗的研發:機遇與挑戰
郭曉強
新冠肺炎(c o r o n a v i r u s d i s e a s e 2 01 9, COVID-19)的迅速蔓延,已對整個世界產生了難以估量的沖擊,目前來看仍未有明顯衰減的跡象。相對于其他傳染病,這次的COVID-19疫情在全球波及范圍更大、造成的損失更嚴重,成為人類進入21世紀后規模最大的一次流行病[1]。面對COVID-19,目前尚未研制出特效的治療藥物,只有寄希望于成功開發出有效疫苗,以解決當前近乎失控的疫情。
疫苗研發歷史
人類早期歷史就是同各類傳染病如天花、霍亂、鼠疫、結核、傷寒等進行殊死搏斗的歷史;傳染病也同戰爭、自然災害等一起,成為大規模人類死亡的重要原因。伴隨著一次次疫情的發生,國內外醫學界人士也在積極探索預防和治療之策。20世紀一系列抗生素的發現,一定程度上遏制了細菌性傳染病的勢頭。然而,病毒性傳染病則由于抗病毒藥物臨床療效不佳等問題,對其采取疫苗預防仍為首選策略。
很久以前,古希臘歷史學家就觀察到天花幸存者通常不會二次感染,隨后在古埃及、古印度和我國等,人們都觀察到此種現象,但真正將這一現象付諸實踐(疾病預防)則始于我國宋朝。當時采用“種痘”策略,就是將感染天花后痊愈患者結的痘痂干燥后取下,碾碎成粉,吹到健康人鼻孔里,使其獲得對天花的抵抗力,從而誕生了人類疫苗的雛形。這種方法后來被傳播到世界各地,但還存在諸多問題。最大的風險在于,采用活的人痘病毒,安全性差和風險性高(健康人種痘后反而患病)。
1796年,英國醫生琴納(E. Jenner)意外發現一種牛痘病毒,盡管也可使人致病但癥狀輕微,患者感染后可獲得對人天花病毒的免疫力(不再患天花),從而有效解決了安全性問題。牛痘疫苗的應用,標志著人類疾病預防進入了一個新時代,疫苗(vaccine)一詞即源自奶牛的拉丁語(vacca)。1880年代,法國微生物學家巴斯德(L. Pasteur)成功開發出狂犬病毒疫苗,一舉奠定現代疫苗學的理論基礎。
進入20世紀,疫苗開發的步伐加速,先后開發成功多種疫苗,如黃熱病毒疫苗(1935年)、流感病毒疫苗(1936年)、脊髓灰質炎疫苗(1955和1963年)、麻疹、腮腺炎和風疹聯合疫苗(1971年)、人乙肝重組疫苗(1986年)、人乳頭瘤病毒疫苗(1992年)等,成為人類抵御眾多致死性傳染病的重要保障[2]。
疫苗主要類型
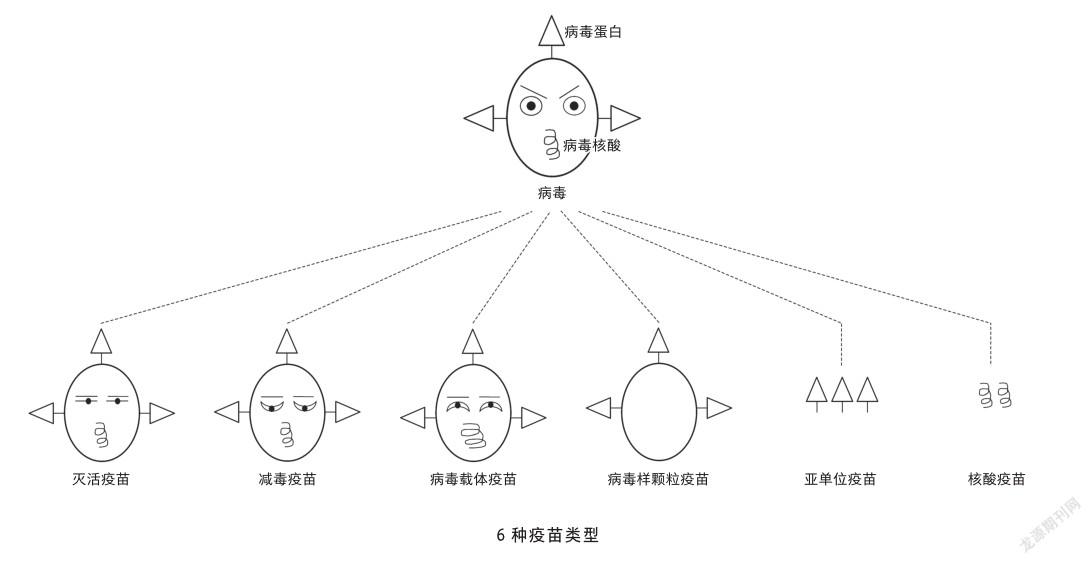
疫苗根據組成通常可分為6大類:滅活疫苗、減毒疫苗、病毒載體疫苗、病毒顆粒疫苗、亞單位疫苗和核酸疫苗[3]。前兩種為傳統疫苗,后面4種為新型疫苗。
滅活疫苗(inactivated vaccine)
采用完全失活的死病毒作為免疫材料。這一思想在18世紀末期由美國科學家薩爾蒙(D. Salmon)和史密斯(T. Smith)等提出,常見的如滅活脊髓灰質炎疫苗、早期流感疫苗和甲肝疫苗等。
減毒疫苗(attenuated vaccine)
疫苗制備材料為脫毒(或低毒)活病毒,通常采用化學處理或連續傳代以實現減毒目標。這一理念最初由巴斯德提出。此類疫苗包含天然減毒株,如牛痘疫苗(這種情況通常可遇不可求);化學脫毒,如最初的狂犬病疫苗;連續傳代脫毒,如麻疹疫苗和口服脊髓灰質炎疫苗等。
病毒載體疫苗(viral vector vaccine)
這是一種嵌合體疫苗,是用已被證實安全的病毒如腺病毒作為載體,將致病病毒的部分遺傳物質帶入體內,以激發人體的免疫應答。這種方法既可保證病毒完整性,又保證了疫苗安全性,目前用于人類免疫缺陷病毒疫苗等的研發。
病毒樣顆粒疫苗(virus-like particle vaccine)
病毒蛋白在體外進行組裝,產生類似病毒的結構。相對于單純的病毒蛋白,其免疫原性大大增強,從而可激發更強的免疫應答,起到保護人體的作用。人乳頭瘤病毒疫苗就是這種類型疫苗。
亞單位疫苗(subunit vaccine)
采用最能有效激發人體免疫應答的病毒成分(通常是蛋白質或糖蛋白)來制備疫苗。相對于完整病毒疫苗,其安全性高,操作性好,可利用基因工程方法進行制備。常用的人乙肝疫苗就屬于此類。
核酸疫苗(nucleic acid vaccine)
將編碼某種抗原蛋白的外源基因(DNA或RNA)借助脂質體納米顆粒攜帶進入宿主細胞,借助宿主細胞表達需要的抗原蛋白,誘導宿主產生對該抗原蛋白的免疫應答,達到預防和治療疾病的目的。這是一種新型疫苗,具有制備簡單,生產迅速,管理方便等諸多優點。至今尚無一種核酸疫苗被正式批準應用,但其諸多優勢得到了科學界和醫藥界的關注。
疫苗預防原理
預防性疫苗原理就是用一種無害或低害的物質提前處理,使機體獲得對特定病毒感染的抵抗能力。為實現這一目標,疫苗必須具備兩方面能力:一是特異性,二是免疫力[4]。
正常情況下,病毒感染宿主后會觸發先天性和適應性兩類免疫系統。先天性免疫系統(樹突細胞等)需要細胞表面模式識別受體(pattern recognition rece ptor, PR R)來識別病原體相關分子模式(pathogen-associated molecular pattern, PAMP)。病毒的PAMP是指病毒特有(宿主缺乏)、結構恒定且進化上保守的一類分子結構,如病毒核酸等。適應性免疫系統(包括T細胞和B細胞)通過識別病毒特定抗原被激活。因此,病毒進入機體后,先天性免疫系統首先判斷感染是否發生,確認后樹突細胞等會迅速聚集到淋巴結,進一步激活適應性免疫系統(如T細胞等)。
兩步免疫應答的特點為疫苗研發提供了設計思路。如減毒活疫苗本身就可激發機體強大且持久的抗病毒免疫應答,因此通常可單獨使用;而亞單位疫苗等新型疫苗則只利用抗原信息,因此只能產生弱化、短暫的應答,可通過補充免疫佐劑(adjuvant)來實現增強效應。免疫佐劑是指一類可增強機體特異性免疫應答能力的物質,常用的有鋁鹽、內毒素等。
疫苗的研發
一種新疫苗從最初研發到最終應用,通常需要經歷數年,至少要經過探索、臨床前、臨床試驗和批準等階段。疫苗批準投入使用后還須對疫苗生產、質量控制及不良反應等進行實時監管,以保障疫苗安全性。
探索階段
根據病原體類型和被感染靶器官等特征,確定疫苗類型。以新冠肺炎疫苗為例,目前大多數公司傾向于亞單位疫苗、病毒載體疫苗和核酸疫苗這些新型疫苗,因為這些疫苗相對而言生產簡單,可為大規模生產提供便利。但挑戰也顯而易見,那就是不確定性和風險性較大。
臨床前階段
對制備出的疫苗開展先期動物實驗,以初步確定保護效果和潛在毒性。新冠疫苗在該階段可選擇的動物有基因工程小鼠、倉鼠和恒河猴等。我國開發的一款新冠滅活疫苗臨床前試驗已獲理想結果,產生了大量病毒中和性抗體,并對動物產生了較強的保護作用[5],為進一步開展臨床試驗奠定了堅實基礎。
臨床試驗階段
這是整個研發過程的重中之重,疫苗只有經過嚴格臨床試驗,才可在公眾中應用。該階段通常又分為三期,即Ⅰ期臨床、Ⅱ期臨床和Ⅲ期臨床[6]。
Ⅰ期臨床
在一個小樣本群體(通常20~80名受試者)中進行,主要目的是初步評價疫苗的安全性和有效性(激發出各種免疫應答的類型和反應程度)。通過這些測試才可進入下一階段。
Ⅱ期臨床
在一個較大群體(通常幾百人)中開展,主要用于評價疫苗的安全性、免疫性、使用劑量、免疫程序和接種方法。
Ⅲ期臨床
在更大規模人群(數千甚至上萬人)中測試。該階段的試驗設計為隨機雙盲試驗:隨機地給一些受試者接種疫苗而對另一些受試者給予安慰劑(生理鹽水或者其他類型疫苗等)。這是臨床試驗中最關鍵的階段,首要目的仍是評估疫苗安全性。假定嚴重不良反應發生率為1/1000,則理論上需要6000名受試者才可能發現(其中接種疫苗的只有3000人)。如果要求不良反應發生率更低,則需進一步增加受試人數。之所以必須如此嚴謹,是因為疫苗與藥物不同,一方面疫苗更多地是給健康人用,另一方面疫苗受眾較廣。以1億人接種疫苗為例,按照1/1000不良率計算,最終也會有10萬人受到傷害。另一個需要確定的是保護效果,即與安慰劑組相比,疫苗組的感染率有多大程度的降低。
批準階段
當Ⅲ期臨床試驗結果達到疫苗要求時,可向衛生行政部門提出審批請求,通過后即可投入生產和應用。
監管階段
疫苗投入應用后,尚需進行嚴格監管,以保障其安全性。如建立疫苗不良事件報告系統,當發現疫苗產生新不良反應時,應及時采取應對措施,若情況足夠嚴重,則要召回疫苗。
新冠疫苗的研發
目前,全世界有近200種新冠疫苗正在研發中,幾乎涵蓋所有的疫苗類型[7],以期從中篩選到理想的疫苗,從而解當前仍在肆虐的新冠疫情燃眉之急。這里重點介紹幾種有潛力的疫苗[8]。
新冠肺炎核酸疫苗
該疫苗制備簡單,是目前研究進展最為迅速的疫苗,主要有以下幾種mRNA疫苗。
BNT162b1
這是由美國輝瑞公司和德國BioNTech等聯合開發的一款mRNA疫苗,主要成分為編碼新冠肺炎病毒刺突蛋白(S)受體結合區(receptor-binding domain, RBD)的mRNA。目前正在對4萬多名參與者進行Ⅲ期臨床試驗。在最近中期療效分析(尚未正式結束)中初步發現,其預防新冠肺炎有效率超過90%,并未發生嚴重不良反應,因此準備盡快提交申請,以求盡快進行大規模生產和免疫接種。該疫苗本身存在一個巨大的劣勢,就是對儲存條件苛刻,需要在-70℃下保存,這給運輸和接種帶來極大困難,因此尚需其他疫苗補充。
mRNA-1273
這是美國莫德納(Moderna)公司開發的一款mRNA疫苗,其成分是編碼刺突蛋白的mRNA。最近從3萬多人的Ⅲ期臨床試驗中也獲得鼓舞人心的結果。該疫苗對預防新冠肺炎的有效率達94.5%,且沒有嚴重不良反應,因此也有望獲得審批。該疫苗的一大優點是可在普通冰箱(2~8℃)保存一個月,在-20℃冰箱可保存半年,這一點遠優于輝瑞公司的疫苗。
ARCoV
這是由我國軍事醫學科學院聯合多家單位聯合研發的國內第一款mRNA疫苗,也采用刺突蛋白作為病毒抗原,目前正開展臨床試驗。
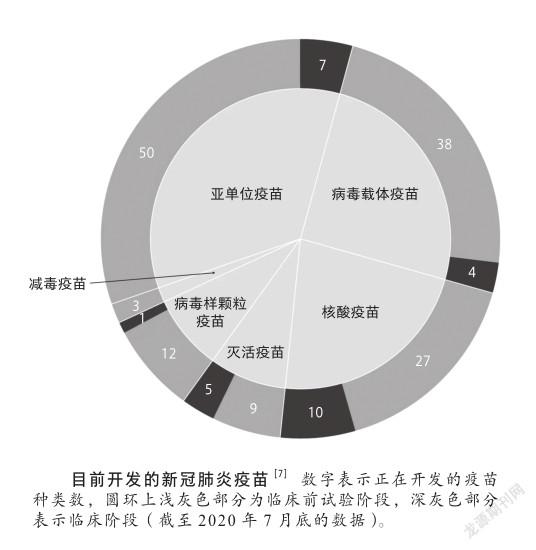
新冠病毒亞單位疫苗
這是目前開發最多的一類,已超過50多種。
NVX-CoV2373
這是由美國諾瓦瓦克斯(Novavax)公司開發的一種蛋白質亞單位疫苗,使用S蛋白(采用基因工程方法制備)作為抗原,目前已進展到臨床Ⅲ期。從前期實驗結果看,可有效激發機體的抗病毒反應,但有一定比例的不良反應,最終結果目前尚無法評判[9]。
SCB-2019
這是由英國葛蘭素史克等公司聯合開發的一種蛋白質亞單位疫苗,采用S蛋白三聚體作為抗原,目前正在臨床試驗中。
COVID-19 vaccine
這是中國醫學科學院和安徽智飛龍科馬生物制藥有限公司聯合開發的蛋白質亞單位疫苗,采用RBD二聚體作為抗原,目前正在臨床實驗中。
病毒載體疫苗
這類疫苗也有多家公司在積極開發。
Ad26.COV2-S
這是美國強生公司開發的一種腺病毒載體疫苗,使用S蛋白作為抗原,目前在Ⅲ期臨床。
Ad5-nCoV
這是由我國北京生物技術研究所和康希諾生物公司聯合研制的腺病毒載體疫苗,也使用S蛋白作為抗原,已進入Ⅲ期臨床。
新冠病毒滅活疫苗
這類疫苗正在我國多家單位的研制中,包括中國醫藥集團、北京科興生物制品有限公司、北京生物制品研究所、武漢生物制品研究所、中國醫學科學院等。目前,相關疫苗如BBIBP-CorV、PiCoVacc等,大多已進展到Ⅲ期臨床[10]。從臨床前、Ⅰ期和Ⅱ期臨床試驗結果來看,具有較高的安全性和有效性,假以時日也有望被批準應用。
考慮到新冠肺炎首次出現,人群缺乏免疫力,因此理論上需兩次接種(一般間隔3~4周),在第二次接種1~2周后,人體開始獲得對新冠肺炎病毒的免疫力。
挑 戰
雖然近期新冠肺炎疫苗臨床試驗傳來一系列好消息,但在后續大規模應用中仍存在諸多挑戰。
首先是疫苗安全性。由于新冠疫情的緊迫性,因此疫苗研發進入了超快通道。正常情況下,一種疫苗研發周期為15年甚至更長,而新冠疫苗的研發估計在10個月到一年半時間內完成[10],勢必在疫苗安全性上存在較大隱患。新冠疫苗即使被批準應用,也應有嚴格的監管機制。在出現嚴重不良反應后,要及時進行針對性治療或采取緊急召回等措施。
其次是疫苗有效性。盡管大家對疫苗都抱有極大希望,但最終大規模應用后的效果如何尚難預測。就當前研發的疫苗而言,它們主要通過肌肉或皮下注射的方式進行接種,這些方法通常只激活下呼吸道部位的免疫(全身免疫應答),而無法激活上呼吸道保護(黏膜抗體應答),因此最終可能只達到部分保護或減弱感染的效果,而無法起到消除病毒傳播的作用。
第三是疫苗生產力。小規模或常規性應用的疫苗(如HPV),生產壓力相對較小,而大規模或緊急性應用的疫苗(如流感、新冠等),目前的生產力有點捉襟見肘。按照每人兩次免疫計算,全球有100多億的需求量。即使全世界疫苗生產企業開足馬力生產,短期內供應全球的疫苗量也是一項巨大挑戰。
第四是疫苗價格。即使疫苗安全、有效,并能足量供應,價格也會成為另一挑戰。疫苗研發和生產過程需要巨大投入,僅僅是收回成本,也會造成疫苗價格不菲,如果考慮盈利,那價格就更加高昂了。誠然,部分富裕國家可通過財政補貼使該問題得到適當解決,但在不發達地區,這個問題就顯得極為棘手。
第五是公眾心理。再安全的疫苗都無法保證萬無一失,因此,許多公眾從內心深處具有排斥心理,擔心注射疫苗會帶來不良后果,從而拒絕注射。如果少量人群拒絕,由于群體免疫效應,尚可取得抑制疾病傳播的效果,但如果過多人不接受疫苗免疫,就蘊含較大風險,這也是一個較為棘手的問題。
新冠疫苗研發是人類控制新冠疫情的重要希望所在,曙光已經顯露,挑戰仍需面對。
[1]Morens D M, Fauci A S. Emerging pandemic diseases: How we got to COVID-19. Cell, 2020, 182(5): 1077-1092.
[2]Plotkin S. History of vaccination. Proc Natl Acad Sci USA, 2014, 111(34): 12283-12287.
[3]Ada G. Vaccines and vaccination. N Engl J Med, 2001, 345(14): 1042-1053.
[4]Iwasaki A, Omer S B. Why and how vaccines work. Cell, 183(2): 290-295.
[5]Gao Q, Bao L, Mao H, et al. Development of an inactivated vaccine candidate for SARS-CoV-2. Science, 2020, 369(6499): 77-81.
[6]Han S. Clinical vaccine development. Clin Exp Vaccine Res, 2015, 4(1): 46–53.
[7]Poland G A, Ovsyannikova I G, Crooke S N, et al. SARS-CoV-2 vaccine development: Current status. Mayo Clin Proc, 2020, 95(10): 2172-2188.
[8]Jeyanathan M, Afkhami S, Smaill F, et al. Immunological considerations for COVID-19 vaccine strategies. Nat Rev Immunol, 2020, 20(10): 615-632.
[9]]Krammer F. SARS-CoV-2 vaccines in development. Nature, 2020, 586(7830): 516–527.
[10]Dong Y, Dai T, Wei Y, et al. A systematic review of SARS-CoV-2 vaccine candidates. Signal Transduct Target Ther, 2020, 5(1): 237.
關鍵詞:新冠肺炎 疫苗 臨床試驗 核酸疫苗 ■

