腦淀粉樣血管病相關炎癥1例附文獻分析
師虹艷 馬彤艷 李智申 周貴福
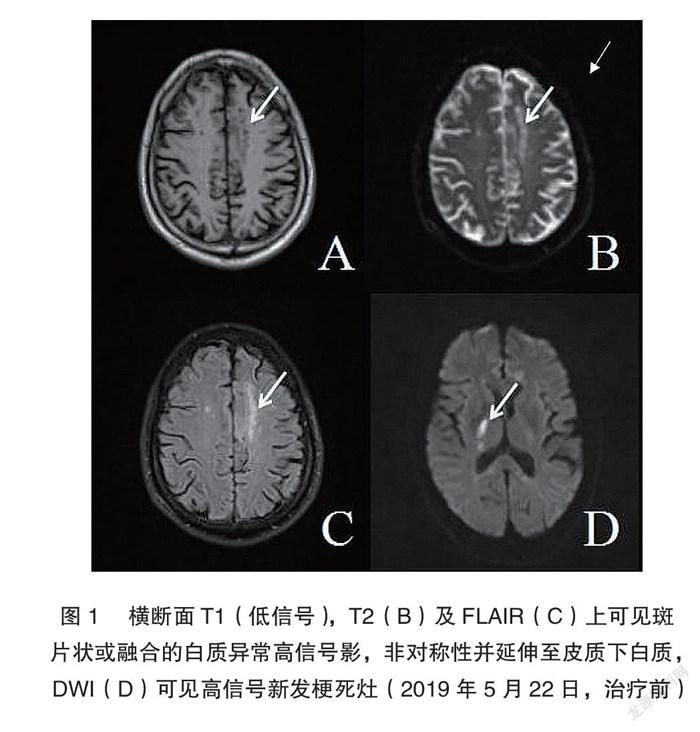


[摘要]目的探討腦淀粉樣血管病相關炎癥的臨床表現、血清及影像學檢查、診斷、治療及預后。方法選取2019年1月20日1例中年男性腦淀粉樣血管病相關炎癥患者,臨床表現以認知行為異常、步態異常、人格改變等為主要特征。結果腦脊液生化:腦脊液總蛋白0.36 g/L,自身免疫系列、自身免疫性腦炎相關指標等檢查未見異常。頭顱 MRI:T2WI 及 FLAIR 上可見斑片狀或融合的白質異常高信號影,非對稱性并延伸至皮質下白質。磁敏感加權成像(SWI)提示≥1處皮質-皮質下微出血灶。診斷為很可能的腦淀粉樣血管病相關炎癥,給予甲潑尼龍沖擊療法,人免疫球蛋白序貫療法,硫唑嘌呤后續療法。結論甲潑尼龍沖擊療法后臨床出現戲劇性效果;人免疫球蛋白靜點治療后近期效果不明顯;除認知行為異常、步態異常等臨床表現外,精神人格改變,如被迫害妄想、幻聽幻視也是該病常見臨床表現;出院后持續口服硫唑嘌呤及醋酸潑尼松,病情進一步好轉中。
[關鍵詞]腦淀粉樣血管病相關炎癥;腦梗死;認知功能減退;磁共振圖像
[中圖分類號] R743 [文獻標識碼] A? [文章編號]2095-0616(2021)22-0223-05
Cerebral amyloid angiopathy-related inflammation: a case report with literature analysis
SHI? Hongyan?? MA? Tongyan?? LI? Zhishen?? ZHOU? Guifu
Department of Neurology, Traditional Chinese Medicine Hospital of Shijiazhuang City, Hebei, Shijiazhuang 050000,China
[Abstract] Objective To discuss the clinical manifestations, serology and imaging examinations, diagnosis, treatment and prognosis of cerebral amyloid angiopathy-related inflammation(CAA-ri). Methods A middle-aged male patient diagnosed with CAA-ri on January 20, 2019 was selected. The clinical manifestations were mainly featured by abnormal cognitive behavior, abnormal gait, and personality changes. Results For cerebrospinal fluid biochemistry, with cerebrospinal fluid total protein of 0.36 g/L, autoimmune disease series, autoimmune encephalitis related indicators and other examinations showed no abnormalities. For brain MRI, patchy or fused white matter hyperintensities could be seen on T2WI and FLAIR which was asymmetric and extended to the subcortical white matter. Sensitivity-weighted imaging (SWI) revealed ≥1 foci of cortical-subcortical microhemorrhage. The patient was diagnosed with probable CAA-ri, and was given methylprednisolone pulse therapy, sequential therapy of human immunoglobulin followed by azathioprine treatment. Conclusion Methylprednisolone pulse therapy shows dramatic clinical effects. The intravenous injection of human immunoglobulin shows no obvious short-term effect. In addition to the clinical manifestations of abnormal cognitive behavior and gait, changes in mental personality, such as persecutory delusions, auditory and visual hallucinations, are also common clinical manifestations of the disease. After discharge, with continuous oral administration of azathioprine and prednisone acetate, his condition is further improved.
[Key words] Cerebral amyloid angiopathy-related inflammation; Cerebral infarction; Cognitive impairment; Magnetic resonance imaging
腦淀粉樣血管病(cerebral amyloid angiopathy,CAA)相關炎癥(CAA-related inflammation, CAA-ri)也稱為β淀粉樣蛋白(Aβ)相關性血管炎,是一種罕見、潛在、可逆性腦病,臨床通常表現為急性或亞急性起病,以進行性認知-行為功能下降為主,伴隨典型腦病癥狀,如局灶性神經功能缺損癥狀,頭痛、癲癇等,其男女發病率基本相同,且一般發病年齡≥40歲,治療上主要以激素沖擊療法、免疫調節等為主。
1臨床資料
1.1病例摘要
患者男性,55歲,主因反復肢體活動不利伴認知行為異常4月余,加重2 d,于2019年5月22日入院。患者2019年1月20日突然出現右下肢活動不利,站立不穩,腳下踩空感,行走困難,伴隨言語不利、神情木訥,后于當地醫院以“腦梗死”住院治療17 d 后患者下肢活動不利癥狀緩解,可自行緩慢行走,遺留言語不利。2019年4月21日患者再次出現左側肢體活動不利,行走不穩,腳下踩棉花感,左手握力差,記憶力下降、行為反常,有強迫行為,如反復洗手、反復沖廁所等,不識方向,再次就診于當地醫院,以“腦梗死”住院治療,經積極治療19 d 后患者遺留左側肢體活動欠靈活、蹣跚步態、言語不利、認知能力下降明顯。2019年5月20日突然出現左側肢體活動不利癥狀較前加重,左手握力差,尚可自行行走,反應遲鈍較前加重,收住我科。既往“高血壓病”“慢性粒細胞性白血病”病史,否認手術、外傷史,否認肝炎、肺結核等傳染病史,無特殊嗜好史,否認冶游史,否認毒麻藥使用史,否認相關性家族遺傳病史。
1.2體格檢查
體溫36.5℃,心率75次/min,呼吸21次/min,血壓144/85 mmHg,心肺腹查體未見異常,神志清楚,反應遲鈍,表情呆滯,雙側瞳孔正大等圓,直徑約3 mm,對光反射靈敏,雙眼球各方向運動充分,空間定向力不完整,人物、時間定向力相對完整,近期記憶力顯著減退,遠期記憶力近乎完整,計算力減退(100-7-7=?),言語不利,伸舌向左偏斜,左上肢肌力Ⅳ級,左下肢肌力Ⅲ級,右側肢體肌力Ⅴ級,左側肢體痛溫覺減退,右側肢體痛溫覺正常,雙側肱二、三頭肌腱、雙膝腱、雙跟腱反射正常存在,雙側 Babinski 征陽性。
1.3實驗室檢查
血常規、生化指標、凝血五項、男性腫瘤標志物、甲功七項、免疫學檢查均在正常范圍。腦脊液檢查:腦脊液壓力180 mmH2O。無色透明。腦脊液生化:腦脊液總蛋白0.36 g/L、腦脊液葡萄糖4.37 mmol/L、腦脊液氯化物126.7 mmol/L。腦脊液常規:外觀無色透明,蛋白定性(-),有核細胞數23.00×106/L,單核細胞百分比為65%,多核細胞百分比為35%。自身免疫性腦炎七項、中樞神經系統脫髓鞘疾病抗體譜、水通道蛋白測定(結果由北京大學第一醫院于2019年6月3日回報),未見異常。
1.4影像學檢查
頭顱平掃+DWI+顱內血管:雙側基底節區、雙側丘腦、雙側額深及右側頂深腦梗死,右側基底節區為新發病灶,側腦室旁白質區、放射冠缺血變性改變(圖1)。
至此,根據患者輔助檢查及臨床癥狀,定位1.雙側皮質脊髓、腦干束;2.左側脊髓丘腦束;3.廣泛腦實質。定性為1.腦梗死?2.血管炎?3.脫髓鞘改變?4.非特異性炎癥?給予雙抗、建立側支循環、改善缺血半暗帶等治療。鑒于患者頭顱 MRI 提示廣泛脫髓鞘改變,需除外自身免疫性、風濕性血管炎、原發性中樞神經系統血管炎(primary angiitis of the centralnervoussystem, PACNS)等。
患者于2019年5月23日出現左下肢活動不能,左手拳握不能,反應遲鈍、認知能力顯著下降,行為反常,強迫動作,查左下肢肌力0級,左上肢肌力Ⅲ級,余查體同前。根據患者病情特點:①5個月內反復3次卒中樣發作;②進行性的認知功能下降;③ T2WI 及 FLAIR 提示廣泛脫髓鞘改變,至此基本除外自身免疫、風濕性血管炎、PACNS 等,不除外 CAA-ri的可能。查腦電圖:清醒閉目狀態下右側枕區偶見3~5 Hz 慢波活動,持續時間約8 s,輕度異常腦電圖。認知量表:蒙特利爾認知評估量表(MoCA)評分為22分(總分26分),認知能力低于正常水平。頭顱 SWI:右側頂枕交界、左側額葉皮層及皮層下多發點狀無信號影,考慮點狀微出血(圖2)。
結合患者病史、體征及輔助檢查,根據 Chung 等[1]基于72例 CAA-ri患者的臨床癥狀、體征修訂的“很可能的 CAA-ri”診斷標準:(1)急性或亞急性病程;(2)年齡≥40歲;(3)存在≥1項以下臨床表現:頭痛、意識水平下降、行為改變、局灶性神經體征、癲癇等;(4)MRI 提示單發或多發白質高信號病灶,非對稱性并延伸至皮質下白質;非對稱性病灶并非既往腦出血所致;(5)SWI 存在≥1處皮質或皮質下出血性病灶,包括腦出血、腦微出血、皮質表面鐵沉積;腦微出血診斷標準[2]為:① T2WI 上低密度信號缺失灶;②圓形或卵圓形;③邊界清晰;④常規 T1T2序列較難顯示;⑤病灶至少有1/2被腦實質環繞;⑥臨床病史除外腦外傷所致彌漫性軸索損傷;⑦除外其他具有相似影響學表現情況(如鈣化、海綿狀血管瘤、小血管流空影等)。(6)排除腫瘤、感染及其他原因;(7)病理證實以下兩點:①有血管周圍或血管內炎癥;②皮質或軟腦膜 Aβ沉積。滿足(1)~(6),可診斷為很可能的 CAA-ri;滿足(1)~(6)任意一條以上+(7)即可確診為 CAA-ri[3]。本患者除頭痛外符合診斷標準,臨床很可能的 CAA-ri診斷成立。
1.5診治經過
2019年5月28日晚21:30給予甲潑尼龍
(Pfizer Manufacturing Belgium NV,進口藥品注冊證號 H20170197,藥品準字:JX20160069,規格:40 mg)1 g/d 沖擊免疫調節治療,于2019年5月28日晚23:00臨床出現戲劇性改變,患者左下肢可抬離床面,左上肢活動較前靈活,2019年5月29日清晨患者在家人攙扶下可緩慢行走、言語流利、反應敏捷、定向力理解力認知能力均改善,2019年5月30日晨起患者出現幻覺、自言自語,約2 min 后意識狀態恢復正常,對答、反應尚可。甲潑尼龍具體用法為第1日至第5日1 g/d,第6日至第8日0.5 g/d,后改為醋酸潑尼松(哈藥集團制藥四廠,國藥準字 H23020185,規格:5 mg)60 mg/d 口服,以每2日減少5~10 mg,至6月12日減至20 mg/d 口服維持,于6月24日出現被迫害妄想癥,復查頭顱 MRI 平掃+DWI:雙側基底節區、雙側丘腦及左側額葉病變較前明顯減輕,左側額深較新點狀高信號病灶(圖3)。患者病情反復,靜點人免疫球蛋白,以0.4 g/kg(30 g/d),連續靜點5 d 后臨床近期效果不明顯。患者出院后持續口服醋酸潑尼松20 mg/d,硫唑嘌呤(上海上藥信誼藥廠有限公司,國藥準字 H31021422,規格:50 mg)2 mg/(kg ·d),持續口服3個月。
2討論
CAA-ri是近年逐漸被認知的散發性 CAA 的一種臨床病理綜合征,是一種罕見、潛在、可逆性腦病[4],發病機制尚未完全明確,目前多數認為是β淀粉樣蛋白(Aβ)沉積于軟腦膜及腦血管壁而導致的炎癥反應[5]。臨床特點類似于中樞神經系統血管炎,表現為急性或亞急性起病,發病年齡≥40歲,男女發病幾率基本相同,主要表現為進行性認知-行為功能下降(75.7%),其次為局灶性神經功能缺損(45.7%),如步態異常、肢體抬舉無力、頭痛(41.4%)、癲癇(31.4%)等[1,6],影像學表現為在 T2WI 及 FLAIR 上可見斑片狀或融合的白質異常高信號影,可伴水腫,非對稱性并延伸至皮質下白質[7]。SWI 提示≥1處皮質-皮質下微出血灶。腦脊液檢查多提示蛋白含量升高,淋巴細胞多處于正常范圍內。在基因學研究領域,目前認為載脂蛋白(Apo)E 是唯一確定的散發 CAA 的基因危險因素[8],由ε2、ε3、ε4三種基因編碼參與 Aβ的轉運,且三種等位基因對 Aβ的轉運率不同。研究表明,CAA-ri患者中ApoEε4基因攜帶率高達80%,而無炎癥反應的 CAA 中ApoEε4基因攜帶率僅為5%[9],ApoEε4一方面促進 Aβ沉積于血管,另一方面降低血管周圍間隙 Aβ的清除率,從而實現淀粉樣蛋白的沉積[4],引起血管內炎癥和血管周圍炎癥,前者表現為肉芽腫性炎癥,即真性血管炎,后者主要表現為血管周圍巨噬細胞、淋巴細胞等炎癥細胞浸潤,而無明顯血管破壞。基于這一研究,部分學者提出,在某些特定的情況下,若 SWI 提示皮層下多發微出血灶,基因檢測提示為ApoEε4/ε4,即使無活檢,也可診斷為“CAA-ri”[10]。Charidimou A 提出在 CAA 與 CMB(cerebral microbleeds)、CSS(cortical superficial siderosis)之間關系,在 CAA 及 CMB 時更易有 CSS,其基因檢測大多為 APOEε2型基因型。二者將增加腦出血的風險,相反,APOEε4等位基因的 CAA 患者,更少出現 CSS 或 ICH(intracerebralhemorrhage)[11]。同時亦有研究證實, APOEε4/ε4純合基因型在伴有 CSS 中過度表達,考慮與 CAA 發病相關[2]。Fanny M 等提出ε2、ε4是 CAA、自發性腦出血、腦淀粉樣相關性腦出血的重要危險因素,尤其在白種人多見,且提出ε2可改變血管壁結構使顱內易出血[12-16]。在自身免疫抗體研究領域,β淀粉樣蛋白沉積時易誘發自身免疫反應[17],在 CAA-ri急性期,抗-Aβ自身抗體特異性增高,且直接與 Aβ蛋白活動有關,與增加的 tau 蛋白和 P181tau 一起參與疾病的發生,隨著疾病的好轉該抗體逐漸接近正常[18]。根據這一研究提出,若在腦脊液中檢測出高濃度抗-Aβ自身抗體,結合臨床癥狀及放射學檢查,基本可診斷 CAA-ri。在腦脊液檢查可見高濃度抗-Aβ抗體聚集,隨著癥狀緩解, Aβ抗體可降至正常水平,證實了 CAA-ri的自身免疫炎癥機制[19]。Liang 等[11]報道了1例未伴有腦微出血及大面積腦組織病變的患者,其腦組織活檢支持 CAA-ri診斷,并進一步提出,在 CAA-ri確診患者中,若不伴有微出血或大面積腦組織病變,其預后相對較好。針對腦組織活檢可誘發短暫或長久的致命并發癥,Du 等[20]提出可能的 CAA-ri診斷標準,即在原有診斷標準基礎上加上在沒有急性腦出血而頭痛的患者、無既往病史癥狀的腦白質變性,且無既往腦出血,即可明確診斷 CAA-ri。
本病目前診斷基于“很可能的 CAA-ri”診斷標準,符合該標準即可行大劑量激素沖擊治療,但若高劑量激素治療3周無反應時可考慮活檢[9]。本病常需要與自身免疫性腦炎、常染色體顯性遺傳性腦動脈病伴皮層下梗死和白質腦病(cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy,CADASIL)等鑒別。自身免疫性腦炎病變部位常為一側或雙側顳葉,腦脊液檢查提示白細胞增多(≥5×106/L),或淋巴細胞性炎癥或寡克隆區帶陽性,臨床表現以精神行為異常、認知障礙、近記憶力下降、癲癇發作為主要特征。影像學提示雙側或單側顳葉內側異常信號,或無明顯異常。腦電圖提示輕度彌漫性慢波或雙側額顳葉慢波。而 CADASIL 病變部位為側腦室旁、半卵圓中心及顳極,基因檢測提示 Notch3基因突變,為家族遺傳疾病,臨床以反復卒中、認知功能下降、精神癥狀及偏頭痛等癥狀為主,影像學提示對稱性彌漫性大腦半球皮質下長 T1長 T2信號,顳極白質 T2異常高信號為特征。腦電圖多無異常改變。本病對激素治療敏感,最常用的藥物是皮質類固醇激素、甲氨蝶呤,必要時可靜點免疫球蛋白。本例患者臨床特點:①不僅表現為進行性認知-行為功能下降、步態異常,還出現人格精神癥狀,如強迫行為,反復洗手、沖廁所,幻視幻聽等;②在治療方面,大劑量甲潑尼龍沖擊治療后有戲劇性療效,患者的認知行為、肢體活動較前明顯改善;③激素沖擊治療后20 d 復查頭顱 MRI 在 DWI 成像上左側額深部側腦室旁出現較新點狀高信號新發病灶;④靜點人免疫球蛋白后近期效果不明顯;⑤患者出院后持續口服硫唑嘌呤2 mg/(kg ·d)、醋酸潑尼松20 mg/d 治療,目前患者已停藥,患者肌力、認知功能已恢復,且目前未再出現腦梗死。CAA-ri在國內報道罕見,臨床醫師容易誤診漏診,本病例分析旨在及時診斷、早期治療,避免臨床出現癱瘓、梗死進一步增大及出血轉化等不可預知病情變化。
[參考文獻]
[1]Chung KK,Anderson NE,Hutchinson D,et al.Cerebralamyloidangiopathy related inflammation: Three case reports and a review[J].J NeurelNeurosurg Psychiatry,2011,82(1):20-26.
[2]Charidimou A,Ni J,Martinez-Ramirez S,et al.Cortical superficial siderosis in memory clinic patients: Further evidence for underlying cerebral amyloid angiopathy[J]. Cerebrovasc Dis,2016,41(3-4):156-162.
[3]杜燁,章殷希,丁美萍.腦淀粉樣血管病相關炎癥的臨床研究進展[J].中華醫學雜志,2015,95(25):2039-2041.
[4]鄧偉平,劉建榮.腦淀粉樣血管病研究現狀及相關認知功能損害的特點[J].內科理論與實踐,2017,12(6):405-409.
[5]張瀟怡.腦淀粉樣血管病相關炎癥研究進展[J].中華老年心腦血管病雜志,2016,18(11):1230-1232.
[6]Reijmer YD,van Veluw SJ,GreenberSM.Ischemic brain in-jury in cerebral amyloid angiopathy[J].J Cereb Blood Flow Metab,2016,36(1):40-54.
[7]Martucci M,Sarria S,Toledo M,et al.Cerebral amyloid angi-opathy-related inflammation: Imaging findings and clinicalotcome[J].Neuroradiology,2014,56:283-289.
[8]Montanola A,de Retana SF,Lopez-Rueda A,et al.ApoAl. ApoJ and ApoE plasma levels and genotype frequencies in cerebral amyloid angiopathy[J].Neuromolecular Med,2016,18(1):99-108.
[9]康遠程,魏文石.腦淀粉樣血管病相關炎癥反應的研究進展[J].中國臨床神經科學,2015,23(6):697-701.
[10]Savoiardo M,Erbetta A,Storchi G,et al.Case 159: Cerebral amyloid angiopathy-related inflammation[J]. Radiology,2010,256(1):323-327.
[11]Liang JW,Zhang W,Sarlin J,et al.Case of cerebral amyloid angiopathy-related in?ammation-is the absence of cerebral microbleeds a good prognostic sign?[J].J Stroke Cerebrovasc Dis,2015,24(11):e319-322.
[12]Tzourio C,Arima H,Harrap S,et al.APOE genotype, ethnicity, and the risk of cerebral hemorrhage[J]. Neurology,2008,70(16):1322-1328.
[13]Marini S,Crawford K,Morotti A,et al.Association of apolipoprotein E with intracerebral hemorrhage risk by race/ethnicity: A meta-analysis[J].JAMA Neurol,2019,76(4):480-491.
[14]Rannikmae K,Kalaria RN,Greenberg SM,et al.APOE associations with severe CAA-associated vasculopathic changes: Collaborative meta-analysis[J].J Neurol NeurosurgPsychiatr,2014,85(3):300-305.
[15]Rannikmae K,Samarasekera N,Martinez-Gonzalez NA,et al.Genetics of cerebral amyloid angiopathy: Systematicreview and meta -analysis[J].J Neurol NeurosurgPsychiatr,2013,84(8):901-908.
[16]Fanny M.Elahi.A Case of Cerebral Amyloid Angiopathy- Related Inflammation With the Rare Apolipoproteinε2/ε2 Genotype[J].Frontiers in Neurology,2019,547:1-4.
[17]Kirshner HS,Bradshaw M .The inflammatory form of cerebral amyloid angiopathy or "cerebral amyloid angiopathy-relaed inflammation"(CAARI)[J].J Curr Neurol Neurosei Rep,2015,15(8):54.
[18] Fabrizio Piazza, Steven M Greenberg, Mario Savoiardo, et al. Anti-Amyloid b Autoantibodies in cerebral Amyloid Angiopathy - Related Inflammation: Implications for Amyloid-Modifying Therapies[J].J ANNALS of Neurology,2013,73(4):449-458.
[19]Boneoraglio GB,Piazza F,Savoiardo M,et al.Prodromal Alzheimer's disease presenting as cerebral amyloid angiopathy-relaed inflammation with spontaneous amyloidrel at ed imaging abnormalities and high cerebrospinal fluid anti -Aβautoantibodies[J].J Alzheimers Dis,2015,45(2):363-367.
[20]Y Du, C Liu,C Ma, et al.Cerebral amyloid angiopathy-related inflammation: A case report presenting with a rare variant in SORL1 gene[J].BMC Neurology,2019,19(1):97.
(收稿日期:2021-05-10)

