淫羊藿-五味子藥對治療非酒精性脂肪肝機制的網絡藥理學研究
宋昌梅 杲春陽 付燕來 張晉 陳寶貴
摘要 目的:基于網絡藥理學探討淫羊藿-五味子藥對治療非酒精性脂肪肝的作用靶點及機制。方法:通過中藥系統藥理學數據庫與分析平臺(TCMSP)、中醫藥綜合數據庫(TCMID)獲取淫羊藿和五味子的化學成分和靶點,并構建成分-靶點網絡,其中化學成分的篩選條件為口服生物利用度(OB)≥30%和類藥性(DL)≥0.18。通過GenCards和OMIM數據庫篩選出淫羊藿-五味子治療非酒精性脂肪肝的潛在作用靶點。利用Cytoscape軟件構建疾病-成分-靶點之間網絡圖,進一步進行基因本體(GO)富集分析和京都基因和基因組百科全書(KEGG)富集分析。結果:共篩選出藥效成分31個,藥物與疾病作用交集靶點69個,涉及109條通路,顯示“淫羊藿-五味子”可能通過作用于IL6、AKT1、CXCL8等關鍵靶點,主要參與轉錄正調控DNA模板、免疫應答、細胞對腫瘤壞死因子的反應等生物學過程,從而調節AGE-RAGE、NAFLD等通路,達到治療作用。結論:通過中藥網絡藥理學,初步探討出“淫羊藿-五味子”治療非酒精性脂肪肝的作用機制,為下一步實驗驗證提供基礎。
關鍵詞 淫羊藿-五味子;溫陽化氣;非酒精性脂肪肝;經驗藥對;作用機制;靶點;通路;網絡藥理學
Abstract Objective:To explore the action target and mechanism of drug pairs Herba Epimedii-Fructus Schisandrae Chinensis in the treatment of nonalcoholic fatty liver based on network pharmacology.Methods:The chemical components and targets of Herba Epimedii-Fructus Schisandrae Chinensis were obtained from TCMSP and TCMID databases,and the component-target network was constructed.Among them,the screening conditions of chemical components were oral bioavailability (OB)≥30% and drug-like properties (DL)≥0.18.The potential targets of Herba Epimedii-Fructus Schisandrae Chinensis in the treatment of non-alcoholic fatty liver were screened through GenCards and OMIM databases.Cytoscape software was used to construct a network diagram between disease-components-targets,and we further performed gene ontology (GO) enrichment analysis and Kyoto Encyclopedia of Genes and Genomes (KEGG) enrichment analysis.Results:A total of 31 efficacy components,69 drug and disease intersection targets,involving 109 pathway,were obtained,showing that Herba Epimedii-Fructus Schisandrae Chinensis may works by acting on vital targets such as IL6,AKT1,CXCL8.They mainly involved in the transcriptional positive regulation of DNA template,immune response,cell response to tumor necrosis factor and other biological processes,thereby regulating AGE-RAGE,NAFLD and other pathways to achieve therapeutic effects.Conclusion:This study preliminarily explores the mechanism of drug pairs Herba Epimedii-Fructus Schisandrae Chinensis in the treatment of non-alcoholic fatty liver through the pharmacology of traditional Chinese medicine network,to provide a basis for the next step of experimental verification.
Keywords Herba Epimedii-Fructus Schisandrae Chinensis; Warm yang to form qi; Nonalcoholic fatty liver disease; Experiential couplet medicinals; Mechanism of action; Target; Pathways; Network pharmacology
中圖分類號:R285;R575文獻標識碼:Adoi:10.3969/j.issn.1673-7202.2021.14.002
非酒精性脂肪肝(Non-alcoholic Fatty Liver Disease,NAFLD)是與胰島素抵抗等密切相關的代謝應激性肝損傷疾病,與2型糖尿病、肥胖、心血管疾病有密切關系[1-2]。研究表明,NAFLD已成為我國第一大慢性肝病和健康體檢肝臟生物化學指標異常的首要原因,但目前臨床尚缺乏療效確切的防治藥物[3]。中醫學從癥狀、病因病機等方面將非酒精性脂肪肝歸屬于“積證”“痰證”等范疇[4],病性屬本虛標實,本虛為陽氣不足,標實涉及氣滯、痰濕、瘀血等。《金匱要略》載“病痰飲者,當以溫藥和之”,溫陽化氣是非酒精性脂肪肝重要的治療思路[5-6]。五味子-淫羊藿是陳寶貴教授臨床常用的溫陽化氣、調補脾腎的經驗藥對[7],淫羊藿溫腎陽以暖脾胃,五味子斂陰陽入脾腎,一散一斂,調節氣機升降出入,以化痰濕、消脹滿,補虛祛邪,達到治療非酒精性脂肪肝的目的[8]。實驗研究表明五味子中木脂素類、黃酮類等成分可抑制肝臟脂肪沉淀,減少肝臟轉氨酶的釋放,抗纖維化[9-10],淫羊藿中的淫羊藿苷等物質可調節脂代謝,抑制炎癥介質,改善肝纖維化[11]。
目前關于探索淫羊藿、五味子治療非酒精性脂肪肝的作用,多從單一藥物成分或單個靶點、通路進行,缺少對二者合用多成分、多靶點途徑的研究。近年來網絡藥理學研究方法的出現,實現藥物研究從單一靶點到多信號通路的多途徑調節[12]。網絡靶標充分考慮到中藥成分的多樣性及關聯性,將病證生物分子網絡當做靶標,以預測中藥治療疾病的作用機制,這一概念的提出和方法的建立大大推動了中藥復方網絡藥理研究的進展[13-14]。本研究旨在通過中藥網絡藥理學方法,建立“藥對-靶點-通路-疾病”多層次生物作用網絡,探討“淫羊藿-五味子”治療非酒精性脂肪肝的作用機制,為今后的實驗研究提供依據和方向。
1 材料與方法
1.1 淫羊藿-五味子藥對藥效成分篩選及靶點獲取 ?通過中藥系統藥理學數據庫與分析平臺(TCMSP)(http://lsp.nwu.edu.cn/tcmsp.php)和中醫藥綜合數據庫(TCMID)(http://www.megabionet.org/tcmid/),結合文獻查閱,得到淫羊藿、五味子所有化學成分,再設定篩選條件為口服生物利用度(OB)≥30%和類藥性(DL)≥0.18,篩選出淫羊藿、五味子的活性成分。同時在TCMSP數據庫中獲取相關化合物靶點蛋白,通過Uniprot數據庫(http://www.uniprot.org/)將預測出的靶點蛋白名轉換為基因名,對應相應的人源基因名稱。
1.2 非酒精性脂肪肝相關作用靶點的篩選 在GeneCards數據庫(http://www.genecards.org/)和OMIM數據庫(http://www.ncbi.nlm.nih.gov/omim)中輸入關鍵詞“Non-alcoholic fatty liver disease”搜索已報道的與非酒精性脂肪肝相關的基因,去除重復基因和假陽性基因,與藥物作用靶點進行匹配,得到藥物與疾病的交集靶點,即淫羊藿-五味子藥對治療非酒精性脂肪肝的潛在作用靶點。
1.3 藥物-活性成分-靶點-疾病網絡的構建 將淫羊藿-五味子的活性成分和非酒精性脂肪肝的潛在作用靶點導入Cytoscape3.7.1軟件,繪制藥物-活性成分-靶點-疾病網絡。
1.4 蛋白質-蛋白質相互作用(PPI)網絡構建與分析 將交集靶點蛋白導入String數據庫(https://string-db.org/cgi/input.pl),獲取PPI網絡,并將結果保存成TSV格式導入Cytoscape3.7.1軟件,再利用“Network Analysis”功能進行網絡的拓撲屬性分析,依據其Degree(節點度值)重要的網絡拓撲參數,明確“淫羊藿-五味子”治療非酒精性脂肪肝關鍵作用的靶點蛋白。同時運用Cytoscape3.7.1軟件Cluster Maker插件,將上述PPI網絡中靶點蛋白進行模塊化分析。
1.5 基因本體(Gene Ontology,GO)富集分析和京都基因和基因組百科全書(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析 利用DAVIAD數據庫(https://david.ncifcrf.gov/)進行GO富集分析,分析靶點蛋白的生物學意義。利用Cytoscape軟件中ClueGO插件進行KEGG通路富集分析,進而分析淫羊藿-五味子藥對治療非酒精性脂肪肝的可能通路及機制。
2 結果
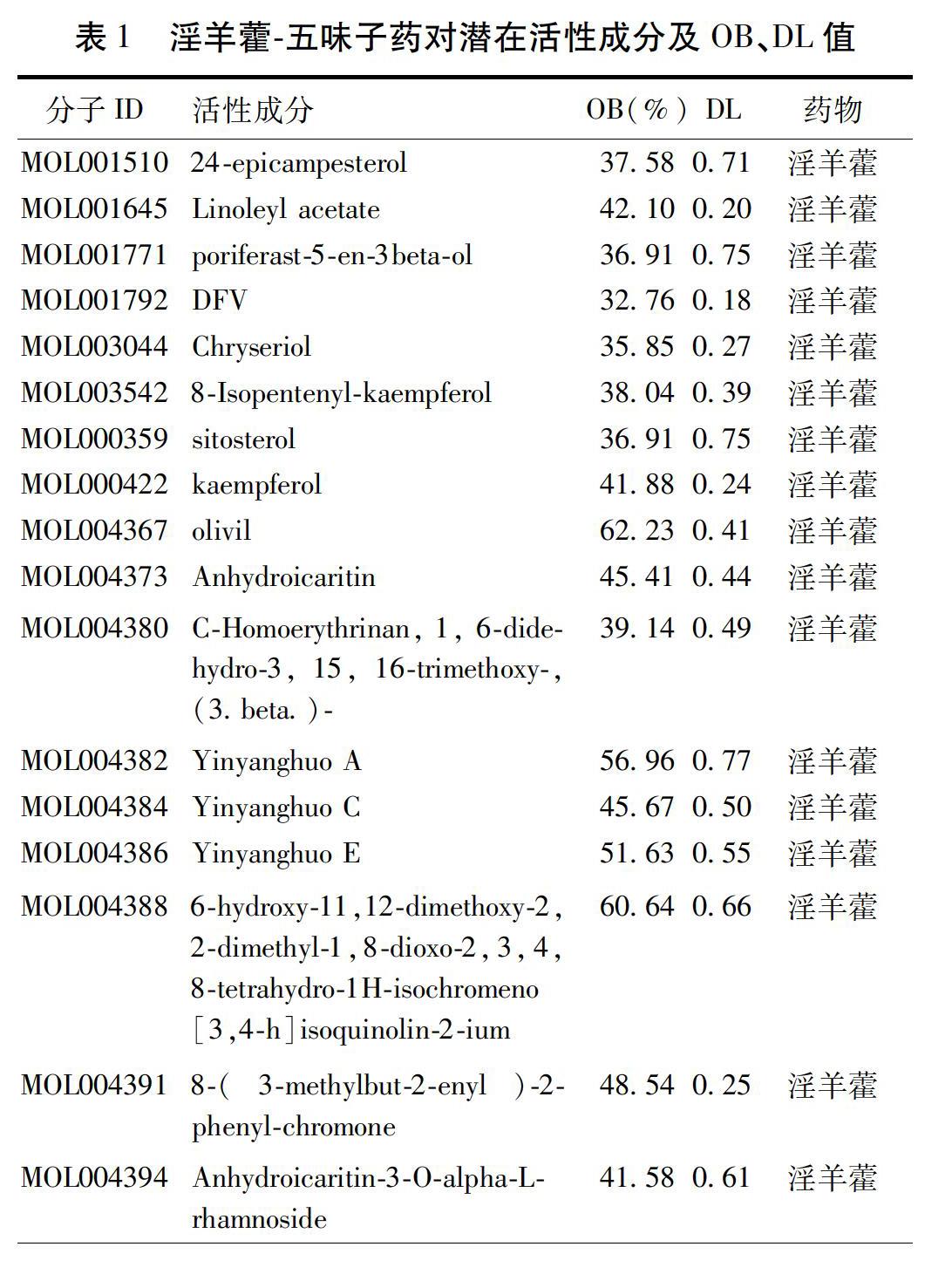
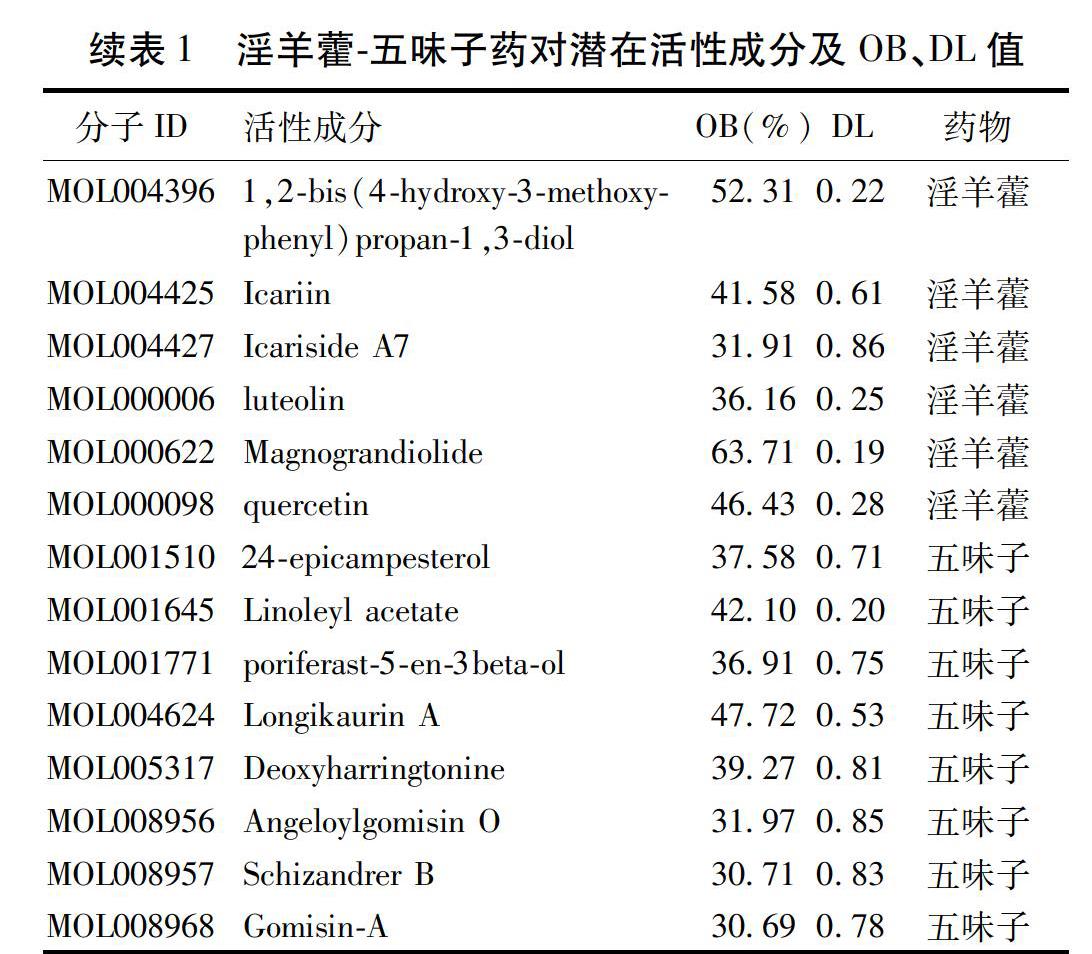
2.1 淫羊藿-五味子藥對藥效成分篩選 共得到31個藥效成分,其中淫羊藿藥效成分23個,五味子藥效成分8個,及藥對活性成分相應靶點蛋白189個。見表1。
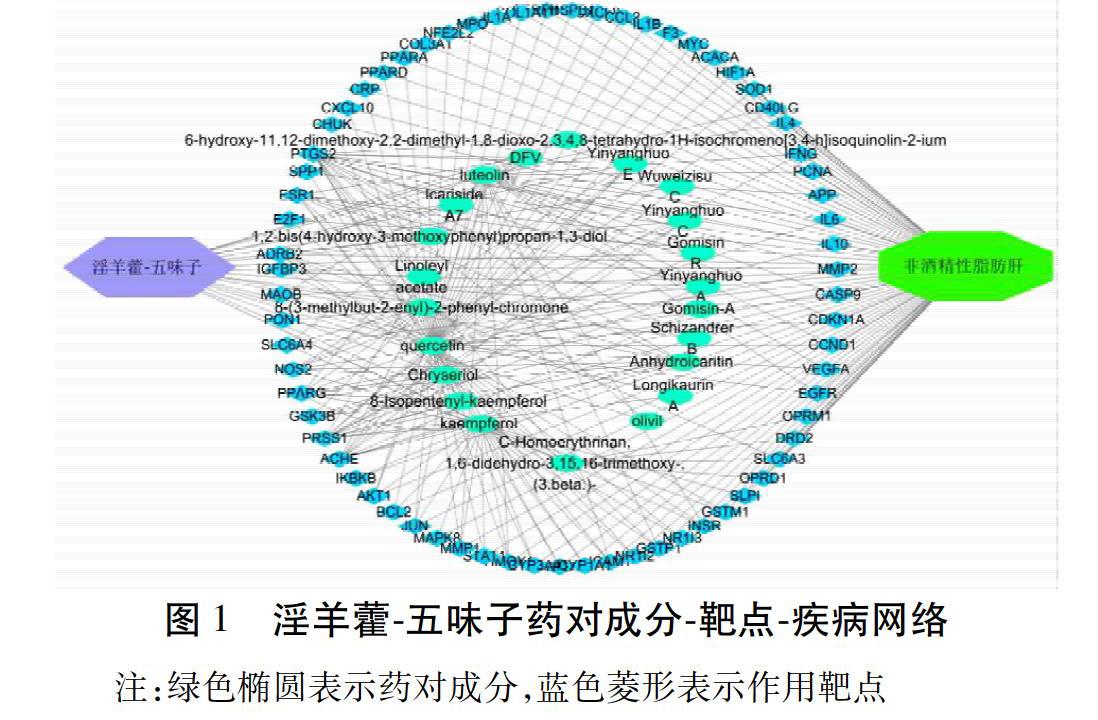
2.2 淫羊藿-五味子藥對成分-靶點-疾病網絡圖 ? 檢索GeneCard、OMIM數據庫獲取非酒精性脂肪肝相關聯的基因靶點,與“淫羊藿-五味子”有效活性成分靶點進行匹配,獲得交集靶點69個,并運用Cytoscape3.7.1軟件繪制活性成分-靶點-疾病網絡圖。可見淫羊藿-五味子藥對中一個活性成分可作用于多個靶點,一個靶點也可與多種活性成分相對應,從而提示“淫羊藿-五味子”能夠通過31個藥效成分,作用于69個靶點達到治療非酒精性脂肪肝的作用,體現了“淫羊藿-五味子”治療非酒精性脂肪肝具有多成分、多靶標的特點。見圖1。
2.3 PPI網絡分析結果 網絡拓撲學分析結果見圖2。PPI網絡共包含45個節點,164條邊,其中節點表示靶點蛋白,每條邊表示靶點蛋白質與蛋白質之間的相互作用關系,邊的粗細代表相互作用力強弱。根據節點連接度(Degree)大小,獲取關鍵靶點蛋白。結果顯示前15個靶點蛋白見表2,其中,與細胞炎癥有關的靶點蛋白包括白細胞介素-6(IL-6)、白細胞介素-8(IL-8)、白細胞介素-1β(IL-1β)、細胞趨化因子2(CCL2)、白細胞介素-10(IL-10)、過氧化物酶體增殖物激活受體γ(PPARG);與細胞增殖分化相關靶點蛋白包括蘇氨酸激酶1(AKT1)、環氧化酶2(PTGS2)、轉錄因子AP-1/JUN、絲裂原活化蛋白激酶8(MAPK8)、MYC原癌基因蛋白質(MYC)、表皮生長因子受體(EGFR)、血管內皮生長因子A(VEGFA)、血紅素加氧酶1(HMOX1);與脂質代謝、胰島素信號轉導相關的有:雌激素受體1(ESR1)、白細胞介素-6(IL-6)、蘇氨酸激酶1(AKT1)、過氧化物酶體增殖物激活受體γ(PPARG)。據此推測,淫羊藿-五味子藥對可通過調節相關靶點蛋白改善脂質代謝、改善胰島素抵抗、抗炎、抗細胞增殖達到綜合治療非酒精性脂肪肝的作用。
2.4 GO富集分析 GO富集分析結果顯示,共富集21個分子功能、7個細胞組分和30個生物學過程。見圖3~5。淫羊藿-五味子藥對治療非酒精性脂肪肝涉及的細胞組分主要有膜筏、投射神經元、細胞器膜、細胞內面上細胞器、內質網膜等;分子功能主要有RNA聚合酶Ⅱ轉錄因子活性配體激活的序列特異性DNA結合、細胞因子活性、藥物結合、轉錄因子結合、類固醇激素受體活性等;參與的生物學過程主要有轉錄正調控DNA模板、免疫應答、細胞對腫瘤壞死因子的反應、成纖維細胞增殖的正調控、類固醇激素介導的信號通路等。
2.5 KEGG通路分析 利用Cytoscape軟件中ClueGO插件進行KEGG通路分析,共富集109條通路。見圖6~7。其中較為重要的通路有糖尿病并發癥AGE-RAGE信號通路(AGE-RAGE Signaling Pathway in Diabetic Complications)、PI3K-AKT信號通路(PI3K-AKT Signaling Pathway)、丙型肝炎(Hepatitis C)、查加斯病(Chagas disease)、松弛信號通路(Elaxin Signaling Pathway)、流體剪切應力與動脈粥樣硬化(Fluid Shear Stress and Atherosclerosis)、非酒精性脂肪肝(Non-alcoholic Fatty Liver Disease,NAFLD)等通路,表明“淫羊藿-五味子”藥效成分可能通過作用于以上通路實現對非酒精性脂肪肝的治療作用。
3 討論
目前非酒精性脂肪肝的發病機制尚不明確,其中胰島素抵抗、肝臟脂肪細胞蓄積、脂質代謝產物脂毒性作用,是非酒精性脂肪肝肝炎發生的重要過程[15]。《素問·經脈別論》曰:“飲入于胃,游溢精氣,上輸于脾,脾氣散精。”脾胃虧虛、陽氣不足不能將飲食化為人體所需的蛋白質、葡萄糖等精微物質,引起血液中血糖、血脂升高以供能,導致機體代謝紊亂,可能是胰島素抵抗發生的中醫病因病機[16]。《玉楸藥解》釋淫羊藿:“味辛,苦,微溫,入足少陰腎、足厥陰肝經。”可“溫補肝腎”“消瘰疬”;《本草經集注》載五味子:“酸,溫……主益氣……養五臟。”二藥配伍,酸辛并用,陰陽并濟,以調整臟腑陰陽,促進氣血津液正常的濡養及代謝功能。中醫藥多途徑、多靶點的治療優勢,能通過改善胰島素抵抗、抗氧化應激、減少炎癥介質釋放等方面達到綜合治療非酒精性脂肪肝的目的[17]。
網絡藥理學結果顯示,淫羊藿-五味子藥對的藥效成分共31個,藥物-疾病交集靶點69個,以上藥效成分通過調控IL6、AKT1、CXCL8、VEGFA、PTGS2、IL1B、JUN、MAPK8、IL10、PPARγ等靶點,作用于AGE-RAGE、丙型肝炎、松弛信號通路、流體剪切應力與動脈粥樣硬化、非酒精性脂肪肝等通路達到治療NAFLD的療效。目前已有研究表明,在非酒精性脂肪肝發病機制中,IL-6、IL-1β不僅是重要的炎癥介質,還能促進胰島素抵抗、改變脂質代謝[18-19],而阻斷二者的表達水平可降低炎癥反應,改善肝纖維化;JNK活性降低可改善脂肪變性、抑制肝組織炎癥反應[20],從而緩解內質網應激引發的“未折疊的蛋白質反應”(UPR);血清中炎癥標志物IL-10[21]、IL-8[22]的水平與非酒精性脂肪肝嚴重程度相關,而VEGFA、EGFR靶點蛋白則通過干擾核糖體、泛素介導的蛋白水解、局灶性黏附等通路影響非酒精性脂肪肝疾病進程[23];PTGS2抑制劑可以抑制PPARγ的表達和激活,從而改善肝臟脂質代謝和胰島素抵抗[24]。
GO富集分析結果顯示,淫羊藿-五味子治療非酒精性脂肪肝的關鍵靶點主要分布在膜筏、投射神經元、細胞器膜、細胞內面上細胞器、內質網膜等細胞組分,具有RNA聚合酶Ⅱ轉錄因子活性配體激活的序列特異性DNA結合、細胞因子活性、藥物結合、轉錄因子結合、類固醇激素受體活性等分子功能,主要參與轉錄正調控DNA模板、免疫應答、細胞對腫瘤壞死因子的反應、成纖維細胞增殖的正調控、類固醇激素介導的信號通路等生物學過程。可見“淫羊藿-五味子”治療非酒精性脂肪肝是通過多種細胞組分、結合多種分子功能、參與多種生物學過程而發揮作用的。
KEGG通路分析結果顯示,淫羊藿-五味子藥對通過AGE-RAGE信號通路、丙型肝炎、查加斯病、松弛信號通路、流體剪切應力與動脈粥樣硬化、非酒精性脂肪肝等通路達到治療NAFLD的作用。已有研究發現,AGE-RAGE信號通路在非酒精性脂肪肝的發病過程中有重要的作用,胰島素抵抗、脂代謝受損促進糖基化終產物(AGEs)的生成,而AGEs與RAGE結合后,激活煙酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶等靶點,相關細胞因子活化后,促進活性氧生成、炎癥反應、細胞增殖分化,抑制AGE-RAGE信號通路可在一定程度上改善NAFLD[25-26]。PI3K/AKT信號轉導通路在調節肝臟胰島素的葡萄糖代謝功能有關鍵作用,胰島素與其受體(IR)結合后,會觸發一系列磷酸化反應并激活關鍵下游靶點如IRS2、PI3K和AKT,PI3K/AKT活化后引起糖原合成酶激酶3α(GSK3α)、糖原磷酸化酶(GP)等失活,從而誘導糖原合成,上調PI3K/AKT信號通路可增加肝臟中IR的表達[27],及下游血紅素氧合酶1(HO-1)和醌氧化還原酶1(NQO1)等表達[28],從而達到改善糖代謝、脂質代謝、抗氧化損傷的作用。此外,“淫羊藿-五味子”還作用在NAFLD疾病通路發揮治療作用,其機制可能是抑制依賴于LKB1/AMPK/mTOR通路的SREBPs激活,以及激活Nrf2等因子,阻斷核因子κB及MAPK等信號通路,抑制內質網應激、相關氧化應激等信號通路有關蛋白的表達,降低血清ALT、AST水平,促進肝星形細胞凋亡,從而改善脂質代謝、減輕肝損傷,延緩肝纖維化[10,29-31]。
此外,研究發現較低的雌激素水平影響非酒精性脂肪肝的發病及程度[32-33],這與雌激素影響肝臟脂代謝,減少肝細胞脂質沉積有關[34],而淫羊藿、五味子中所含有的黃酮類、木脂素類有較好的擬雌激素作用[35-37]。“淫羊藿-五味子”藥效成分可作用于雌激素受體(ESR1),參與類固醇激素介導的信號通路,達到調節人體雌激素的作用。
綜上所述,本研究基于網絡藥理學技術,結合已有實驗報道,初步探索了淫羊藿-五味子藥對治療NAFLD多層次的作用機制,同時也體現中醫藥治療的整體觀念。該結果為進一步實驗研究及臨床應用提供一定的依據,也為淫羊藿和五味子單一成分治療NAFLD的研究提供不同的思路。但是,本研究存在一定局限性,首先劑量是中藥發揮作用的關鍵之處,不同劑量的配伍可達到不同的治療目的;其次,復方煎煮后是否產生新的化合物,從而作用于其他的靶點和通路,尚不能確定;最后采用數據庫的不同,也可能給研究結果帶來一定影響。因此,上述結果尚需本研究組進一步通過實驗進行驗證。
參考文獻
[1]Younossi ZM,Koenig AB,Abdelatif D,et al.Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence,incidence,and outcomes[J].Hepatology,2016,64(1):73-84.
[2]Rinella ME.Nonalcoholic fatty liver disease:a systematic review[J].JAMA,2015,313(22):2263-2273.
[3]中華醫學會肝病學分會脂肪肝和酒精性肝病學組,中國醫師協會脂肪性肝病專家委員會.非酒精性脂肪性肝病防治指南(2018年更新版)[J].實用肝臟病雜志,2018,21(2):177-186.
[4]中華中醫藥學會脾胃病分會.非酒精性脂肪性肝病中醫診療專家共識意見(2017)[J].中醫雜志,2017,58(19):1706-1710.
[5]費亞軍,費璇.溫陽通絡祛濁方治療非酒精性脂肪肝的療效及對肝脾CT值的影響[J].現代中西醫結合雜志,2018,27(24):2699-2702.
[6]柳濤,唐志鵬,季光.溫陽化氣論治非酒精性脂肪性肝病[J].中西醫結合學報,2011,9(2):135-137.
[7]張美英,陳慧媧.陳寶貴醫論醫話選[M].北京:中國中醫藥出版社,2015:141.
[8]張玉嶺.陳寶貴運用和胃安神法治療不寐經驗[J].河南中醫,2012,32(12):1601-1602.
[9]張雯,朱雅迪,張起堯,等.五味子在肝臟疾病防治中的應用及其作用機制研究進展[J].中國中藥雜志,2020,45(16):3759-3769.
[10]董艷敏.五味子乙素治療非酒精性脂肪肝病藥效學和機制研究[D].廣州:廣東藥科大學,2016.
[11]Zheng ZG,Zhou YP,Zhang X,et al.Anhydroicaritin improves diet-induced obesity and hyperlipidemia and alleviates insulin resistance by suppressing SREBPs activation[J].Biochem Pharmacol,2016,122:42-61.
[12]Hopkins AL.Network pharmacology:the next paradigm in drug discovery[J].Nat Chem Biol,2008,4(11):682-690.
[13]李梢.網絡靶標:中藥方劑網絡藥理學研究的一個切入點[J].中國中藥雜志,2011,36(15):2017-2020.
[14]Li S,Zhang B,Jiang D,et al.Herb network construction and co-module analysis for uncovering the combination rule of traditional Chinese herbal formulae[J].BMC Bioinformatics,2010,11 Suppl 11(Suppl 11):S6.
[15]Buzzetti E,Pinzani M,Tsochatzis EA.The multiple-hit pathogenesis of non-alcoholic fatty liver disease(NAFLD)[J].Metabolism,2016,65(8):1038-1048.
[16]陳筱云,段正勝.2型糖尿病前期中醫病機探討[J].世界中西醫結合雜志,2013,8(1):4-5.
[17]周雨,張智偉,王京奇.從“二次打擊”學說探討中藥防治非酒精性脂肪肝的研究進展[J].中醫藥導報,2017,23(18):109-111.
[18]Stojsavljevi'c S,Gomeri'c Pali'c M,Virovi'c Juki'c L,et al.Adipokines and proinflammatory cytokines,the key mediators in the pathogenesis of nonalcoholic fatty liver disease[J].World J Gastroenterol,2014,20(48):18070-18091.
[19]Vonghia L,Magrone T,Verrijken A,et al.Peripheral and Hepatic Vein Cytokine Levels in Correlation with Non-Alcoholic Fatty Liver Disease(NAFLD)-Related Metabolic,Histological,and Haemodynamic Features[J].PLoS One,2015,10(11):e0143380.
[20]Puri P,Mirshahi F,Cheung O,et al.Activation and dysregulation of the unfolded protein response in nonalcoholic fatty liver disease[J].Gastroenterology,2008,134(2):568-576.
[21]Paredes-Turrubiarte G,González-Chávez A,Pérez-Tamayo R,et al.Severity of non-alcoholic fatty liver disease is associated with high systemic levels of tumor necrosis factor alpha and low serum interleukin 10 in morbidly obese patients[J].Clin Exp Med,2016,16(2):193-202.
[22]Glass O,Henao R,Patel K,et al.Serum Interleukin-8,Osteopontin,and Monocyte Chemoattractant Protein 1 Are Associated With Hepatic Fibrosis in Patients With Nonalcoholic Fatty Liver Disease[J].Hepatol Commun,2018,2(11):1344-1355.
[23]Wang R,Wang X,Zhuang L.Gene expression profiling reveals key genes and pathways related to the development of non-alcoholic fatty liver disease[J].Ann Hepatol,2016,15(2):190-199.
[24]Tsujimoto S,Kishina M,Koda M,et al.Nimesulide,a cyclooxygenase-2 selective inhibitor,suppresses obesity-related non-alcoholic fatty liver disease and hepatic insulin resistance through the regulation of peroxisome proliferator-activated receptor γ[J].Int J Mol Med,2016,38(3):721-728.
[25]Santos JC,Valentim IB,de Araújo OR,et al.Development of nonalcoholic hepatopathy:contributions of oxidative stress and advanced glycation end products[J].Int J Mol Sci,2013,14(10):19846-19866.
[26]Palma-Duran SA,Kontogianni MD,Vlassopoulos A,et al.Serum levels of advanced glycation end-products(AGEs) and the decoy soluble receptor for AGEs(sRAGE) can identify non-alcoholic fatty liver disease in age-,sex-and BMI-matched normo-glycemic adults[J].Metabolism,2018,83:120-127.
[27]Xu H,Zhou Y,Liu Y,et al.Metformin improves hepatic IRS2/PI3K/Akt signaling in insulin-resistant rats of NASH and cirrhosis[J].J Endocrinol,2016,229(2):133-144.
[28]Fan H,Ma X,Lin P,et al.Scutellarin Prevents Nonalcoholic Fatty Liver Disease(NAFLD) and Hyperlipidemia via PI3K/AKT-Dependent Activation of Nuclear Factor(Erythroid-Derived 2)-Like 2(Nrf2) in Rats[J].Med Sci Monit,2017,23:5599-5612.
[29]尤旭,趙海霞,楊思琪,等.淫羊藿苷激活Nrf2/HO-1信號通路減輕自然衰老大鼠睪丸生殖細胞DNA損傷研究[J].中草藥,2019,50(12):2915-2921.
[30]Jung JY,Park SM,Ko HL,et al.Epimedium koreanum Ameliorates Oxidative Stress-Mediated Liver Injury by Activating Nuclear Factor Erythroid 2-Related Factor 2[J].Am J Chin Med,2018,46(2):469-488.
[31]Jang MK,Nam JS,Kim JH,et al.Schisandra chinensis extract ameliorates nonalcoholic fatty liver via inhibition of endoplasmic reticulum stress[J].J Ethnopharmacol,2016,185:96-104.
[32]Ballestri S,Nascimbeni F,Baldelli E,et al.NAFLD as a Sexual Dimorphic Disease:Role of Gender and Reproductive Status in the Development and Progression of Nonalcoholic Fatty Liver Disease and Inherent Cardiovascular Risk[J].Adv Ther,2017,34(6):1291-1326.
[33]Regitz-Zagrosek V,Lehmkuhl E,Weickert MO.Gender differences in the metabolic syndrome and their role for cardiovascular disease[J].Clin Res Cardiol,2006,95(3):136-147.
[34]李鳳娟,魏蘇寧,王綠婭,等.雌激素抑制脂滴包被蛋白Perilipin2減少肝細胞脂質沉積[J].心肺血管病雜志,2018,37(7):687-691.
[35]趙元,鄭紅霞,徐穎,等.中藥植物雌激素的研究進展[J].中國中藥雜志,2017,42(18):3474-3487.
[36]柯志鵬,張新莊,曹澤彧,等.基于網絡藥理學研究淫羊藿治療骨質疏松癥的分子作用機制[J].中國中藥雜志,2019,44(18):4048-4052.
[37]曾華婷,郭健,陳彥.淫羊藿素藥理作用及其新型給藥系統的研究進展[J].中草藥,2020,51(20):5372-5380.
(2019-12-01收稿 責任編輯:張雄杰)

