強心一號配方對膿毒癥小鼠海馬區(qū)神經(jīng)炎癥反應的影響
王雪蕊 劉清泉 徐霄龍 白云靜 哈雁翔 郭玉紅

摘要 目的:探討強心一號配方對膿毒癥小鼠認知功能障礙和海馬區(qū)神經(jīng)炎癥反應的影響。方法:將60只C57BL/6小鼠分為假手術組、模型組、強心組,每組20只。模型組和強心組采取盲腸結扎穿孔術(CLP)制備膿毒癥模型。強心組于術后2 h給予強心一號配方灌胃治療,濃度為1 g/kg體質(zhì)量,模型組和假手術組分別給予1 mL生理鹽水灌胃治療。術后10 d采用Morris水迷宮實驗評價小鼠空間學習記憶能力的變化,酶聯(lián)免疫吸附試驗法(ELISA)檢測小鼠海馬組織中炎癥介質(zhì)蛋白表達水平,實時定量PCR檢測海馬組織炎癥介質(zhì)基因表達水平。結果:與假手術組比較,模型組Morris水迷宮逃避潛伏期和目標象限的時間顯著降低,海馬組織中白細胞介素1-β(IL-1β)、白細胞介素6(IL-6)、腫瘤壞死因子-α(TNF-α)蛋白和基因表達水平顯著增高(P<0.05);與模型組比較,強心組逃避潛伏期和目標象限時間顯著升高,海馬組織IL-1β和TNF-α蛋白和基因表達水平顯著下降(P<0.05)。各組小鼠Morris水迷宮游泳速度差異無統(tǒng)計學意義(P>0.05)。結論:強心一號配方對CLP小鼠認知功能障礙具有保護作用,其機制可能與減輕海馬區(qū)神經(jīng)炎癥反應有關。
關鍵詞 膿毒癥;中藥;強心一號配方;認知功能;水迷宮;海馬;炎癥介質(zhì);神經(jīng)炎癥
Abstract Objective:To investigate the effects of Qiang-xin1 Formula on cognitive dysfunction and neuroinflammation in hippocampus of sepsis mice.Methods:A total of 60 healthy male C57BL/6 mice were selected as the research objects and were randomly divided into a sham group,a model group and a Qiang-xin1 group,with 20 cases in each group.Cecal ligation and puncture (CLP) was used to establish sepsis model in model group and Qiang-xin1 group.Two hours after operation,1g/kg·bw of Qiang-xin1 Formula was orally administrated in the Qiang-xin1 group,and 1 mL of normal saline was orally administrated in the model group and the sham operation group.Morris water maze test was used to evaluate the spatial learning and memory ability in CLP mice 10 days after surgery.ELISA was used to detect the protein levels of inflammatory factors in the hippocampus of mice.Realtime PCR was used to detect the expression of inflammatory factors in the hippocampus.Results:Compared with the sham group,the escape latency and the time in the target quadrant accessed by Morris water maze test were significantly reduced in the model group.The protein and gene levels of IL-1 β,IL-6,TNF-α in the hippocampus were significantly increased (P<0.05) in the model group.Compared with the model group,the escape latency and the time in the target quadrant accessed by Morris water maze test were significantly increased in Qiang-xin1 group (P<0.05).The protein and gene levels of IL-1β and TNF-α were significantly down-regulated in Qiang-xin1 group (P<0.05).The swimming speed in the Morris water maze test showed no difference among each groups.Conclusion:Qiang-xin1 Formula has protective effect on cognitive dysfunction in CLP mice,and the mechanism may be related to the reduced neuroinflammation in the hippocampus.
Keywords Sepsis; Chinese Medicinal; Qiang-xin1 Formula; Cognitive function; Morris water maze; Hippocampus; Inflammatory Factor; Neuroinflammation
中圖分類號:R285.5文獻標識碼:Adoi:10.3969/j.issn.1673-7202.2021.14.008
膿毒癥是指宿主對微生物感染的應答反應失調(diào)而導致危及生命的多器官功能障礙[1],是導致重癥監(jiān)護病房(Intensive Care Unit,ICU)患者死亡的“頭號殺手”[2]。膿毒癥患者常伴隨大腦的局灶性或者彌漫性的功能障礙,出現(xiàn)如注意力缺乏、譫妄、昏迷、認知功能異常等一系列臨床綜合征,被稱為膿毒癥相關性腦病(Sepsis-associated Encephalopathy,SAE)。ICU患者中SAE的發(fā)病率高達70%以上[3],SAE是膿毒癥患者死亡的危險因素[4]。不僅如此,幸存的膿毒癥患者多伴有遠期認知障礙、抑郁癥、創(chuàng)傷后應激障礙和記憶存儲損傷等遠期神經(jīng)系統(tǒng)癥狀,是導致生命質(zhì)量下降和醫(yī)療成本增加的主要原因[5]。因此,及時有效地預防和治療SAE對于改善膿毒癥患者的生存率和提高生命質(zhì)量至關重要。本課題組在多年治療膿毒癥的相關經(jīng)驗下,總結明確了強心一號配方對膿毒癥小鼠的療效[6-7]。本研究觀察強心一號配方對膿毒癥小鼠認知功能損害和海馬區(qū)神炎癥反應的影響,為強心一號配方的臨床應用提供理論證據(jù)。
1 材料與方法
1.1 材料
1.1.1 動物 本研究所用SPF級動物均采購于北京華阜康生物科技股份有限公司(生產(chǎn)許可證號SCXK(京)2014-0004,使用許可證號:SCXK(京)2015-0023)。動物為C57BL/6J背景小鼠,60只,雄性,鼠齡10~12周,體質(zhì)量20~23 g,各組小鼠自由進水進食,保持室溫恒定,由北京中醫(yī)醫(yī)院研究所按純系動物要求專人飼養(yǎng)。
1.1.2 藥物 強心一號配方中藥物均由首都醫(yī)科大學附屬北京中醫(yī)醫(yī)院中藥房提供。組成包括:水紅花子30 g、黃芪30 g、茯苓20 g、丹參20 g、五味子10 g。藥物煎煮方法同既往文獻[6-7]。
1.1.3 試劑與儀器 反轉(zhuǎn)錄試劑盒(Promega,美國,批號:A3500),實時定量PCR試劑盒(TaKaRa,日本,批號RR047A),小鼠白細胞介素-6(IL-6,批號:M6000B)、腫瘤壞死因子-α(TNF-α,批號:MTA00B)和白細胞介素-1β(IL-1β,批號:MLB00C)均購于美國R&D公司,戊巴比妥鈉(上海榕柏生物技術有限公司,批號:57-33-0)。Morris水迷宮(Styling,美國,型號:LM-WM0010),Morris水迷宮視頻分析系統(tǒng)(Supermaze,美國,型號:XR-XM101),Bio-Rad iQ5實時定量PCR儀(Bio-Rad,美國,型號:ABI7500),臺式離心機(BECKMAN,美國,型號:Allegra X-30R),酶標儀(Biotek,美國,型號:ELx808)。
1.2 方法
1.2.1 分組與模型制備 采用隨機數(shù)字表法將實驗動物隨機分為假手術組、模型組和強心組,每組20只。模型組和強心組小鼠采用盲腸結扎穿孔術(CLP)復制膿毒癥動物模型。采用1%戊巴比妥鈉對動物進行腹腔麻醉后,行手術操作,假手術組小鼠行假手術操作,方法同既往文獻報道[7-8]。術后各組小鼠自由進水進食,保持室溫恒定。
1.2.2 給藥方法 強心組于造模后2 h開始給予1 g/kg體質(zhì)量強心一號配方灌胃,1次/d,時間為每天8:00-10:00,灌胃體積為1 mL。模型組和假手術組于造模術后2 h開始給予1 mL生理鹽水灌胃,1次/d,時間為每天8:00-10:00。
1.2.3 檢測指標與方法
1.2.3.1 認知功能測定 采用Morris水迷宮試驗評價各組小鼠空間學習記憶能力。該試驗包括定位航行試驗和空間探索試驗。水迷宮試驗在直徑100 cm、高度40 cm的圓形水箱中進行。水溫維持在(22±1)℃,分為東北、西北、東南、西南4個象限。一個可移動的隱蔽平臺(直徑5 cm)被放置在目標象限(東北方向)水面以下0.5 cm的深處。每次調(diào)試完設備后,于上午8:30正式開始實驗。假手術組、模型組、強心組小鼠各20只,依次進行試驗。定位航行試驗:各組小鼠于CLP術后第6天開始訓練試驗,每只老鼠連續(xù)訓練4 d,每天接受3次訓練。給小鼠90 s的時間來尋找平臺。小鼠一旦定位到水下平臺,就可以在平臺上停留10 s。期間攝像自動記錄每只小鼠逃避潛伏期和游泳速度。每次訓練試驗結束后小鼠被放回籠子里休息10 min后開始下1次訓練。空間探索試驗:在訓練的5 d(CLP術后第10天)通過移除平臺進行探索試驗,允許小鼠自由游泳90 s,攝像自動記錄各小鼠在目標象限的時間。
1.2.3.2 海馬組織炎癥介質(zhì)蛋白水平檢測 于CLP造模后第10天,采用隨機數(shù)字表法將檢測完Morris水迷宮的假手術組、模型組、強心組小鼠各選出10只。動物麻醉后進行斷頭處理,小鼠腦組織放于冰盒上并迅速分離海馬組織,經(jīng)液氮快速冷凍后轉(zhuǎn)入-80 ℃保存。采用酶聯(lián)免疫吸附試驗法(ELISA)參照試劑盒步驟對海馬組織中炎癥介質(zhì)的水平進行檢測。
1.2.3.3 實時熒光定量PCR法檢測海馬組織炎癥介質(zhì)mRNA表達水平 于CLP造模后第10天,將剩余測完Morris水迷宮的假手術組、模型組、強心組小鼠各10只,采用1%戊巴比妥鈉(40 mg/kg)腹腔注射麻醉,用含有肝素的0.9%氯化鈉溶液灌注心臟,然后進行斷頭處理。小鼠腦組織放于冰盒上并迅速分離海馬組織,經(jīng)液氮快速冷凍后轉(zhuǎn)入-80 ℃保存,待檢測。按照說明書利用Trizol法提取細胞總RNA。將總RNA提取、測濃度、反轉(zhuǎn)錄后進行實時定量PCR實驗。小鼠IL-6、IL-1β、TNF-α和GAPDH引物均通過Premier3軟件設計,引物序列及產(chǎn)物長度同既往文獻[7]。
1.3 統(tǒng)計學方法 采用SPSS 19.0統(tǒng)計軟件進行數(shù)據(jù)分析,數(shù)據(jù)符合正態(tài)分布以均數(shù)±標準差(±s)表示。Morris水迷宮數(shù)據(jù)采用多因素重復測量方差分析。其他數(shù)據(jù)比較采用單因素方差分析(one-way ANOVA),方差齊時采用LSD檢驗,方差不齊時采用Dunnett-t檢驗。以P<0.05為差異有統(tǒng)計學意義。
2 結果
2.1 各組小鼠認知功能比較 1)定位航行試驗:重復測量方差分析檢測時間和分組之間存在交互作用(F=21.3,P<0.01),各組小鼠逃避潛伏期隨時間變化差異有統(tǒng)計學意義(F=209.69,P<0.05),逃避潛伏期根據(jù)分組變化差異有統(tǒng)計學意義(F=213.59,P<0.05)。與假手術組比較,模型組小鼠逃避潛伏期顯著增加(P<0.05);與模型組比較,強心組大鼠逃避潛伏期明顯縮短(P<0.05)。見圖1A和表1。各組小鼠的游泳速度差異無統(tǒng)計學意義(P>0.05)。見圖1B和表2。2)空間探索試驗:與假手術組比較,模型組小鼠在平臺所在目標象限時間百分比顯著降低(P<0.05);與模型組比較,強心組小鼠在目標象限時間百分比顯著增加(P<0.05)。見圖1C。
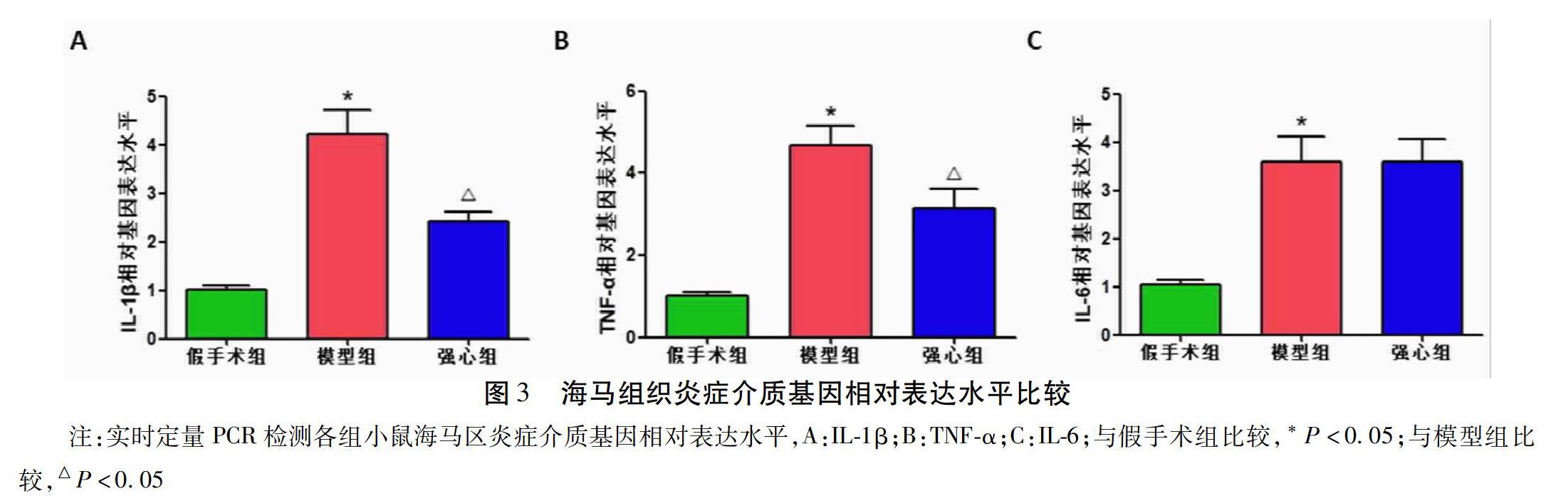
2.2 各組小鼠海馬組織IL-1β、TNF-α和IL-6基因及蛋白表達比較 與假手術組比較,模型組海馬組織中炎癥介質(zhì)IL-1β、TNF-α和IL-6的蛋白和基因表達水平均顯著增高(P<0.05);與模型組比較,強心組海馬組織中IL-1β和TNF-α的蛋白和基因表達水平顯著下降(P<0.05),IL-6的蛋白和基因表達水平?jīng)]有顯著變化。見圖2~3。
3 討論
膿毒癥的高致病率和高死亡率一直是全球面臨的重大難題,據(jù)統(tǒng)計據(jù)流行病學統(tǒng)計,全球每年有2 100萬膿毒癥患者[1],ICU出院后的膿毒癥患者1年病死率高達40%[9],5年病死率高達80%[10]。SAE患者住院期間都常出現(xiàn)譫妄、煩躁、嗜睡、昏睡等腦功能障礙的臨床癥狀,出院后有較高的失語、抑郁、認知功能障礙的風險。研究表明,膿毒癥患者出現(xiàn)情緒及認知功能障礙的概率是正常人的3倍,約25%的膿毒癥患者在出院后1年內(nèi)出現(xiàn)認知障礙,約70%的患者在ICU出院后1年出現(xiàn)認知障礙[11-12]。認知功能障礙不僅影響患者生命質(zhì)量,同時需要更多的康復治療及護理[13],給家庭和社會帶來長期的經(jīng)濟負擔。尋找有效的改善SAE認知功能障礙的治療方式具有重大意義。
SAE患者出現(xiàn)神志癥狀和認知功能障礙,可屬中醫(yī)學“神昏”“癡呆”范疇[14]。本課題組帶頭人劉清泉教授多年來總結了大量的臨床及基礎研究工作,提出了“外來之毒與內(nèi)生毒邪互結”是膿毒癥的主要病因,“正虛毒損,絡脈閉阻”是基本病機[15]。SAE的發(fā)生是由于熱毒、痰濁、瘀血互結于心腦清竅,而致氣機逆亂,蒙蔽心神。其病位在腦,與心、肝、脾、腎皆相關。本病以氣血、腎精虧虛為本,痰濁、瘀血為標,臨床多見虛實夾雜之證,“扶正解毒通絡”應為其主要治則[16]。強心一號配方中黃芪補氣升陽、養(yǎng)血益中;茯苓寧心安神、益氣生津;丹參通絡活血;水紅花子利水化痰消積;五味子養(yǎng)陰益氣、鎮(zhèn)驚安神。我們前期研究發(fā)現(xiàn),強心一號配方對于可以顯著降低膿毒癥小鼠的死亡率[6]。在本研究中,我們利用評價小動物空間學習記憶能力的“金標準”Morris水迷宮檢測強心一號配方對SAE認知功能障礙的改善作用。各組小鼠的游泳速度差異無統(tǒng)計學意義,說明CLP造模和強心一號配方干預對小鼠運動功能沒有影響。定位航向試驗和空間探索試驗結果發(fā)現(xiàn),強心一號配方可以顯著提高膿毒癥小鼠的逃避潛伏期和象限時間百分比,說明強心一號配方對膿毒癥小鼠的空間學習記憶能力具有一定改善作用。
大腦海馬體是與人類的學習記憶等高級功能有密切關系的重要功能區(qū),是腦內(nèi)參與學習、記憶、認知和突觸可塑性的重要部分。研究表明,海馬區(qū)的過度神經(jīng)炎癥反應是導致SAE認知功能障礙的重要原因之一[17-18]。膿毒癥發(fā)生時,血腦屏障的破壞會導致循環(huán)中的細胞因子和免疫炎癥細胞浸潤至深部腦區(qū);腦區(qū)中的細胞因子激活細胞表面的模式識別受體,進一步放大炎癥反應。過度的炎癥反應引起小膠質(zhì)細胞激活、神經(jīng)元細胞凋亡、氧化應激等病理生理學過程,導致認知功能障礙[19]。研究發(fā)現(xiàn),與正常人比較,SAE患者海馬區(qū)IL-6等炎癥介質(zhì)表達顯著升高[20]。在膿毒癥動物模型中,造模6 h內(nèi)即可觀察到炎癥介質(zhì)TNF-α、IL-1β和IL-6等表達的升高,并持續(xù)升高至造模后10~30 d[21-22]。既往研究表明,炎癥介質(zhì)的升高與膿毒癥認知功能障礙的嚴重程度和死亡率的升高成正相關[23-24]。本研究發(fā)現(xiàn),在CLP術后10 d,模型組海馬組織中炎癥介質(zhì)IL-1β、TNF-α和IL-6表達水平顯著增高,強心一號配方可顯著改善炎癥介質(zhì)IL-1β和TNF-α的表達水平。說明強心一號配方改善SAE認知功能障礙的機制可能與降低海馬組織神經(jīng)炎癥反應有關。
但是,強心一號配方是否是通過改善突觸可塑性、減少神經(jīng)元細胞凋亡、降低小膠質(zhì)細胞激活等分子機制來改善膿毒癥認知功能障礙,仍需要進一步研究。
參考文獻
[1]Shankar-Hari M,Phillips GS,Levy ML,et al.Developing a New Definition and Assessing New Clinical Criteria for Septic Shock:For the Third International Consensus Definitions for Sepsis and Septic Shock(Sepsis-3)[J].JAMA,2016,315(8):775-787.
[2]Cohen J,Vincent JL,Adhikari NK,et al.Sepsis:a roadmap for future research[J].Lancet Infect Dis,2015,15(5):581-614.
[3]Sonneville R,de Montmollin E,Poujade J,et al.Potentially modifiable factors contributing to sepsis-associated encephalopathy[J].Intensive Care Med,2017,43(8):1075-1084.
[4]Feng Q,Ai YH,Gong H,et al.Characterization of Sepsis and Sepsis-Associated Encephalopathy[J].J Intensive Care Med,2019,34(11-12):938-945.
[5]Schmidt K,Worrack S,Von Korff M,et al.Effect of a Primary Care Management Intervention on Mental Health-Related Quality of Life Among Survivors of Sepsis:A Randomized Clinical Trial[J].JAMA,2016,315(24):2703-2711.
[6]王雪蕊,徐霄龍,黃坡,哈雁翔,張瑞,郭玉紅,劉清泉.強心一號復方對膿毒癥小鼠心肌細胞凋亡的影響[J].中國中醫(yī)急癥,2020,29(5):769-772.
[7]王雪蕊,徐霄龍,白云靜,等.強心一號復方對膿毒癥小鼠心臟的保護作用及機制[J].中醫(yī)雜志,2019,60(24):2133-2137.
[8]Mishra SK,Choudhury S.Experimental Protocol for Cecal Ligation and Puncture Model of Polymicrobial Sepsis and Assessment of Vascular Functions in Mice[J].Methods Mol Biol,2018,1717:161-187.
[9]Vincent JL,Rello J,Marshall J,et al.International study of the prevalence and outcomes of infection in intensive care units[J].JAMA,2009,302(21):2323-2329.
[10]Iwashyna TJ,Ely EW,Smith DM,et al.Long-term cognitive impairment and functional disability among survivors of severe sepsis[J].JAMA,2010,304(16):1787-1794.
[11]Needham DM,Dinglas VD,Morris PE,et al.Physical and cognitive performance of patients with acute lung injury 1 year after initial trophic versus full enteral feeding.EDEN trial follow-up[J].Am J Respir Crit Care Med,2013,188(5):567-576.
[12]Jackson JC,Girard TD,Gordon SM,et al.Long-term cognitive and psychological outcomes in the awakening and breathing controlled trial[J].Am J Respir Crit Care Med,2010,182(2):183-191.
[13]Prescott HC,Langa KM,Liu V,et al.Increased 1-year healthcare use in survivors of severe sepsis[J].Am J Respir Crit Care Med,2014,190(1):62-69.
[14]王雪飛,李彬,劉清泉,等.膿毒癥相關性腦病的發(fā)病機制及治療探討[J].世界中醫(yī)藥,2014,(3):281-284,287.
[15]趙紅芳,江其敏.劉清泉教授應用中醫(yī)藥治療膿毒癥的臨床經(jīng)驗[J].中國中醫(yī)急癥,2017,26(9):1563-1565.
[16]黃坡,趙京霞,蘇芮,等.劉清泉教授對膿毒癥相關性腦病的認識及其中醫(yī)研究思路探討[J].世界中醫(yī)藥,2018,13(10):2390-2392,2395.
[17]Tian M,Qingzhen L,Zhiyang Y,et al.Attractylone attenuates sepsis-associated encephalopathy and cognitive dysfunction by inhibiting microglial activation and neuroinflammation[J].J Cell Biochem,2019 Jan 22.doi:10.1002/jcb.27983.Online ahead of print.
[18]Michelon C,Michels M,Abatti M,et al.The Role of Secretase Pathway in Long-term Brain Inflammation and Cognitive Impairment in an Animal Model of Severe Sepsis[J].Mol Neurobiol,2020,57(2):1159-1169.
[19]Mazeraud A,Righy C,Bouchereau E,et al.Septic-Associated Encephalopathy:a Comprehensive Review[J].Neurotherapeutics,2020,17(2):392-403.
[20]Wiersinga WJ,Leopold SJ,Cranendonk DR,et al.Host innate immune responses to sepsis[J].Virulence,2014,5(1):36-44.
[21]Hasegawa-Ishii S,Inaba M,Shimada A.Widespread time-dependent changes in tissue cytokine concentrations in brain regions during the acute phase of endotoxemia in mice[J].Neurotoxicology,2020,76:67-74.
[22]Jeremias IC,Victorino VJ,Barbeiro HV,et al.The Role of Acetylcholine in the Inflammatory Response in Animals Surviving Sepsis Induced by Cecal Ligation and Puncture[J].Mol Neurobiol,2016,53(10):6635-6643.
[23]Xu XE,Liu L,Wang YC,et al.Caspase-1 inhibitor exerts brain-protective effects against sepsis-associated encephalopathy and cognitive impairments in a mouse model of sepsis[J].Brain Behav Immun,2019,80:859-870.
[24]Ji MH,Xia DG,Zhu LY,et al.Short-and Long-Term Protective Effects of Melatonin in a Mouse Model of Sepsis-Associated Encephalopathy[J].Inflammation,2018,41(2):515-529.
(2019-12-13收稿 責任編輯:王明)

