細菌周質分子伴侶LolA研究進展
賀小麗 郭磊周 韓佳慧 唐殷 袁媛 代其林 平淑珍 江世杰
(1. 西南科技大學生命科學與工程學院,綿陽 621010;2. 中國農業科學院生物技術研究所,北京 100081; 3. 中南大學生命科學學院,長沙 410078)
細菌脂蛋白是一種由脂質和蛋白質組成的膜錨定蛋白,該類蛋白以攜帶信號肽的前體形式在細胞質中合成,然后在內膜(IM)周質側通過N端半胱氨酸的脂質修飾[1-6],經過3種酶的加工最終形成成熟的三酰化脂蛋白。細菌的脂蛋白涉及多種細胞功能,如細胞表面結構的生物發生和維持、底物的運輸和藥物的流出[7-10]。此外,部分蛋白分泌系統中也含有脂蛋白,致病性革蘭氏陰性菌可以利用這些蛋白質分泌系統將蛋白質注入宿主細胞[11]。因此,理解脂蛋白的轉運體系對于調節細菌與其宿主相互作用有重要意義。成熟脂蛋白通過Lol系統(Lipoprotein outer membrane localization)轉移到外膜(OM)或者滯留在細菌內膜(IM)[11-13]。Lol系統由內膜上的ABC(ATP-binding cassette transporter)轉運復合物LolCDE、周質伴侶分子LolA和外膜脂蛋白受體LolB組成,該系統的不同組分在脂蛋白向外膜的轉運過程中發揮重要作用[13-15]。伴侶分子可以將疏水性脂蛋白從細胞內膜轉運到外膜上,1995年研究發現的脂蛋白特異載體LolA揭示了疏水脂蛋白穿過親水周質的復雜過程[16]。
到目前為止,周質分子伴侶已被證實參與兩個主要過程,即位于OM(OMPs和脂蛋白)的蛋白質成熟過程[17]和在應激條件下保護周質蛋白的過程[18]。LolA伴侶蛋白是一種可溶性蛋白質,用于協助OM脂蛋白在周質中的轉運。本文通過對周質分子伴侶LolA的結構、參與的轉運體系和LolA生物學功能進行綜述,旨在闡明脂蛋白轉運的分子機制以及為細胞膜靶向藥物治療提供參考。
1 細胞周質伴侶LolA結構
LolA是Matsuyama等[16]發現的一種以單體形式存在的伴侶蛋白,它可以將疏水性脂蛋白從細胞IM穿越親水性周質空間轉運到OM上。LolA蛋白具有一段由6個高度保守氨基酸組成的短肽序列(Lys-Arg-Pro-Asn-Leu-Phe),整個蛋白折疊成一個不完整的β-桶(由11個反向平行的β鏈組成)和一個蓋子結構(由3個α-螺旋組成),它們一起形成疏水腔,為脂蛋白酰基鏈提供潛在的結合位點[19]。LolA有一個額外的環結構,該結構包含一個短α-螺旋和C端的第12個β鏈,通過阻斷載體蛋白與磷脂的相互作用,從而阻止脂蛋白逆向轉移至細胞質膜[18,20]。LolA中第二個β鏈的Arg殘基與幾個α螺旋蓋子殘基的氫鍵進一步限制了脂蛋白進入LolA疏水腔[21-22](圖 1)。Pastukhov等[23]通過驗證LolA和 突變體LolA(R43L)的bis-ANS熒光性發現LolA的疏水區處于開放或關閉狀態,取決于LolA是否結合脂蛋白,這種分子內的“扣環”允許LolA蓋子可逆地打開或關閉。研究發現LolA(R43L)突變體的Arg殘基突變后,LolA不能有效地將脂蛋白轉移至LolB[24]。相反,通過LolA(I93C)蓋子半胱氨酸殘基取代突變體中的二硫鍵將LolA蓋子鎖定在關閉構象中是有毒的,會引起包膜應力并激活Cpx雙組分系統[25]。
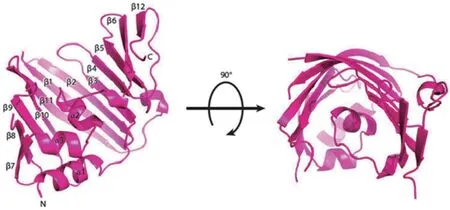
圖1 大腸桿菌LolA的晶體結構[22]Fig. 1 Crystal structure of Escherichia coli LolA[22]
2 周質伴侶LolA參與脂蛋白生物合成
OM脂蛋白首先被Lol-CDE從IM中獲取,周質伴侶蛋白LolA與脂蛋白的酰基鏈結合,保護脂蛋白的疏水部分不受周質親水環境的影響。此后LolA和脂蛋白形成可溶復合物穿過周質空間到達OM,LolA將其底物蛋白質轉移到外膜脂蛋白受體LolB,完成脂蛋白的轉運過程[18,22](圖2)。
2.1 LolA與LolCDE復合物相互作用
轉運體系中周質伴侶LolA首先與LolCDE復合物進行相互作用。LolCDE復合物作為一種ATP結合轉運蛋白,由1個膜亞基LolC、1個膜亞基LolE和2個ATP結合亞基LolD組成。大腸桿菌外膜特異性脂蛋白被ATP結合轉運體LolCDE復合物識別,該轉運體消耗2個ATP能量,將其傳遞至周質分子伴侶LolA進而形成可溶性復合物。位點特異光交聯技術揭示了LolA疏水腔入口與LolCDE存在相互作用[26]。在與ATP結合之前,LolCDE與內膜中的外膜定向脂蛋白相互作用,導致LolD對ATP的親和力增加。隨后ATP與LolD的結合進一步導致LolC / LolE亞基的構象變化,并降低LolCDE與脂蛋白之間的疏水相互作用。LolD介導的ATP水解進一步引起LolC / LolE的構象變化,從而使脂蛋白轉移到LolA,伴隨著疏水腔的打開[26](圖2)。
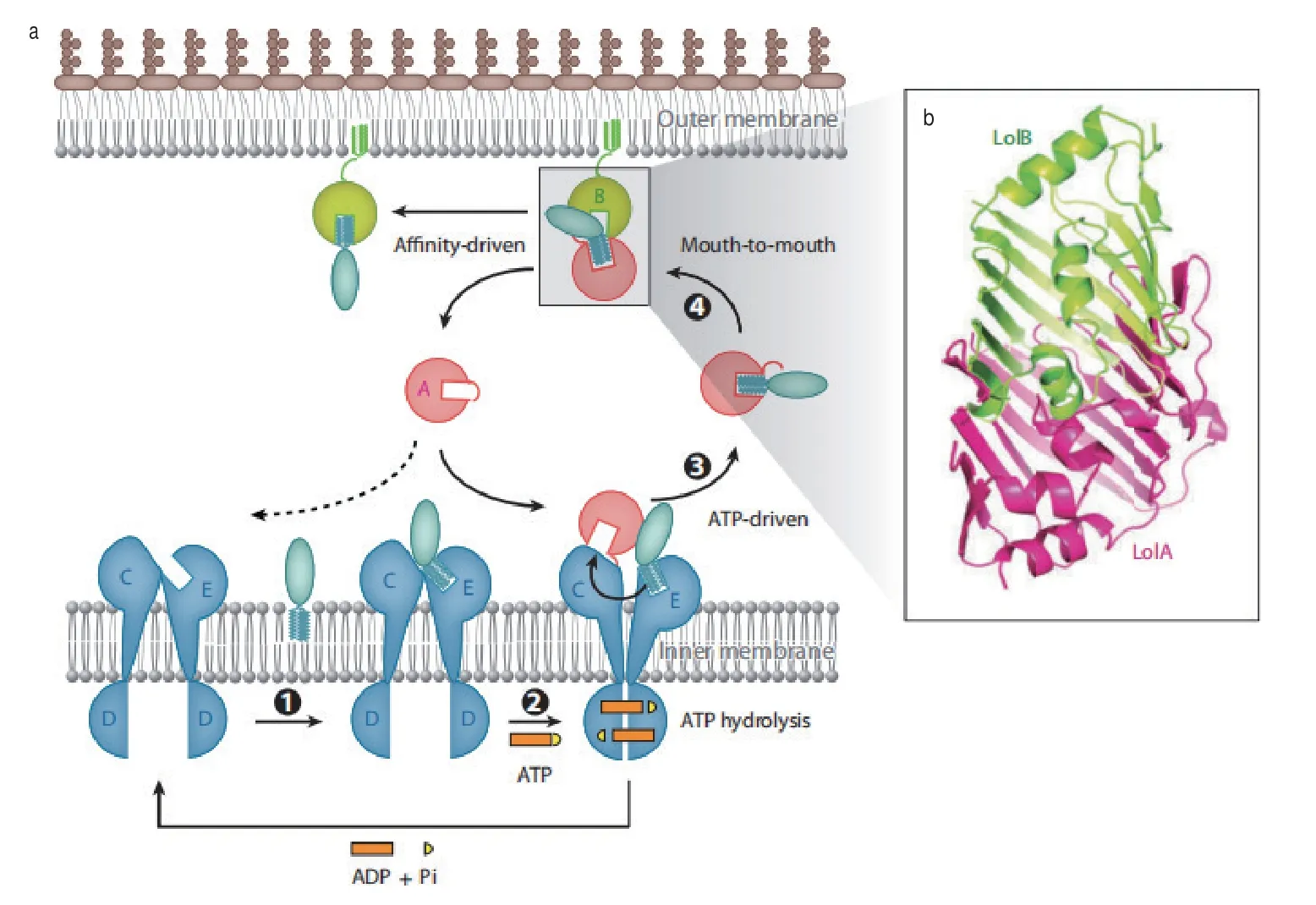
圖2 Lol系統介導的脂蛋白轉運和外膜錨定[22]Fig. 2 Lipoprotein transport and outer membrane anchoring mediated by the Lol system[22]
LolC和LolE的周質區域顯示出與LolA的序列相似性,表明這些區域也具有疏水腔[22],即脂蛋白可能通過其疏水腔的入口或出口從LolCDE轉移至LolA再到LolB。交聯殘基的空間排列顯示在酰基鏈轉移過程中,疏水腔的開口非常接近,支持脂蛋白從LolE到LolA的“mouth to mouth”轉運[26-27]。LolC和LolE都是大腸桿菌生長所必需的,并且具有相似的膜拓撲結構,即具有暴露于周質的4個跨膜區域[28-29]。雖然他們的結構和序列相似,但只有LolC與LolA產生交聯產物,表明LolA特異性地與LolC相互作用[22]。圖3揭示了LolC暴露于溶劑的 β-發夾環(the “Hook”)和3個表面殘基(the “Pad”)是如何從周質中捕獲LolA進而使其接收脂蛋白[30]。另外,當LolCDE結合脂蛋白時,LolA和LolC的互作增強,然而LolA和LolE之間沒有發生相互作用[26]。LolA脂蛋白復合物與LolB的相互作用不受游離LolA的抑制[30-31],這些結果說明脂蛋白的結合影響Lol蛋白之間的互作。LolCDE對ATP的依賴性隨著脂蛋白結合而增加[32]。所有的這些調整對于脂蛋白從內膜單方向轉運到外膜的效率來說是非常重要的。
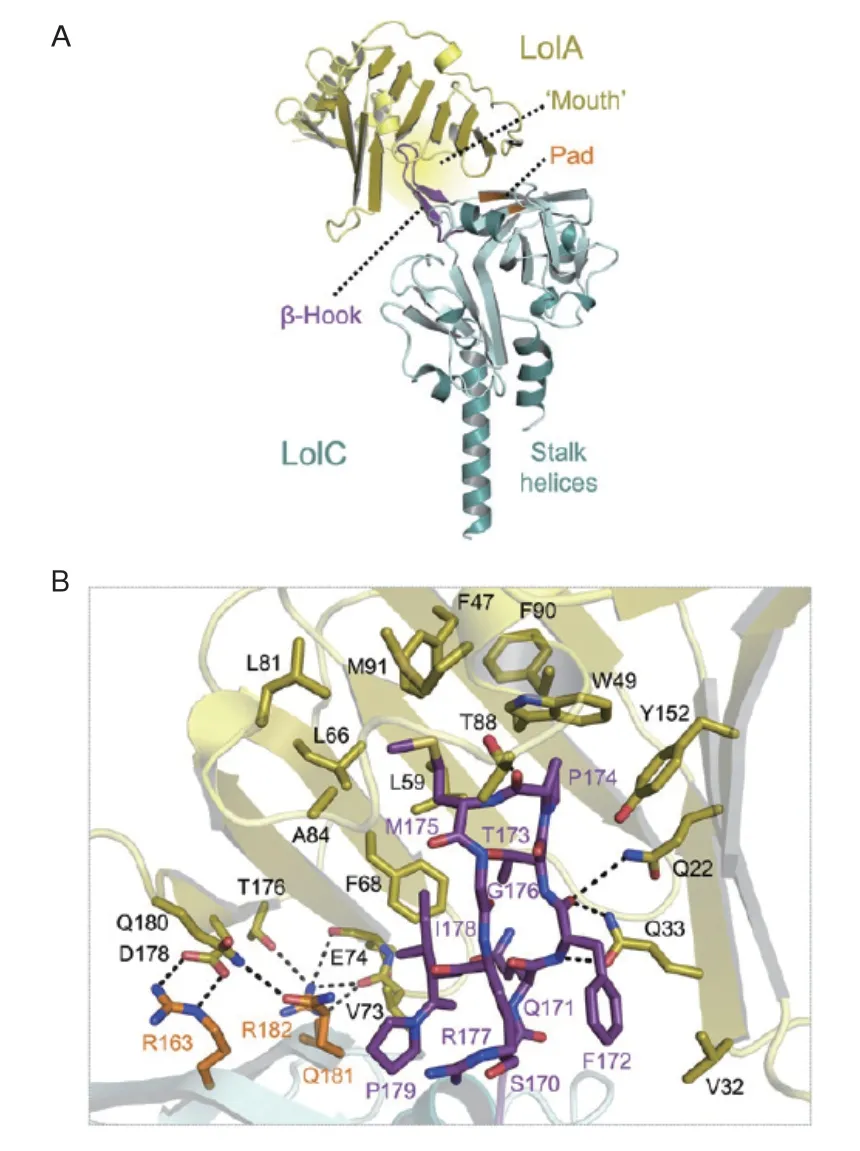
圖3 LolA的晶體結構與LolC的周質域結合[30]Fig. 3 Crystal structure of LolA is combined with the periplasmic domain of LolC[30]
2.2 LolA與LolB的相互作用
使用體內光交聯技術應用于Lol系統,進而闡明脂蛋白如何通過Lol蛋白從內膜轉移到外 膜[26]。該技術能夠將非天然的光敏氨基酸對苯甲酰基-苯丙氨酸(pBPA)引入到琥珀酸密碼子(TAG) 中[33-34]。以琥珀酸突變的Lol蛋白及其靶蛋白為載體,用紫外光照射細胞進行體內光交聯。對交聯產物的分析表明,LolA和LolB在各自疏水腔的入口處發生相互作用[35]。脂蛋白的相互作用位點僅位于LolA和LolB的空腔內,表明它們的疏水腔是脂蛋白酰基鏈的結合位點。NMR分析也發現了LolA和LolB之間類似的作用模式[36](圖4)。當LolA-脂蛋白復合物穿過周質到達OM,脂蛋白將以“mouth to mouth”的方式從LolA轉移到LolB。LolB本身是OM特異性脂蛋白[37-39]。脂蛋白從LolA轉移到LolB不需要外源性能量,這種反應是由LolA和LolB對脂蛋白親和力的差異驅動,即脂蛋白對LolB的親和力高于對LolA的親和力,固定在OM內小葉上的LolB接受來自LolA的脂蛋白,然后將其轉移到OM[36]。
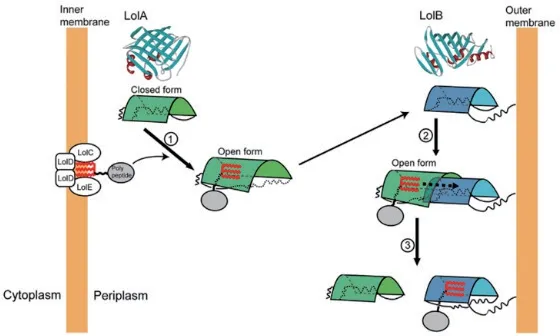
圖4 脂蛋白在LolA和LolB上的轉運模型[36]Fig. 4 Transport model of lipoprotein on LolA and LolB[36]
3 細胞周質伴侶LolA功能
3.1 LolA在脂蛋白外膜定位及脂蛋白分類中的重要作用
Matsuyama等[16]對脂蛋白外膜定位(Lol)系統的研究解決了脂蛋白如何轉運的難題 。研究發現原生質體分泌各種周質和疏水性β-桶外膜蛋白到外部環境中,而外膜特異性脂蛋白(如Lpp蛋白)仍錨定在原生質體的內膜上。嘗試在外部培養基中添加周質組分的情況下,Lpp也能夠分泌到外部培養基中[26]。從細胞周質成分中純化了能夠釋放Lpp的活性物質,檢測到一種水溶性蛋白LolA。此后研究發現LolA也可以釋放其它外膜特異性脂蛋白,如Pal、BamC、Slp以及RlpA,內膜特異脂蛋白AcrA和NlpA仍保留在內膜原生質體上,這些結果充分說明脂蛋白釋放步驟對于脂蛋白向外膜的轉運非常重要。
原生質體釋放的脂蛋白與LolA形成1∶1的水溶性復合體[26]。LolA的缺失會導致嚴重的生長缺陷,并損害外膜脂蛋白Lpp和Pal的外膜定位。盡管LolA缺失并不能立即阻止缺乏Lpp的細胞的生長,但染色體lolA基因的破壞對Lpp菌株是致命的,這表明LolA是脂蛋白外膜定位所必需的[40]。另外將LolA(R43L)中43位的Arg突變為Leu,可接受來自LolCDE的脂蛋白,但不能將其轉移到LolB,突變導致LolA與脂蛋白的疏水相互作用顯著增加,從而導致LolA-脂蛋白復合物在周質中的積聚[41],因此LolA在脂蛋白的分類和外膜定位中都起著重要的作用。
3.2 LolA在脂蛋白釋放中的重要作用
蛋白突變體LolA(I93C/F140C)衍生物中,Cys取代了位于93位的Ile和140位的Phe,由于兩個Cys殘基之間的化學分子內二硫化物的缺失,該衍生物強烈抑制了菌株的生長。研究發現I93C/F140C的表達可激活Cpx雙組分系統,對細胞包膜應激作出反應,Cpx系統是大腸桿菌的5個包膜應激反應系統之一,通過形成二硫鍵使疏水性口袋關閉,阻斷了脂蛋白的轉運[25]。研究發現該突變體的表達強烈誘導了lolA基因的轉錄。LolA或LolB蛋白的缺失也觸發了lolA基因的轉錄。LolA(I93C/F140C)揭示空腔蓋子的打開和關閉是脂蛋白從LolCDE持續轉移到LolA的關鍵。另外LolA和LolCDE促進ATP依賴的外膜定向脂蛋白從大腸桿菌內膜釋放[42]。第47位Phe突變為Glu的LolA(F47E)突變體在由LolCDE重構的球質體和蛋白脂質體中釋放脂蛋白方面存在缺陷。當與含有LolCDE的蛋白脂質體孵育時,LolA保留在上清中,而LolA(F47E)結合到蛋白脂質體上。LolA(F47E)與LolCDE的緊密聯系導致了體內顯性的負表型,揭示LolA和LolCDE的相互作用對脂蛋白的釋放至關重要[43]。
3.3 LolA作為周質脂轉運蛋白和細胞生長必需因子
當缺失LolA時,外膜特異性脂蛋白在大腸桿菌細胞的內膜上逐漸積累[26]。因此,在將疏水外膜特異脂蛋白穿過親水周質轉運到外膜這一過程中,LolA起到關鍵作用。此外,敲除lolA基因的菌株在耗盡LolA條件下會在內膜中積累OM脂蛋白,并且此菌株只能在特殊環境下生存[40],證實了LolA在體內作為周質脂蛋白轉運和細胞生長的必需因子的作用。另外,LolAB在野生型細胞中的基本功能是提供一種有效的運輸途徑,減輕由OM脂蛋白錯誤定位到IM引起的毒性。當LolAB途徑耗盡時,發現了兩種OM靶向脂蛋白能殺死細胞:Lpp與IM形成有毒的PG交聯;OsmB則可能在IM上形成孔,損耗質子動力殺死細胞[44]。因此,LolA是疏水外膜脂蛋白通過親水性周質空間向外膜轉運的關鍵因素。
4 細胞周質伴侶LolA抑制劑
細胞外膜OM是一種獨特的結構,對抗生素等有毒分子起著很強的滲透屏障作用[45],破壞OM完整性的化合物有望降低OM的屏障功能,從而提高現有抗生素的效率。鑒于OM脂蛋白是OM組裝的必要成分,且LolA在脂蛋白轉運、外膜定位及分類的重要作用,LolA抑制劑的研發將為開發新的藥物來克服革蘭氏陰性菌的抗生素耐藥性提供新的思路。最新研究表明,MAC12343(MAC)及其降解產物S-(4-chlorobenzyl)isothiourea和3,4-dichlorobenzyl carbamimidothioate等疏水小分子能夠與LolA結合并在體內對其抑制,使大腸桿菌外膜更具滲透 性[46-47]。Braun lipoprotein(BLP)是大腸桿菌中含量最豐富的蛋白質通過一個脂質部分錨定在外膜上,其N端有3個烴尾,在C端共價結合在細胞壁肽聚糖上[48-49]。迄今為止,BLP是唯一已知的共價結合在細胞壁上的蛋白質,為細胞包膜提供穩定性。
研究表明,小分子MAC13243及其降解產物很容易結合到LolA的特定空腔內。即使空腔已被3個MAC分子占據,BLP脂尾也能與空腔結合,只是沒有小分子存在時,脂尾與空腔結合的較弱。在腔內,BLP尾部和MAC分子相互纏繞(圖5)。有趣的是,當BLP單獨與腔體結合時,LolA會發生構象變化,這為BLP和LolA之間提供了穩定作用,MAC及其降解產物通過降低BLP對LolA的親和力抑制LolA,這樣MAC- BLP復合物就可以在到達LolB之前從LolA中脫落[47],從而降低LolA轉運效率破壞OM完整性,使細菌更具滲透性,從而提高抗生素效率。
圖5 LolA疏水腔中BLP的結合模式[47]Fig.5 Binding mode of BLP in the hydrophobic cavity of LolA[47]
5 總結與展望
綜上所述,周質伴侶LolA作為脂蛋白轉運和細胞生長的必需因子,在脂蛋白釋放、脂蛋白外膜定位及脂蛋白分類方面發揮重要作用。隨著對脂蛋白LolA晶體結構的深入分析,使得我們對疏水性脂蛋白如何通過Lol系統穿過親水周質有了更清晰的認識[18]。基于生化實驗驗證結果,LolA蛋白的疏水腔的打開和關閉在脂蛋白轉運中起關鍵作用[25,50]。此外,當用LolCDE抑制劑處理大腸桿菌時,發現LolCDE復合物亞基的轉錄水平沒有增加。然而,在較高濃度的抑制劑作用下,lolA轉錄水平略微增加了3.5倍[50]。由于脂蛋白Lol系統在病原菌中的重要性[51-54],對脂蛋白轉運分子機制的理解將為感染性疾病的治療提供更多的藥物靶點。
抗生素耐藥性是一個重大的公共健康威脅。多重耐藥革蘭氏陰性菌由于其對抗菌化合物的內在滲透性較低,以及廣泛存在的多藥外排泵而面臨著特殊的挑戰。Pathania等[51]首次通過化學基因組學方法發現了一種以LolA為靶點的新型抗菌化合物MAC13243。MAC13243代表了一種針對細菌中脂蛋白的新型化學探針,并有望作為革蘭氏陰性選擇性的新型藥物,先導MAC13243的亞致死濃度會導致LolA分子伴侶的部分抑制。這導致外膜脂蛋白部分保留在內膜上,這些錯誤靶向的脂蛋白中的一些直接與外膜生物發生有關,例如LolB(插入脂蛋白),BamB(插入β-桶蛋白)和LptE(插入LPS分子),因此,LolA的部分消耗可以直接影響外膜關鍵成分的生物發生,從而削弱膜并導致通透性增加。可利用MAC13243處理的細胞所增加的通透性來增加大支架抗生素如新生霉素和紅霉素的吸收[46]。對耐多藥銅綠假單胞菌有一定的抑制作用,對開發生物系統的新化學探針和治療疾病的新藥物的研發有重要作用。
近期研究表明,在缺乏底物的菌株中,當定位錯誤時,可以通過激活包膜應激反應繞過LolA和LolB而不會影響必需脂蛋白的運輸。這意味著這些蛋白質在脂蛋白轉運中不執行機械運輸步驟。相反,這些蛋白質的關鍵功能是防止錯誤定位的脂蛋白的致命積累[44,55]。由此推斷出LolAB的出現可能是為了提高運輸效率和運輸能力。隨著對LolA更加深入的了解,如何抑制LolA功能降低脂蛋白的轉運效率從而降低外膜完整性,將對提高抗生素效率、降低抗生素抗性具有重要意義。Flavobacterium johnsoniae(擬桿菌門)中LolA的突變會導致細菌的滑動能力喪失,這與LolA在幾種已知有助于滑動機制的BaLpp定位中的作用一致。BaLpp生物合成途徑特性表明,該途徑可能為新型抗生素提供一個潛在靶點[56-57]。此外,抑制絲狀線蟲內共生體中BaLpp的生物合成,可能是預防全球重要寄生蟲引起的疾病的一個靶點[57]。目前還沒有LolA或LolB結合BLP或抑制劑分子的結構,因此,BLP的結合模式是未知的,而且一些重要的問題仍然沒有得到解答,例如BLP與LolA的空穴結合的深度問題,空腔中可容納多少酰基鏈?此外,通過阻止小分子進入疏水腔來抑制LolA的機理沒有直接的結構或分子基礎。因此對于LolA結合抑制劑機制的進一步闡明,不但有助于人們了解抑制劑的具體作用機制,針對脂蛋白的釋放過程篩選新型藥物,也有助于尋求新的抗生素靶點,以解決日益增長的抗生素抗性問題。
前期大量研究顯示,對LolA功能的研究主要集中在脂蛋白的分類、釋放、轉運以及外膜定位等方面,但也有研究證明LolA突變體在多種膜擾動劑的存在下表現出顯著的細菌粘附、胞外酶產生、毒性和耐受性的降低,突變體的這些表型變化可以通過完整lolA基因的表達回復至野生型水平[58],這項研究結果為細菌LolA的功能提供了新的見解。此外,本實驗室在研究極端微生物的抗逆分子機理的過程中,發現來源于抗逆模式微生物耐輻射異常球菌的LolA同源蛋白參與細胞的非生物脅迫抗性過程。通過基因突變獲得lolA基因突變體,開展非生物脅迫實驗發現,該基因突變導致細菌在鹽和氧化脅迫條件下的生存能力下降(數據未發表),表明LolA蛋白可能參與了細菌的耐鹽抗氧化過程,推測周質分子伴侶蛋白LolA在細菌耐受非生物脅迫過程中也發揮重要作用。周質分子伴侶蛋白LolA可能通過調節未知的調控途徑(如雙組分信號轉導系統)來影響編碼多種毒力相關功能的基因的表達。但是,需要進一步研究可能編碼在lolA突變后激活的未知調控途徑的候選基因,以驗證這種可能性。

