膠孢炭疽菌細胞骨架熒光標記菌株的構(gòu)建
劉娜 劉世科 王倩男
(海南大學熱帶作物學院 海南省熱帶生物資源可持續(xù)利用重點實驗室,海口 570228)
膠孢炭疽菌(Colletotrichum gloeosporioides)寄主廣泛,其多個不同的生理小種能夠侵染諸如橡膠樹、香蕉、火龍果、香瓜、西瓜等多種經(jīng)濟作物,是造成農(nóng)業(yè)減產(chǎn)的主要病害之一。深入研究膠孢炭疽菌的致病力機制,有助于新型防控措施的開發(fā)。
細胞極性的確立和維持在真核生物的形態(tài)發(fā)生過程中起著重要的作用。絲狀真菌的分生孢子萌發(fā)后,菌絲呈現(xiàn)出明顯的極性生長現(xiàn)象[1-3]。在這個極性生長過程中,細胞壁及細胞膜前體物質(zhì)、細胞器以及囊泡等不斷運輸匯集到菌絲頂端的特殊結(jié)構(gòu)(spitzenk?rper,Spk)[4]。Spk由密集的囊泡、細胞骨架、核糖體及其他多種物質(zhì)組成[5-6];與此同時,Spk介導的菌絲頂端胞外物質(zhì)分泌也與真菌的生長發(fā)育及致病力密切相關(guān)[7-8]。雖然目前關(guān)于Spk的形成及其機制還尚不清楚,但是普遍認為細胞骨架在其中起著重要作用。細胞骨架廣泛存在于真核生物的細胞質(zhì)及細胞核中。細胞骨架在細胞分裂、細胞生長等多項生理活動中具有重要的功能。細胞質(zhì)骨架主要包括微絲、微管和中間纖維,其中關(guān)于微絲和微管的研究較多。微絲(microfilament)是由單體肌動蛋白(actin)呈螺旋狀排列組裝而成;微管(microtubule)是由α-微管蛋白(tubulin)和β-微管蛋白通過非共價鍵連接組成的中空管狀結(jié)構(gòu)。在細胞內(nèi),微絲和微管均處于聚合和解聚的高度動態(tài)循環(huán)中,而這一動態(tài)過程分別受一系列微絲結(jié)合蛋白(actin binding protein,ABP)和微管結(jié)合蛋白(microtubule associated protein,MAP)的精密調(diào) 控[9-10]。至今為止,尚未有關(guān)膠孢炭疽菌細胞骨架研究的相關(guān)報道。
Lifeact是來自出芽酵母(Saccharomyces cerevisiae)ABP140(actin binding protein 140)一段17個氨基酸的多肽,其序列被廣泛用作真核生物細胞內(nèi)微絲骨架標記探針[11-12],已有研究結(jié)果表明Lifeact能很好的標記出稻瘟菌、灰霉菌等真菌細胞中的微絲骨架結(jié)構(gòu)[13-14]。而在微管研究中發(fā)現(xiàn),鼠微管相關(guān)蛋白MAP4(microtubule associated protein 4)的微管結(jié)合結(jié)構(gòu)域MBD(microtubule binding domain)能很好的標記出植物細胞內(nèi)微管的結(jié)構(gòu)[12,15]。因此,本研究構(gòu)建了增強型綠色熒光蛋白EGFP(enhanced green fluorescent protein)與Lifeact及MBD的融合表達載體,將其轉(zhuǎn)化膠孢炭疽菌并獲得了相應(yīng)的重組菌株。與此同時,還在膠孢炭疽菌β-微管蛋白(β-tubulin)編碼基因(CgTUB1)后面原位敲入了EGFP的編碼序列,構(gòu)建了CgTUB1-EGFP標記菌株。顯微觀察及生理表型分析結(jié)果表明,所構(gòu)建的Lifeact-EGFP及CgTUB1-EGFP的重組菌株的微絲及微管骨架標記清晰,為進一步研究膠孢炭疽菌細胞骨架的動態(tài)變化及骨架結(jié)合蛋白的功能奠定基礎(chǔ)。
1 材料與方法
1.1 材料
1.1.1 供試菌株 橡膠樹膠孢炭疽菌野生型菌株由本實驗室分離保存,并在前期工作中完成該菌株的基因組測序工作。
1.1.2 實驗試劑 實驗所用基因表達載體pPgTH由本實驗室改造,以pMD19-T為骨架,在Pst I和Xba I位點處連入構(gòu)巢曲霉3-磷酸甘油醛脫氫酶基因的啟動子PgpdA,在Sac I和EcoR I處連入構(gòu)巢曲霉色氨酸合成基因trpC的終止子(TtrpC)及潮霉素磷酸轉(zhuǎn)移酶抗性基因(HPT)。PCR引物合成及DNA測序由華大基因及擎科生物公司完成。DNA聚合酶、DNA Marker及大腸桿菌感受態(tài)均購自北京全式金公司,限制性內(nèi)切酶及T4 DNA連接酶購自Thermo Scientific公司,膠回收試劑盒、質(zhì)粒提取試劑盒購自天根公司。羧芐青霉素、卡那霉素購自索萊寶公司,潮霉素購自Roche公司,其它化學試劑采用國產(chǎn)分析純。膠孢炭疽菌的培養(yǎng)使用土豆浸膏培養(yǎng)基 (PDA,PDB)及基本培養(yǎng)基(minimal medium)。
1.2 方法
1.2.1 微絲骨架標記載體的構(gòu)建 采用隨機重組原理敲入標記基因,具體策略如圖1-A所示,將Lifeact與綠色熒光蛋白EGFP的融合編碼序列Lifeact-EGFP連入基因表達載體pPgTH的Xba I和Sac I位點,構(gòu)建微絲標記載體。
1.2.2 微管骨架標記載體的構(gòu)建 分別采用隨機重組原理及同源重組原理等兩種策略構(gòu)建兩種微管骨架標記載體[16]。(1)將鼠MAP4的微管結(jié)合結(jié)構(gòu)域MBD與綠色熒光蛋白EGFP的融合編碼序列MBDEGFP連入載體pPgTH的Xba I和SacI位點,構(gòu)建微管標記載體(圖1-B)。(2)將膠孢炭疽菌β1 tubulin DNA序列CgTUB1的3'端序列(去除終止密碼子,853 bp)連入載體pPgTH的Xba I和Kpn I位點,將EGFP編碼序列連入Kpn I和Sac I位點,再使用引物CgTub-SF/hph-splR將這兩個片段與潮霉素抗性基因編碼序列(HPT)的5'端序列PCR擴增備 用,所得產(chǎn)物為左側(cè)敲除片段;之后將HPT的3'端序列與CgTUB1的下游序列(flanking region,804 bp)進行融合PCR擴增備用,所得產(chǎn)物為右側(cè)敲除片段;最后將兩個敲除片段共同轉(zhuǎn)化野生型菌株,將CgTUB1 DNA的3'端序列作為上游同源臂、CgTUB1的下游序列作為下游同源臂,利用同源重組原理將EGFP編碼序列原位敲入CgTUB1的下游,構(gòu)建敲入重組菌株(圖1-C)。
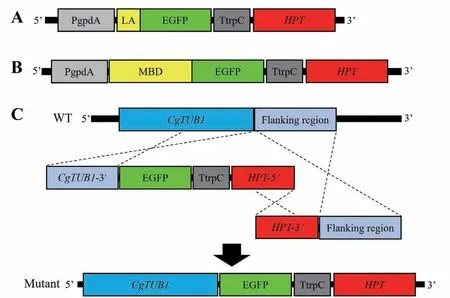
圖1 細胞骨架熒光標記載體原理圖Fig. 1 Diagram of fluorescent labeled cytoskeleton vectors
1.2.3 原生質(zhì)體轉(zhuǎn)化 橡膠樹膠孢炭疽菌原生質(zhì)體的制備及轉(zhuǎn)化參照文獻[3]所述方法進行。在轉(zhuǎn)化前,將Lifeact-EGFP、MBD-EGFP及CgTUB1-EGFP標記載體用Pst I進行酶切線性化處理。
1.2.4 重組菌株的鑒定 本實驗中采用潮霉素(300 μg/mL)篩選轉(zhuǎn)化子。待轉(zhuǎn)化、再生培養(yǎng)后,將陽性轉(zhuǎn)化子轉(zhuǎn)接到PDA培養(yǎng)基進行擴大培養(yǎng),并提取其基因組DNA進行PCR鑒定。對于轉(zhuǎn)化過Lifeact-EGFP或MBD-EGFP的轉(zhuǎn)化子,以其基因組為模板,分別擴增其基因組中是否已經(jīng)轉(zhuǎn)入目標序列。對于CgTUB1-EGFP轉(zhuǎn)化子,為了檢測敲入重組菌株中EGFP編碼序列是否重組到CgTUB1基因后面,本實驗中采用兩輪PCR檢測方法鑒定轉(zhuǎn)化子,在重組片段中的上游同源臂的外側(cè)及EGFP序列中設(shè)計一對檢測引物CgTub-JCF/EGFP-R;同理,再在下游同源臂的外側(cè)及抗性基因HPT序列中設(shè)計一對檢測引物HPT-JCF/CgTub-JC3R;通過PCR擴增檢測重組片段是否正確整合到目標基因的位點(表1)。在獲得以上所述3種陽性重組菌株后,通過單孢分離對篩選到的重組菌株進行分離純化。
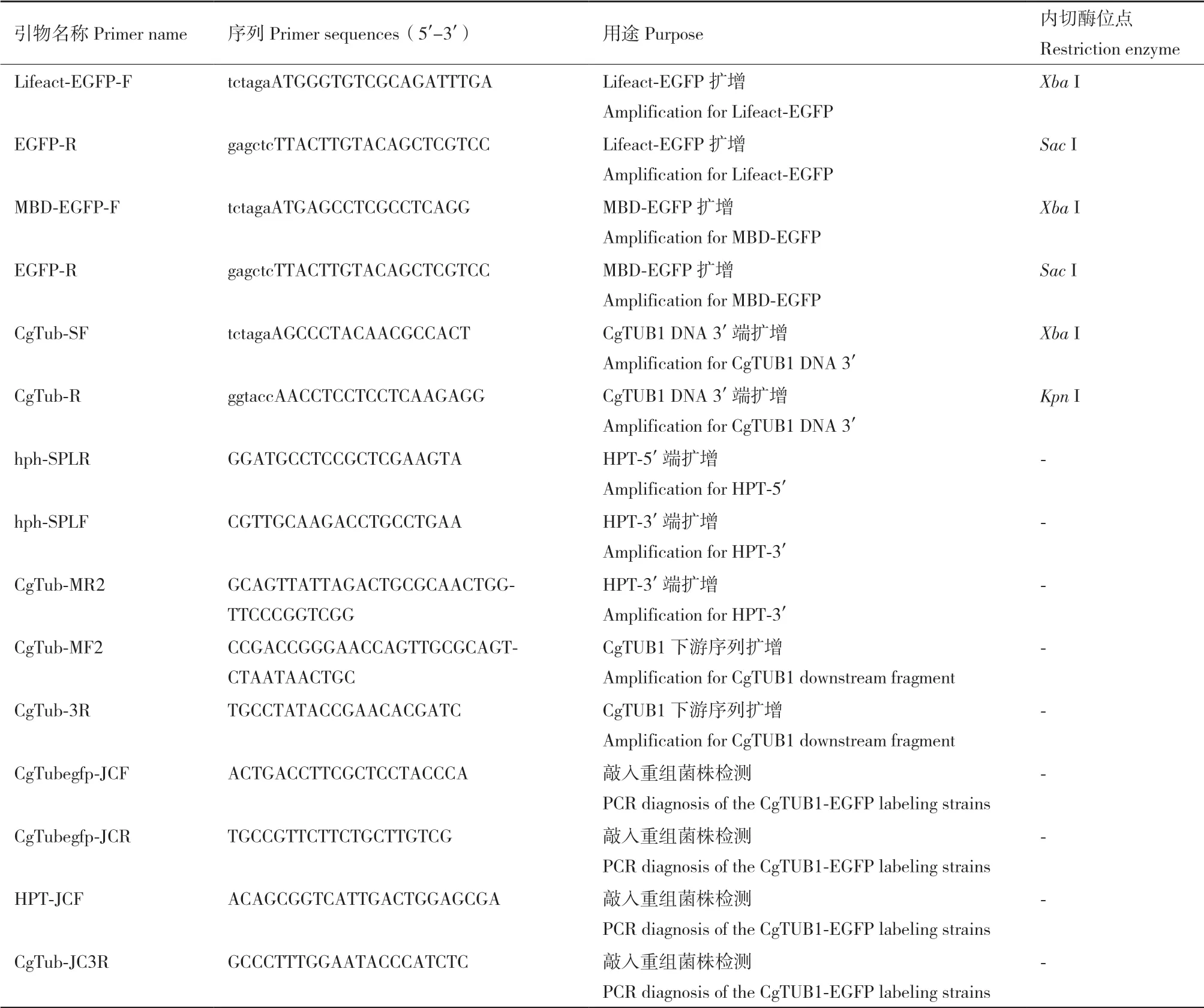
表1 本實驗所用引物Table 1 Primers used in this study
1.2.5 激光掃描共聚焦顯微鏡觀察重組菌株中細胞骨架 將獲得的純合體重組菌株接種于PDB培養(yǎng)基中,28℃震蕩培養(yǎng)2 d后,過濾收集孢子,用ddH2O洗滌2遍后重懸,再于激光共聚焦顯微鏡下觀察孢子內(nèi)微絲或微管骨架的分布情況。與此同時,將上述孢子接種于新鮮的PDB培養(yǎng)基中,震蕩培養(yǎng)24 h后,于激光共聚焦顯微鏡下觀察菌絲內(nèi)微絲或微管骨架的分布情況。所有熒光圖片均采自Leica SP8激光掃描共聚焦熒光顯微鏡。EGFP由Argon 激光器488 nm通道激發(fā),檢測的發(fā)射波長范圍是505-540nm。靜態(tài)層掃圖片的步距為0.5 μm。所有圖片均通過Image J 軟件進行后期疊加及處理。
1.2.6 生長速率及產(chǎn)孢量檢測 參照文獻[3]所述方法進行。
1.2.7 致病力分析 參照文獻[3]所述方法進行。每個處理共包含30片葉片,分為3組。本實驗共重復2次。
2 結(jié)果
2.1 重組菌株的鑒定
膠孢炭疽菌原生質(zhì)體轉(zhuǎn)化后分別獲得了多個具有潮霉素抗性的陽性轉(zhuǎn)化子。接著將轉(zhuǎn)化子轉(zhuǎn)接到PDA平板進行培養(yǎng),提取其DNA,并利用PCR檢測各轉(zhuǎn)化子。實驗中共獲得了多個Lifeact-EGFP及MBD-EGFP表達載體轉(zhuǎn)化子;分別隨機挑取4個轉(zhuǎn)化子,并用PCR擴增檢測其基因組中是否已轉(zhuǎn)入Lifeact-EGFP或MBD-EGFP片段。結(jié)果這兩組轉(zhuǎn)化子均能檢測到目標片段(圖2-A,B),表明標記重組菌株構(gòu)建成功,分別將這兩組重組菌株命名為PgpdA∷Lifeact-EGFP和PgpdA∷MBD-EGFP。與此同時,挑取了10個CgTUB1-EGFP基因敲入重組轉(zhuǎn)化子,并對轉(zhuǎn)化子進行兩輪PCR檢測。結(jié)果有3個轉(zhuǎn)化子能夠同時成功擴增出1 722 bp、1 648 bp大小的目標條帶(圖2-C,D),且PCR產(chǎn)物測序結(jié)果也與預期結(jié)果一致,表明這3個轉(zhuǎn)化子均已在CgTUB1的DNA序列后面敲入了EGFP編碼序列,因此將這3個轉(zhuǎn)化子命名為CgTUB1-EGFP。之后通過單孢分離,分別獲得了PgpdA∷Lifeact-EGFP、PgpdA∷MBD-EGFP和CgTUB1-EGFP的純合體重組菌株。
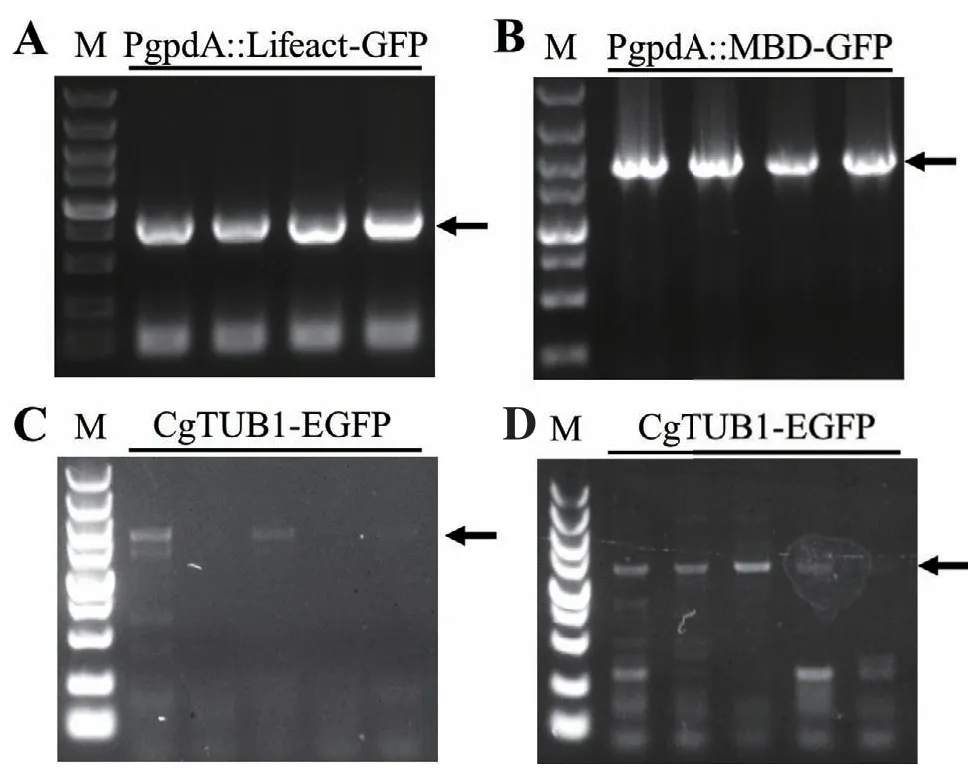
圖2 細胞骨架熒光標記重組菌株的PCR鑒定Fig. 2 PCR diagnosis of cytoskeleton labeling recombinant strains
2.2 重組菌株細胞骨架觀察
將上述獲得的PgpdA∷Lifeact-EGFP純合體重組菌株制片后置于共聚焦顯微鏡下觀察其微絲骨架。結(jié)果發(fā)現(xiàn)在其孢子及菌絲細胞內(nèi)均能檢測到明顯的熒光,并且與只表達EGFP的對照菌株相比,重組菌株孢子內(nèi)微絲主要以點狀信號分布,也有少量絲狀結(jié)構(gòu)存在(圖3)。在菌絲中,可在其頂端觀察到明顯的微絲聚集現(xiàn)象,呈明顯的極性分部;此外在細胞中間部位,也能觀察到絲狀結(jié)構(gòu)(圖4)。以上結(jié)果表明Lifeact-EGFP能夠較好的標記膠孢炭疽菌的微絲骨架。隨后,選擇了其中一株熒光強度較高的重組菌株進行后續(xù)研究。
將上述獲得的PgpdA∷MBD-EGFP及CgTUB1-EGFP純合體重組菌株制片后置于共聚焦顯微鏡下觀察其微管骨架。結(jié)果發(fā)現(xiàn)PgpdA∷MBD-EGFP菌株細胞內(nèi)熒光強度極低,難以觀測到其孢子及菌絲內(nèi)部的微管骨架結(jié)構(gòu)(結(jié)果未展示);而CgTUB1-EGFP標記重組菌株的孢子及菌絲細胞內(nèi)均能檢測到明顯的熒光。如圖3所示,與對照菌株相比,標記菌株孢子內(nèi)的微管主要呈點狀和絲狀結(jié)構(gòu)。在菌絲內(nèi)部微管也呈現(xiàn)出較明顯的極性分布現(xiàn)象,此外,微管主要以點狀和絲狀分布于菌絲中間(圖4)。以上結(jié)果表明CgTUB1-EGFP能較好的標記微管骨架。隨后,選擇了其中一株熒光強度較高的CgTUB1-EGFP重組菌株進行后續(xù)研究。
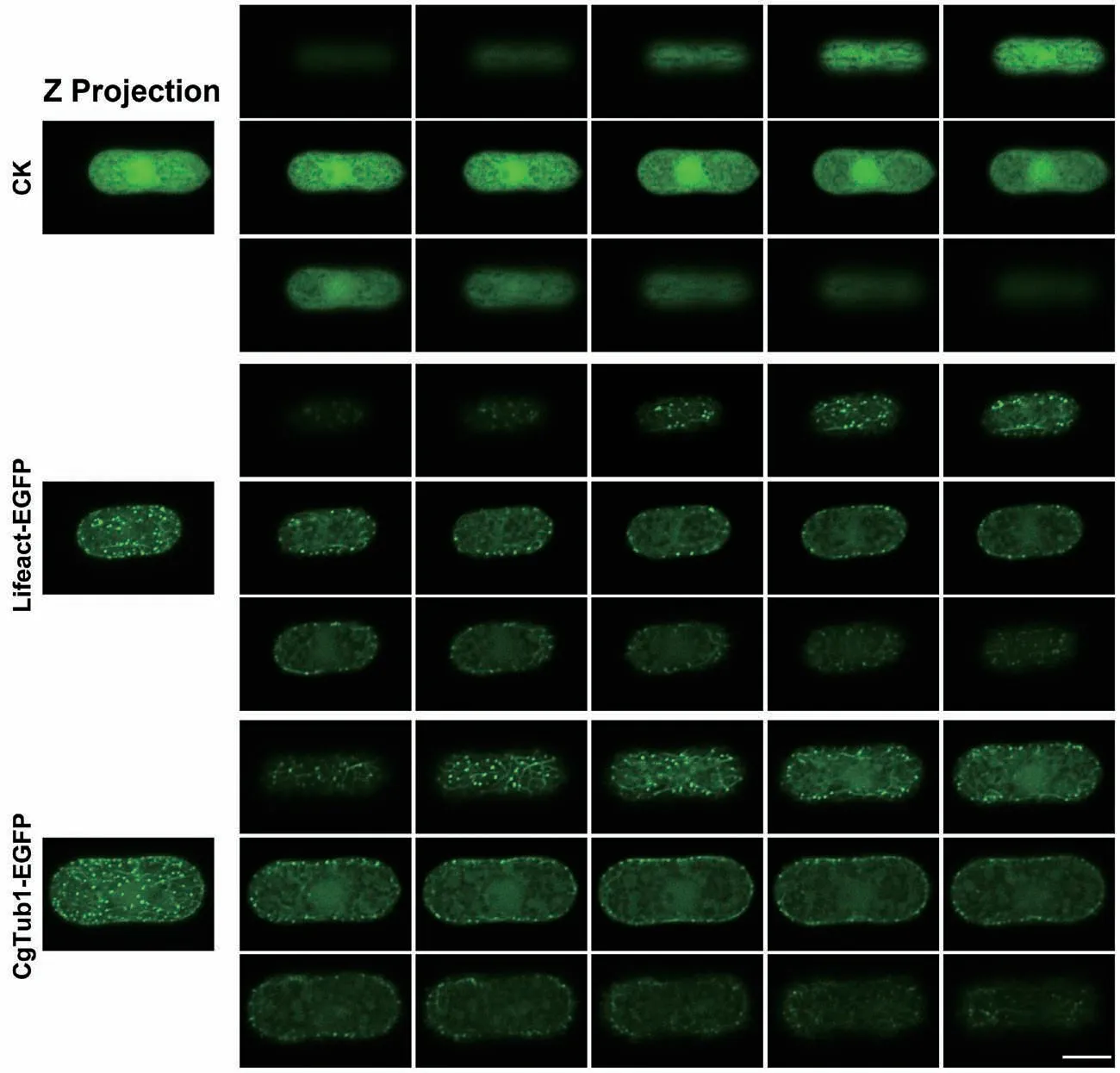
圖3 熒光標記重組菌株孢子中的細胞骨架結(jié)構(gòu)Fig. 3 Cytoskeleton structure in conidiophores of fluorescent labeled recombinant strains
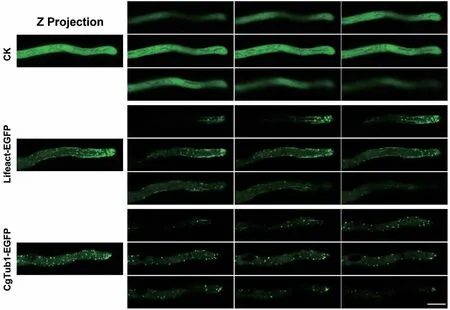
圖4 熒光標記重組菌株菌絲中的細胞骨架結(jié)構(gòu)Fig. 4 Cytoskeleton structure in the hypha of fluorescent labeled recombinant strains
2.3 重組菌株生長速率及產(chǎn)孢量檢測
在PDA培養(yǎng)基中培養(yǎng)時,PgpdA∷Lifeact-EGFP、CgTUB1-EGFP重組菌株與野生型菌株相比,其菌落生長速率及菌落形態(tài)都沒有顯著差別(圖5-A),在培養(yǎng)4 d后,菌落直徑均約為6 cm。與此同時,在液體PDB培養(yǎng)基中培養(yǎng)3 d后,重組菌株的產(chǎn)孢量與野生型相比也沒有顯著變化,孢子產(chǎn)量都約為35×105個/mL(圖5-B)。
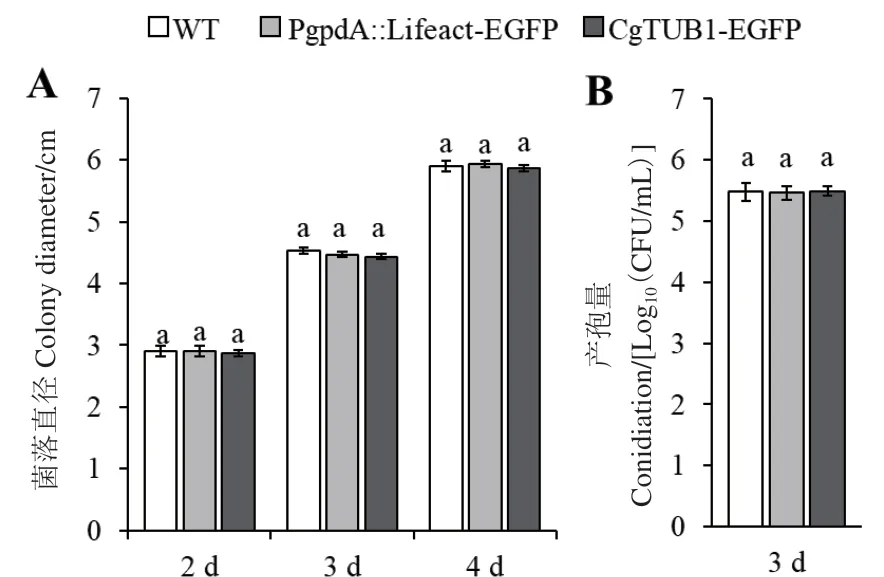
圖5 野生型菌株與重組菌株菌落直徑及產(chǎn)孢量Fig. 5 Clony diameters and conidiations of WT and mutant strains
2.4 重組菌株致病力分析
將PgpdA∷Lifeact-EGFP、CgTUB1-EGFP重組菌 株與野生型菌株同時接種橡膠樹葉片。在接種后,重組菌株與野生型菌株均能侵染橡膠樹葉片并造成病斑;與此同時,在接種2 d及3 d后,重組菌株與野生型菌株形成的病斑直徑均約為10 mm及20 mm(圖6)。表明重組菌株與野生型菌株致病力沒有明顯差異。

圖6 接種野生型菌株與重組菌株后橡膠樹葉片的發(fā)病情況及病斑直徑Fig. 6 Virulence assay on rubber tree leaves and lesion diameter after inoculation with WT and recombinant strains
3 討論
細胞骨架廣泛存在于真核生物細胞中,并在其形態(tài)建成、物質(zhì)運輸與極性生長等方面有著重要的功能。絲狀真菌的生長和發(fā)育主要依賴菌絲尖端的極性生長,而這種極性生長受到細胞內(nèi)骨架的嚴格調(diào)控[17-18]。近年來,越來越多的研究揭示了細胞骨架的結(jié)構(gòu)及其動態(tài)變化在絲狀真菌形態(tài)發(fā)生與致病過程中的作用[19-21]。因此,要研究膠孢炭疽菌中細胞骨架結(jié)構(gòu)及其動態(tài)變化及相關(guān)蛋白功能,對胞內(nèi)細胞骨架進行熒光標記和活體細胞觀察是必要的。由于actin-GFP(green fluorescent protein)難以加入到聚合的微絲中,若直接對actin進行熒光標記還會導致單體肌動蛋白被標記且呈現(xiàn)較強熒光背景[22]。此外,actin-GFP的表達嚴重影響了盤基網(wǎng)柄菌細胞(Dictyostelium)的胞質(zhì)分裂等生理生化活動[22]。目前對于微絲骨架的活體細胞成像來說,主要通過微絲結(jié)合蛋白來標記F-actin,如擬南芥AtFIM1的微絲結(jié)合結(jié)構(gòu)域ABD2[23],以及酵母ABP140的一段僅17個氨基酸的保守結(jié)構(gòu)域Lifeact[24-29]。Delgado-Alvarez的相關(guān)研究表明,通過對粗糙脈孢霉(Neurospora crassa)多個微絲結(jié)合蛋白及其結(jié)構(gòu)域與綠色熒光蛋白GFP進行融合表達,構(gòu)建了多種熒光標記菌株:Fimbrin-GFP,ARP3-GFP,tropomyosin-GFP,Lifeact-GFP;結(jié)果發(fā)現(xiàn)不同的熒光標記菌株能標記出菌絲內(nèi)不同的微絲骨架結(jié)構(gòu),但Lifeact-GFP能較好的標記出菌絲不同部位的多種結(jié)構(gòu)[30]。此外,Lifeact也被廣泛用于其他真菌胞內(nèi)微絲骨架的標記[13,31-33]。在此基礎(chǔ)上,本研究構(gòu)建了PgpdA∷lifeact-EGFP表達載體,通過膠孢炭疽菌原生質(zhì)體轉(zhuǎn)化成功構(gòu)建了重組菌株,并對微絲骨架的三維立體結(jié)構(gòu)進行了活體觀察。結(jié)果表明,在膠孢炭疽菌中微絲主要以點狀信號分布于孢子中,以點狀和絲狀結(jié)構(gòu)分布于菌絲中,且呈現(xiàn)出明顯的極性分布現(xiàn)象,這一結(jié)果也與其它真菌中觀察到的結(jié)果相類似[13,30]。在絲狀真菌中,點狀微絲結(jié)構(gòu)是細胞內(nèi)吞作用的標志[34]。稻瘟菌中菌絲頂端點狀微絲結(jié)構(gòu)的減少會導致胞吞作用明顯延遲,效應(yīng)因子分泌受阻,致病力受到嚴重的影響[35]。
而對于微管骨架,常用小鼠MAP4的MBD與熒光蛋白融合進行標記[15,36],或直接用tubulin與熒光蛋白融合來標記動植物細胞中的微管骨架[37];但是在不同生物的不同組織中,兩種標記方法的效果不盡相同。在構(gòu)巢曲霉(Aspergillus nidulans)中,利用GFP-TUA(α-tubulin)菌株來觀察菌絲中的微管骨架結(jié)構(gòu)[38-39]。在粗糙脈孢霉中,β-tubulin-GFP被用來標記胞內(nèi)的微管骨架[40]。在禾谷鐮刀菌(Fusarium graminearum)中,多用FgTub1-GFP及FgTub2-GFP來標記胞內(nèi)的微管骨架[21,41-42]。在本研究中分別使用了兩種方法對膠孢炭疽菌的微管結(jié)構(gòu)進行標記:構(gòu)建了PgpdA∷MBD-EGFP-TtrpC表達載體與CgTUB1基因位點后EGFP敲入載體,并通過原生質(zhì)體轉(zhuǎn)化成功獲得重組菌株。結(jié)果表明,MBD-EGFP標記重組菌株中熒光強度較低,而CgTUB1-EGFP標記重組菌株熒光強度較高;與此同時,在CgTUB1-EGFP重組菌株孢子和菌絲中都可觀察到明顯的點狀和絲狀信號,且在菌絲尖端的微管骨架也呈現(xiàn)出一定的極性分布現(xiàn)象。
為了檢測兩種骨架標記重組菌株是否會對膠孢炭疽菌正常的生理活動產(chǎn)生影響,本研究分別選擇了兩株熒光強度較高的PgpdA∷lifeact-EGFP和CgTUB1-EGFP重組菌株,對其生理表型進行了分析。結(jié)果發(fā)現(xiàn)這兩種細胞骨架的熒光標記并不影響膠孢炭疽菌的生長、產(chǎn)孢及致病力,表明本研究所構(gòu)建的重組菌株能夠用于后續(xù)分析。
絲狀真菌細胞頂端極性的建立、維持都需要細胞骨架的參與,其結(jié)構(gòu)的動態(tài)變化在細胞生長、胞內(nèi)物質(zhì)運輸以及外泌過程中扮演著至關(guān)重要的角色,因而在其致病過程中也發(fā)揮著重要的作用[43]。細胞骨架結(jié)構(gòu)由肌動蛋白、微管蛋白及很多相關(guān)蛋白(ABPs,MAPs)共同調(diào)控。且微管蛋白還是很多真菌殺菌劑的作用靶點[42]。鑒于此,對于膠孢炭疽菌中微絲微管骨架的熒光標記將有利于推動對其菌絲生長及致病過程中細胞內(nèi)骨架分布、動態(tài)變化及其相關(guān)蛋白功能,以及對殺菌劑作用機理的研究。
4 結(jié)論
本研究構(gòu)建了膠孢炭疽菌微絲及微管骨架的標記重組菌株,為今后深入研究膠孢炭疽菌微絲和微管骨架的結(jié)構(gòu)、動態(tài)變化、以及細胞骨架相關(guān)蛋白的功能奠定了良好的基礎(chǔ)。

