α-1抗胰蛋白酶對缺氧/復氧小鼠心肌細胞凋亡的影響
黃達 劉燕 黃蘭松 岑團 劉文靜 潘興壽 黃照河

【摘要】 目的 ?建立小鼠心肌細胞缺氧/復氧模型,觀察α-1抗胰蛋白酶(α-1 antitrypsin,A1AT)對小鼠心肌細胞凋亡的影響。
方法 ?體外采用連二亞硫酸鈉(Na2S2O4)4 mmol/L誘導的缺氧培養基培養小鼠心肌細胞,模擬缺氧/復氧模型,并篩選A1AT最佳干預濃度,篩選A1AT最佳干預濃度實驗分為7個組:Blank組、Control組、H/R組、A1AT 10 μmol/L 組、A1AT 20 μmol/L 組、A1AT 40 μmol/L 組以及A1AT 80 μmol/L 組。篩選最佳干預時間實驗分為8個組:Blank組、Control組、H/R組、A1AT 1 h組、A1AT 2 h組、A1AT 4 h組、A1AT 6 h組及A1AT 12 h組。之后A1AT干預實驗分組:正常組(Control組)、缺氧/復氧組(H/R組)、α-1抗胰蛋白酶干預組(A1AT組)。利用CCK-8檢測細胞功能、流式細胞儀檢測細胞凋亡、免疫熒光及Western Blot 檢測caspase-3的表達。并用SPSS 22.0進行數據統計。
結果 ?A1AT最佳干預濃度為20 μmol/L,最佳干預時間為4小時。流式細胞儀檢測發現H/R組細胞凋亡率增加,A1AT組細胞凋亡率明顯下降,Control組、H/R組及A1AT組三組比較差異有統計學意義( P <0.05)。免疫熒光檢測發現H/R組caspase-3分子表達強陽性,與Control組及A1AT組比較,差異有統計學意義( P <0.05)。Western Blot檢測發現H/R組caspase-3蛋白表達上調,與Control組及A1AT組比較,差異有統計學意義( P <0.05)。
結論 ?α-1抗胰蛋白酶對小鼠缺氧/復氧心肌細胞凋亡具有改善作用。
【關鍵詞】 ?α-1抗胰蛋白酶;Na2S2O4;缺氧/復氧;凋亡;caspase-3
中圖分類號: R363?? ?文獻標志碼: A?? ?DOI: 10.3969/j.issn.1003-1383.2021.08.003
Effects of α-1 antitrypsin on cardiomyocyte apoptosis in hypoxia/reoxygenation mice
HUANG Da, LIU Yan, HUANG Lansong, CEN Tuan, LIU Wenjing, PAN Xingshou, HUANG Zhaohe▲
(Department of Cardiovascular, Affiliated Hospital of ?Youjiang Medical University for Nationalities, Baise 533000, Guangxi, China)
【Abstract】 Objective ?To establish a hypoxia/reoxygenation model of? cardiomyocytes in mice, and observe the effect of α-1 antitrypsin (A1AT) on cardiomyocyte apoptosis in mice.
Methods ?Mouse cardiomyocytes were cultured in vitro by hypoxia medium induced by (Na2S2O4) 4 mmol/L of sodium dithionite, hypoxia/reoxygenation model was simulated, and the best intervention concentration of A1AT was selected. The experiment of screening the best intervention concentration of A1AT was divided into 7 groups: blank group, control group, H/R group and A1AT 10 μmol/L group, A1AT 20 μmol/L group, A1AT 40 μmol/L group and A1AT 80 μmol/L group. The experiment of screening the best intervention time was divided into 8 groups: blank group, control group, H/R group, A1AT 1 h group, A1AT 2 h group, A1AT 4 h group, A1AT 6 h group and A1AT 12 h group. After that, A1AT intervention experiment was divided into normal group (control group), hypoxia reoxygenation group (H/R group) and α-1 antitrypsin intervention group (A1AT group). CCK-8 was used to detect cell function, flow cytometry was used to detect the expression of apoptosis, and immunofluorescence and Western Blot were used to detect the expression of caspase-3. In addition, SPSS 22.0 was used for data statistics.
Results ?The best intervention concentration for A1AT was 20 μmol/L, and the best intervention time was 4 hours. The results of flow cytometry showed that the apoptosis rate increased in the H/R group and decreased significantly in the A1AT group, and there was statistically significant difference among the control group, the H/R group and the A1AT group ( P ?< 0.05). The Immunofluorescence detection revealed that the expression of caspase-3 molecules in the H/R group was strong positive, and compared with the control group and the A1AT group, the difference was statistically significant ( P ?< 0.05). Western Blot detection revealed that the expression of caspase-3 molecules in the H/R group was up-regulated, and compared with the control group and the A1AT group, the difference was statistically significant ( P ?< 0.05).
Conclusion ?α-1 antitrypsin can improve the apoptosis of hypoxia/reoxygenation cardiomyocytes in mice.
【Key words】 ?A1AT; Na2S2O4; hypoxia/reoxygenation; apoptosis; caspase-3
目前,心血管病死亡占城鄉居民總死亡原因的首位,農村占45.91%,城市占43.56%[1]。《中國心血管健康與疾病報告2019》推算心血管病現患人數3.30億,其中冠心病1100萬,肺源性心臟病500萬,心力衰竭890萬,先天性心臟病200萬,高血壓2.45億。心血管病死亡率的上升趨勢主要是由于缺血性心臟病(ischemia heart disease,IHD)死亡上升所致。急性心肌梗死是IHD的主要類型,早期再灌注治療是恢復心肌血液供應唯一有效的途徑,雖然及時恢復心肌血液灌注挽救了不少生命,但心臟血液供應不足一段時間后,恢復血液灌注心肌損傷反而加重,從而出現心肌頓抑、心臟功能下降甚至致命性心律失常,即心肌缺血再灌注損傷(myocardial ischemic reperfusion injury,MIRI)。再灌注后心肌壞死面積增加50%[2]。但MIRI的發生機制尚未完全明了,可能與氧自由基、炎性細胞因子、蛋白酶等介導的內皮細胞功能受損及心肌受損有關[3~4]。其中,凋亡在MIRI中起到很關鍵的作用。然而,迄今為止,尚未發現任何一種有效防止MIRI的方法。α-1抗胰蛋白酶(α-1 antitrypsin,A1AT)是絲氨酸蛋白酶抑制劑超家族中的一員,其主要作用是保護機體正常細胞和器官不受蛋白酶的損傷,抑制感染和炎癥,維持機體內環境的平衡[5]。近年來,A1AT在干預炎癥因子的治療研究中愈來愈得到廣大學者的青睞,目前已經廣泛用于各種炎癥疾病的治療。本實驗研究是在心肌缺血再灌注損傷學說的基礎上,總結前人經驗,建立小鼠心肌細胞缺氧/復氧模型,探索A1AT對小鼠缺氧/復氧心肌細胞凋亡的影響。
1 材料與方法
1.1 材料
導師組凍存小鼠心肌細胞(型號FMC84,來源:ATCC),caspase-3抗體購自CST。
1.2 檢測方法
1.2.1 CCK-8檢測法篩選A1AT最佳干預濃度及最佳干預時間
篩選A1AT最佳干預濃度實驗分為 7個組:Blank組、Control組、H/R組、A1AT 10 ?μmol/L 組、A1AT 20 μmol/L 組、A1AT 40 μmol/L 組以及A1AT 80 μmol/L 組,按設定的濃度預先干預2小時,孔中換成4 mmol/L的Na2S2O4誘導缺氧1小時后,吸取Na2S2O4溶液棄掉,并予PBS清洗兩次,予含有10 μmol/L、20 μmol/L、40 μmol/L及80 μmol/L的α-1抗胰蛋白酶的完全培養基復氧24小時,用CCK8檢測它們的活力,篩選最佳α-1抗胰蛋白酶干預濃度。篩查A1AT最佳干預時間實驗分為8個組:Blank組、Control組、H/R組、A1AT 1 h組、A1AT 2 h組、A1AT 4 h組、A1AT 6 h組及A1AT 12 h組,心肌細胞接種至96孔板中,以α-1抗胰蛋白酶最佳干預濃度干預,待細胞貼壁后,予20 μmol/L α-1抗胰蛋白酶分別干預1 h、2 h、4 h、6 h和12 h,到時間即去掉α-1抗胰蛋白酶藥液,并予PBS清洗兩次,予4 mmol/L Na2S2O4干預60 min建立小鼠心肌細胞缺氧模型,之后去掉Na2S2O4溶液,予完全培養基復氧24小時,進行CCK8檢測。
1.2.2 利用流式細胞儀雙染法檢測細胞凋亡
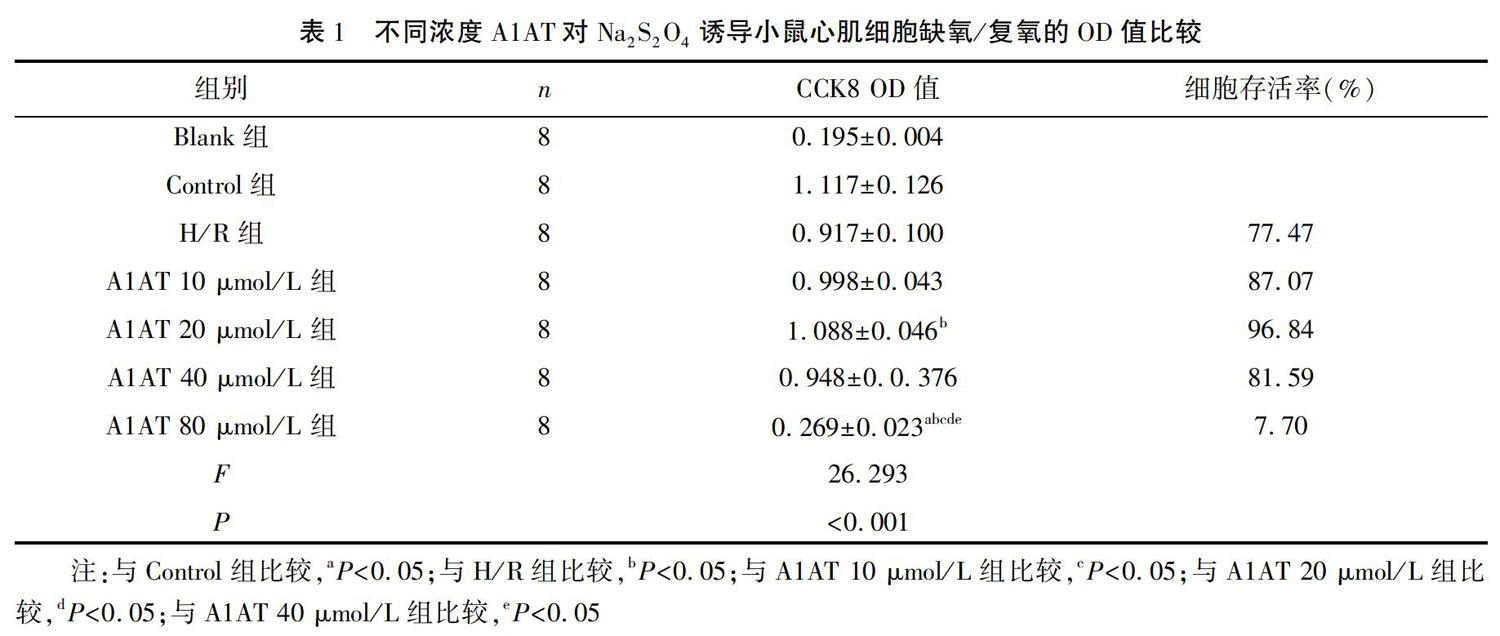
我們利用流式細胞儀檢測細胞凋亡,采用AnnexinV-FITC/PI雙染法標記小鼠心肌細胞FMC84,對Control組、H/R組、A1AT組進行凋亡檢測,收集細胞后在1小時內完成上機檢測。設置四個象限,分別為1象限:此區域為機械損傷及壞死細胞;2象限:此區域為晚期凋亡細胞;3象限:此區域為存活細胞;4象限:其區域為早期凋亡細胞。以4象限細胞數來判定各組細胞早期凋亡程度。
1.2.3 利用免疫熒光檢測caspase-3表達
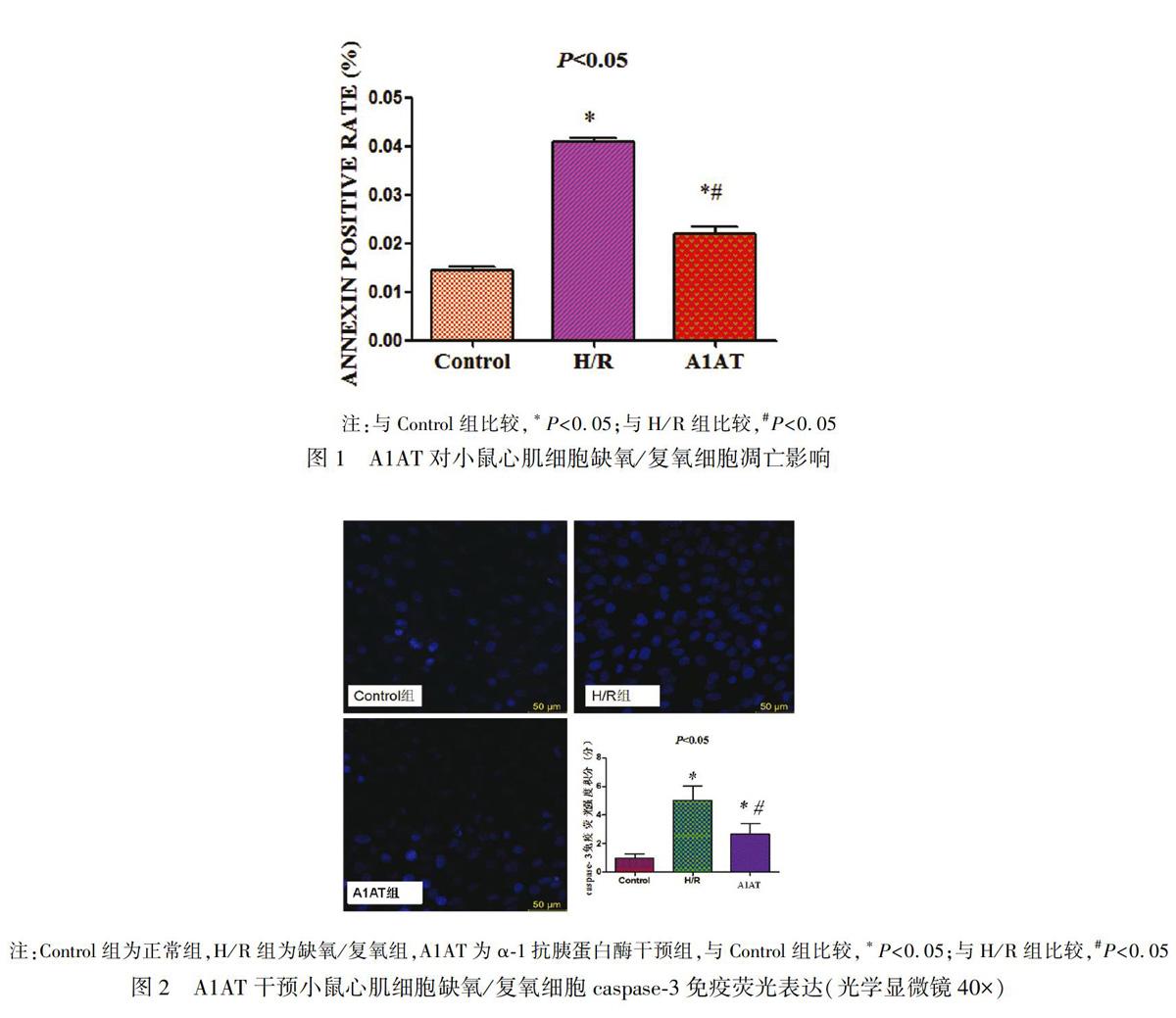
按一定細胞濃度在24孔板種植細胞,待細胞爬片后以4%的聚甲醛固定,0.5% Triton 破膜,山羊血清封閉,之后以一抗4℃ 孵育過夜,加熒光二抗,滴加DAPI再染核,在熒光顯微鏡下觀察采集圖像。
1.2.4 Western Blot檢測caspase-3表達
按一定的細胞濃度在6孔板中種植細胞,待細胞貼壁后進行造模及藥物干預,收取細胞,提取蛋白,按提取的蛋白濃度在電泳槽中上樣,跑電泳,轉膜,一抗孵育過夜,孵育二抗,利用凝膠系統成像儀進行顯影。
1.3 統計學方法
用Graphprism 5.0進行作圖。應用SPSS 22.0統計軟件進行數據分析,計量資料符合正態分布,以均數±標準差( ?±s )表示,多組間比較采用單因素方差分析,進一步兩兩比較采用 q 檢驗(Newman-Keuls法),檢驗水準:α=0.05,雙側檢驗。
2 結? 果
2.1 A1AT干預心肌細胞缺氧/復氧的濃度梯度探索
與Blank組比較,不同濃度的A1AT均可不同程度地影響小鼠心肌細胞活力,其中A1AT 20 μmol/L 組的影響最明顯。提示α-1抗胰蛋白酶20 μmol/L是最佳干預濃度。見表1。
2.2 A1AT干預心肌細胞缺氧/復氧的時間梯度探索
與Control組相比,α-1抗胰蛋白酶作用時間不同可對細胞活力造成不同的影響,其中A1AT 4 h組作用時間最佳,4小時后隨著α-1抗胰蛋白酶作用時間越長,細胞活力逐漸下降。α-1抗胰蛋白酶4小時作用的OD值與對照組及A1AT 2 h組比較無統計學意義,但與其他作用時間組及H/R組比較差異均有統計學意義( P <0.05)。提示α-1抗胰蛋白酶干預的最佳時間為4小時。見表2。
2.3 流式細胞儀檢測小鼠心肌細胞凋亡
與Control組比較,H/R組心肌細胞早期凋亡明顯增加,A1AT干預后心肌細胞凋亡減少,差異有統計學意義( P <0.05)。結果提示Na2S2O4誘導的心肌細胞缺氧/復氧可以增加心肌細胞凋亡,A1AT預先干預后Na2S2O4誘導的心肌細胞缺氧/復氧心肌細胞早期凋亡減少(圖1)。
2.4 免疫熒光檢測小鼠心肌細胞caspase-3分子表達
caspase-3免疫熒光陽性為小鼠心肌細胞核呈現藍色熒光物質。Control組、H/R組、A1AT組caspase-3的平均陽性表達率分別為19.16%,68.47%,35.52%,染色強度為弱陽性、強陽性、弱陽性,平均總積分分別為1分,5分,2.67分。Control組染色為陰性,H/R組及A1AT染色為陽性,且H/R組較A1AT組更為明顯(圖2),三組比較差異有統計學意義( P <0.05)。提示A1AT對MIRI細胞凋亡有保護作用。
2.5 Western Blot 檢測小鼠心肌細胞 caspase-3蛋白表達
我們利用Western Blot 技術對caspase-3蛋白的表達水平進行檢測,結果發現:與Control組比較,H/R組caspase-3表達明顯上調,A1AT干預后其表達明顯下調,三組比較差異有統計學意義( P <005)(圖3)。說明A1AT對MIRI心肌細胞凋亡具有保護作用。
3 討? 論
MIRI后壞死心肌的面積增加了50%[2],但發生機制尚未完全明了,可能與氧化應激、炎癥因子等介導的細胞凋亡有關[3~4]。由于MIRI預后差,危害大,對MIRI的治療也成為當前醫療界的研究熱點之一。
A1AT是急性反應性蛋白質,在炎癥性疾患時,A1AT可透過毛細血管進入組織液,在炎癥局部往往濃度很高,對急性炎性疾病有一定限制作用[6]。A1AT具有免疫調節、抗炎和細胞保護特性,與降低IL-6和IL-8的表達和成熟有關[7]。冠狀動脈硬化癥的發生與炎癥因子密切相關,國外研究發現,血漿A1AT水平與心絞痛患者冠狀動脈狹窄的存在和嚴重程度相關[8],還有研究發現,A1AT可以抑制IL-1的產生從而影響急性冠脈綜合征的預后[9]。A1AT在干預炎癥因子的治療中愈來愈得到廣大學者的青睞,目前已經廣泛用于各種炎癥疾病。因此,干預炎癥因子對防治MIRI尤為重要。
缺血性心肌病大多數是由急性冠脈綜合征演變而來,且其發生機制與氧自由基、炎癥因子有關[10]。氧化應激是炎癥的特征之一, 氧化應激不僅可以導致組織損傷, 還可以促進炎癥反應[11]。氧化應激是炎癥反應的特征表現之一,氧化應激導致的炎癥反應在缺血再灌注損傷發生時爆發[12~13]。因此,阻斷炎癥反應及氧化應激可以在一定程度上減輕缺血再灌注損傷。炎癥細胞因子的代表性家族為白介素家族,處于免疫反應及凋亡的上游,可以調控凋亡的發生,從而加劇缺血再灌注損傷[14]。我們的研究發現,心肌細胞缺氧/復氧后,細胞凋亡發生率明顯減少,caspase-3表達明顯增加,提示凋亡參與心肌缺血再灌注損傷的發生發展,這與王娓娓團隊及李奇的研究一致[15~16]。近年來,隨著臨床藥物的深入研究與應用發現,A1AT在控制炎癥和免疫過程中起關鍵作用[17~18],我們的研究亦發現,心肌細胞缺氧/復氧予A1AT干預后,心肌細胞凋亡發生率明顯下降,且caspase-3表達明顯下降,這可能與A1AT可以有效干預炎癥反應[19]進而抑制細胞凋亡有關。說明A1AT具有干預凋亡的作用,但目前這方面的研究甚少。但有國外報道A1AT可減少缺血再灌注引起的急性炎癥損傷[20],有學者使用內皮細胞單層暴露于缺氧/復氧模型來研究A1AT在人臍靜脈內皮細胞中的作用,結果發現 A1AT的過表達可抗氧化應激從而降低了細胞凋亡并促進了增殖[21]。
綜上所述,凋亡是MIRI的關鍵環節,A1AT可以下調caspase-3,A1AT可能通過干預凋亡起到預防心肌缺血再灌注損傷的作用。
參 考 文 獻
[ 1] ??中國心血管健康與疾病報告編寫組.中國心血管健康與疾病報告2020概要[J].中國循環雜志,2021,36(6):521-545.
[ 2] ??HAUSENLOY D J, YELLON D M. Targeting myocardial reperfusion injury:the search continues[J].N Engl J Med,2015,373(11):1073-1075.
[ 3] ??高啟軍,董曉帆,鄧長金.心肌缺血再灌注損傷研究進展[J].嶺南心血管病雜志,2020,26(1):107-109.
[ 4] ??馮旭光.大鼠心肌缺血再灌注損傷中氧自由基、心肌細胞凋亡和缺血再灌注性心律失常的相關性[J].中西醫結合心血管病電子雜志,2016,4(30):73.
[ 5] ??BALDUYCK M, ODOUM F, ZERIMECH F, et al.Diagnosis of alpha-1 antitrypsin deficiency: modalities, indications and diagnosis strategy[J].Review? Rev Mal Respir,2014,31(8):729-745.
[ 6] ??陳少蓮,張濤,馬曉桂,等.血清α-1抗胰蛋白酶測定的臨床意義[J].吉林醫學,2020,41(12):3004-3008.
[ 7] ??YUAN Y,? DICIACCIO B, LI Y,et al.Anti-inflammaging effects of human alpha-1 antitrypsin[J].Aging Cell,2018,17(1):e12694.
[ 8] ???ZHAO H, LIU H, CHAI L, et al.Plasma α1-antitrypsin: a neglected predictor of angiographic severity in patients with stable angina pectoris[J].Chin Med J (Engl),2015,128(6):755-761.
[ 9] ???ZIAKAS A G, KOSKINAS K C, SOULIOU E, et al.Serial measurements of acute phase proteins in patients with acute coronary syndrome[J].Hellenic J Cardiol,2011,52(4):293-298.
[10] ??張夢雨,王田,孟凡靜,等. 缺血性心肌病及擴張型心肌病患者血清炎癥因子的表達及臨床意義探討[J]. 中華老年醫學雜志,2018,37(11):1185-1189.
[11] ???LIANG Y P,? LIU Q, XU G H,et al.The lncRNA ROR/miR-124-3p/TRAF6 axis regulated the ischaemia reperfusion injury-induced inflammatory response in human cardiac myocytes[J].J Bioenerg Biomembr,2019,51(6):381-392.
[12] ??TIAN L,? CAO W J,? YUE R J, et al.Pretreatment with Tilianin improves mitochondrial energy metabolism and oxidative stress in rats with myocardial ischemia/reperfusion injury via AMPK/SIRT1/PGC-1 alpha signaling pathway[J].J Pharmacol Sci,2019,139(4):352-360.
[13] ???GUO W W,? LIU X J, LI J J,et al.Prdx1 alleviates cardiomyocyte apoptosis through ROS-activated MAPK pathway during myocardial ischemia/reperfusion injury[J].Int J Biol Macromol,2018,112:608-615.
[14] ??韋亞忠,薛曉梅,何斌. 活性氧介導心肌缺血再灌注損傷的研究進展[J]. 上海交通大學學報(醫學版),2021,41(6):826-829.
[15] ??王娓娓,葉宏,孫林,等. 燈盞花素促進缺血/再灌注損傷的微血管內皮細胞自噬、抑制氧化損傷及凋亡[J]. 中國藥理學通報,2021,37(7):946-951.
[16] ??李奇.miR-327調控凋亡抑制因子ARC在心肌缺血再灌注損傷中的作用及機制研究[D].宜昌:三峽大學,2020.
[17] ??黃達,劉燕,黃照河. α-1抗胰蛋白酶的研究進展及與心血管疾病的關系[J]. 右江醫學,2021,49(5):382-385.
[18] ??齊亞飛,阿迪拉·阿爾肯,比拉力·艾山,等. α1抗胰蛋白酶抑制脂多糖誘導肺泡上皮細胞炎癥因子的分泌[J]. 新疆醫科大學學報,2017,40(8):1061-1064.
[19] ???EBRAHIMI T, RUST M, KAISER S N,et al.α1-antitrypsin mitigates NLRP3-inflammasome activation in amyloid β 1-42-stimulated murine astrocytes[J].J Neuroinflammation,2018,15(1):282.
[20] ???TOLDO S,?? MAURO A G, MARCHETTI C,et al.Recombinant human alpha-1 antitrypsin-Fc fusion protein reduces mouse myocardial inflammatory injury after ischemia-reperfusion independent of elastase inhibition[J].J Cardiovasc Pharmacol,2016,68(1):27-32.
[21] ????FENG Y L, HU L Q, XU Q,et al.Cytoprotective role of alpha-1 antitrypsin in vascular endothelial cell under hypoxia/reoxygenation condition[J].J Cardiovasc Pharmacol,2015,66(1):96-107.
(收稿日期:2021-04-13 修回日期:2021-07-23)
(編輯:梁明佩)

