衰老大鼠腸道菌群的變化及人參-黃芪干預效應
程波敏 汪棟材 吳海濱 宋曉容 尹霖 王慧
【摘要】目的:探討人參-黃芪對衰老大鼠模型腸道微生態的影響,探尋二者聯合使用對腸道微生態的影響及抗衰老機理研究。方法:模型組和人參-黃芪組大鼠皮下注射給予 D-氨基半乳糖制作衰老模型, 人參-黃芪組同時每日腹腔注射200 mg/kg 黃芪多糖及40 mg/kg 人參總皂苷持續8周,顯微鏡下觀察小腸黏膜的形態,檢測腸道iNOS、zo-1、occludin、claudin-1蛋白表達變化。結果:大鼠經衰老誘導后,小腸絨毛表面細胞凋亡較為明顯,小腸iNOS、occludin、claudin-1表達顯著升高,zo-1表達顯著降低;而經過人參與黃芪處理后,顯著抑制了大鼠小腸絨毛表面細胞的凋亡,同時抑制iNOS、occludin、claudin-1的表達,升高zo-1表達。結論:人參-黃芪聯合應用可影響腸道菌群變化進而發揮抗衰老作用。
【關鍵詞】人參;黃芪;抗衰老;腸道菌群
【中圖分類號】R951 【文獻標識碼】A 【文章編號】2096-5249(2021)08-0006-02
衰老是一種自然的生命現象,以機體各部分組織和器官的功能活動逐漸衰退為特征。中醫延年學說對人體衰老或早衰的認識源遠流長,以氣血津液學說最為經典,氣為生命之源,“衰老”在中醫中謂“氣虛”,即元氣不足,臟腑機能逐漸減退的虛弱癥候,臨床常用補益劑延年益壽[1]。現代研究認為,衰老是一個內外多種因素(基因、環境和精神心理等)共同作用的綜合結果[2],可由多種應激因素引起,如氧化應激、線粒體功能障礙等。近年來,研究發現,腸道微生物變化會導致機體免疫功能衰退,同時導致衰老相關的慢性疾病,提示腸道微生物可能對衰老產生重要作用[3]。課題組前提研究提示人參-黃芪具有調節腸道微生態功能,故本研究旨在探討人參-黃芪對衰老大鼠模型腸道微生態的影響,探尋二者聯合使用對腸道微生態的影響及抗衰老機理研究,為中醫藥抗衰老提供理論依據及實驗數據。
1 材料與方法
1.1 實驗動物
3月齡SPF級SD雄性大鼠30只由實驗動物中心提供,體重分別為300~350 g/只。30只大鼠分為5組:對照組、模型組、人參組、黃芪組和人參黃芪組,大鼠在實驗動物中心SPF環境下適應性喂養1周后用于試驗研究,室溫20~25℃,濕度40 %~60 %,定期紫外線燈消毒。
在模型組、人參組、黃芪組和人參黃芪組大鼠后肢外側皮下部位連續注射D-半乳糖,注射劑量為0.125 g/kg·d,注射時間為每天上午9∶00~13∶00,連續注射40 d。
30只大鼠均在自由攝食、飲水,標準條件下飼養40 d。
1.2 干預方式
每日腹腔注射給予黃芪組大鼠200 mg/kg黃芪多糖,人參組大鼠40 mg/kg 人參總皂苷, 人參黃芪組大鼠200 mg/kg黃芪多糖及40 mg/kg 人參總皂苷, 同時給予對照組和衰老組大鼠等量生理鹽水,連續注射8周。
1.3 觀察指標
1.3.1 大鼠小腸形態:研究期間觀察大鼠小腸形態變化。
1.3.2 大鼠腸道iNOS、zo-1、occludin、claudin-1蛋白表達檢測:取體積100 mg凍存組織,以RIPA裂解液提取組織總蛋白,蛋白經純化后進行定量,進行SDS-PAGE電泳,PAGE膠經硝酸纖維膜轉膜后,分別孵育兔抗鼠iNOS、zo-1、occludin、claudin-1以及GAPDH一抗。再以HRP標記的二抗孵育過夜。硝酸纖維膜經定影、顯影后,以Quantity One v4.4.0軟件分析iNOS、zo-1、occludin、claudin-1以及GAPDH蛋白條帶的光密度。
2 結果
2.1 人參-黃芪處理對衰老大鼠小腸形態的影響
如圖1所示,與對照組大鼠相比較,大鼠經衰老誘導后,小腸絨毛表面細胞凋亡較為明顯。而經過人參與黃芪處理后,顯著抑制了大鼠小腸絨毛表面細胞的凋亡(人參組和黃芪組未觀察小腸形態)。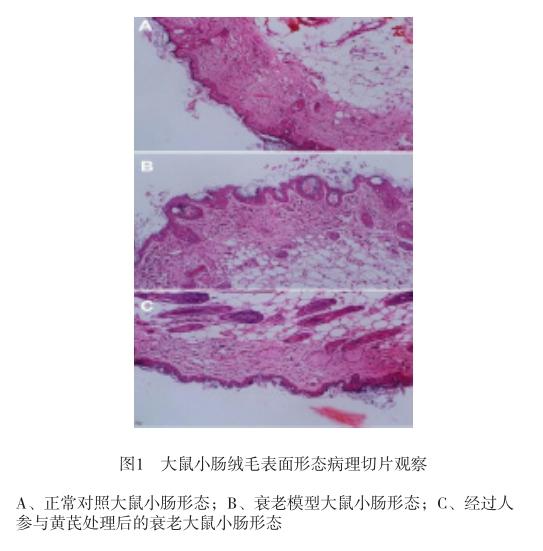
2.2 人參和黃芪處理對衰老大鼠腸道iNOS、zo-1、occludin、claudin-1蛋白表達的影響
如圖2所示,與對照組大鼠相比較,大鼠經衰老誘導后,小腸iNOS、occludin、claudin-1表達顯著升高,但經過人參與黃芪分別處理后,iNOS、occludin、claudin-1的表達顯著得到抑制。此外,與對照組大鼠相比較小腸zo-1表達顯著降低,但經過人參與黃芪處理后,zo-1的表達顯著得到提高。
3 討論
隨著人口老齡化進程的加劇,人們日益關注衰老問題及衰老所導致的疾病。研究顯示,腸道微生物與機體發育和衰老密切相關,腸道菌群也叫“第二基因組”[4]。隨著機體衰老,腸道微生物多樣性減少,尤其是有益菌群銳減,導致許多衰老相關疾病,如免疫相關疾病、糖尿病等代謝疾病、神經退行性疾病等嚴重影響健康和生活質量。
《神農本草經》中記載:“人參主補五臟,安精神,定魂魄,止驚悸,除邪氣,明目開心益智,久服輕身延年。”人參莖葉中提取的人參皂苷(Rb1、Rb2、Rc、Rg1、Rg2等)能不同程度的清除氧自由基,其中Rb1和Rg1被證實作用最強[5]。黃芪最早見于《五十二病方》,有“補氣”之功,其活性成分黃芪甲苷[6]具有抗衰老、抗炎、免疫調節、抗氧化、抗纖維化等作用[7]。
本研究在衰老大鼠模型上證實了衰老誘導后,小腸絨毛表面細胞凋亡較為明顯,小腸iNOS、occludin、claudin-1表達顯著升高,zo-1表達顯著降低;而經過人參與黃芪處理后,顯著抑制了大鼠小腸絨毛表面細胞的凋亡,同時抑制iNOS、occludin、claudin-1的表達,升高zo-1表達;表明人參-黃芪聯合應用可通過影響腸道菌群變化進而發揮抗衰老作用。衰老是人體必須經歷的過程,從整體看,衰老代表健康的器官功能退化,但在細胞層面衰老也代表了細胞的功能減退和衰老凋亡的進程[8]。衰老發生的機制復雜多樣,其中被廣泛認可的假說是衰老受遺傳因素、飲食習慣和運動等多種因素的影響,在炎癥和氧化應激等多種機制的作用下引起細胞衰老等生理過程,進而導致機體各系統功能逐步退化[9]。而腸道微生物變化可以改變腸道屏障功能,破壞腸道屏障完整性,為后續的炎癥和感染提供條件[10]。與此同時,腸道菌群失調,尤其是吲哚丙酸代謝相關菌群減少破壞腸道抗氧化功能;雙歧桿菌和擬桿菌減少能夠減少抗炎因子IL-10的含量,上調TNF-α和IL-17的含量[11]。以上均表明腸道微生物變化與衰老密切相關。而本研究通過實驗已經證實,人參-黃芪聯合作用能明顯改善腸道微生物的紊亂,起到抗衰老的作用,為抗衰老機制的探索及臨床上相關疾病的診治提供有力證據和作用靶點,值得繼續深入研究和應用推廣。
參考文獻
[1] 周玉,趙燕,馬暉,等.中醫藥抗衰老作用機制研究進展[J].亞太傳統醫藥,2016,12 (17):50-52.
[2] Choi SH,Kim HJ,Cho HJ,et al.Gintonin-mediated release of astrocytic vascular endothelial growth factor protects cortical astrocytes from hypoxia-induced cell damages[J].J Ginseng Res,2019,43(2):305-311.
[3] 李思慧,吳巧鳳.腸道菌群對Th17/Treg免疫平衡和炎癥性腸病影響的研究進展[J].免疫學雜志,2019,35(8):722-726.
[4] 馬明.人體腸道微生物組學與大健康產業[J].科學(上海),2018,70(6):23-28,69.
[5] 周峰,李佳琪,周玉枝,等.腸道微生物與衰老[J].中國藥學雜志,2019,54(10):761-765.
[5] Kang S,Min H.Ginseng, the Immunity Boost: The Effects of Panax ginseng on Immune System[J].J Ginseng Res.2012,36(4):354-368.
[6] 朱嘉歡,黃小平,鄧常清.黃芪和當歸的主要活性成分配伍促進衰老造血干細胞增殖作用的研究[J].中草藥,2019,50(1):111-119.
[7] 苗雨丹,張浩,許妍妍.黃芪多糖對致衰老模型小鼠氧自由基水平的影響[J].中國老年學雜志,2017,37(17):4193-4194.
[8] Ron,Sender,Shai,et al.Are We Really Vastly Outnumbered Revisiting the Ratio of Bacterial to Host Cells in Humans[J].Cell,2016,164(3):337-340.
[9] Hwangbo DS,Lee HY,Abozaid LS,et al. Mechanisms of Lifespan Regulation by Calorie Restriction and Intermittent Fasting in Model Organisms[J].Nutrients,2020,12(4):1194.
[10] Berry D,Stecher B,Schintlmeister A ,et al.Host-compound foraging by intestinal microbiota revealed by single-cell stable isotope probing[J]. Proceedings of the National Academy of Sciences of the United States of America,2013,110(12):4720-4725.
[1 1 ] Li M,Bai YQ,Zhou JR,et al.Core Fucosylation of Maternal Milk N-Glycan Evokes B Cell Activation by Selectively Promoting the l-Fucose Metabolism of Gut Bifidobacterium spp. and Lactobacillus spp.[J]. mBio,2019,10(2):128-129.

