實時熒光PCR 法檢測結核桿菌的臨床價值
魏進武,廖俐雅,余登瓊,吳朝菊,袁世梅
重慶市墊江縣人民醫院檢驗科,重慶 408300
結核病是一種嚴重危害人民健康的慢性傳染病,是全球需要面對的重要公共衛生問題,也是我國重點控制的重大疾病之一。我國是全球30 個結核病高負擔國家之一,位居全球第2 位[1]。每年新報告肺結核患者約80 余萬例,位居甲乙類傳染病第2 位[2],結核桿菌是引發肺結核的主要病原菌,該菌的細胞壁結構較為特殊,具有較強的耐藥性,能夠抵抗多種藥物,形成耐藥性的機制較為復雜[3]。這種病菌能夠侵犯全身的器官,其中最為常見的就是肺部受到侵害,進而形成肺結核。肺結核是一種具有較強傳染性的傳染性疾病,并且能夠通過空氣進行傳播。實驗室病原學檢查是診斷結核病的主要手段。肺結核主要是通過藥物治療,如果患者化療無效、多重耐藥的厚壁空洞、大塊干酪灶結核性膿胸、支氣管胸膜瘺、大咯血保守治療無效,需要進行肺結核外科手術治療[4]。針對肺結核,還應做到早發現、早診斷、早治療,改善預后,促進患者病情好轉。該次研究方便選取2018 年1 月—2020 年9 月該院門診和住院部接收的疑似肺結核患者作為研究對象,應用涂片法、QT-PCR 法、固體培養法進行結核分枝桿菌檢測,并比較三者的優異性,現報道如下。
1 資料與方法
1.1 一般資料
方便選取該院門診和住院部接收的疑似肺結核的患者作為該次的研究對象,其中男性3 728 例,女性3 338例。納入標準:具有咳嗽、咳痰、低熱、盜汗、痰中帶血等癥狀或已診斷肺結核患者的密切接觸者的患者,且近1個月未進行抗結核治療,同意參與該次研究。排除標準:近1 個月進行抗結核治療。
1.2 方法
1.2.1 儀器與試劑 抗酸染色液:冷染法;結核分枝桿菌復合群核酸檢測試劑盒(QT-PCR 法)和核酸提取試劑(磁珠法);核酸提取儀(型號:Lab-Aid808),PCR 熒光定量分析儀(型號:宏石SLAN-48P);羅氏培養基。
1.2.2 檢驗方法 嚴格按照《全國臨床檢驗操作規程》、商品試劑盒說明書及儀器標準進行操作。
①標本采集和處理:患者清晨起床后首先給予清水漱口,用力咳痰置于無菌痰杯中,立即送檢。涂片法連續3 d 留清晨痰液。
②固體培養法(56 例):視樣本黏稠程度,加1~2 倍4% NaOH,震蕩使樣本液化,取液化后的標本0.1~0.3 mL,以無菌操作接種于羅氏培養基斜面上,置培養箱中37℃孵育。7 d 后有菌落生長,報固體培養法結核桿菌陽性。若8 周內未生成菌落,則報告陰性。
③痰涂片鏡檢(7 066 例):取痰標本中干酪樣、膿樣或可疑部分0.05 mL,在玻片正面均勻涂抹成10 mm×20 mm 的卵圓形痰膜,厚度為透過痰膜看報紙上的5號字時字跡較模糊為適宜,室溫中干燥后加熱固定,后加入石碳酸復紅染液室溫染色10 min,水洗后使用3%的鹽酸酒精脫色,再使用亞甲基藍復染0.5~1 min,水洗后等待自然干燥,最后放置在顯微鏡下查看。若淡藍色背景下可見紅色略帶彎曲的桿菌,且有分枝生長態勢即為陽性[5]。
④QT-PCR 法檢測(942 例):用1~2 倍體積的4%NaOH 溶液液化痰樣本,上機提取核酸,將提取好的核酸取30 μl 加入擴增管(擴增管中已預置反應體系),震蕩混勻并瞬時離心后進行擴增。反應條件設置:UNG 處理50℃2 min,預變性95℃10 min ;Touchdown 循環程序:95℃10 s,71℃15 s(每個循環下降1℃),78℃15 s,循環10 次;PCR 循環程序:95℃10 s、61℃15 s、78℃15 s,循環45 次。每批次實驗設置陰陽對照及臨界水平對照,擴增結束按試劑盒說明書要求分析結果,結果有效且樣本Ct 值≤25 判斷結果為陽性。
1.3 觀察指標
觀察3 組患者抗酸桿菌陽性檢出率。對比涂片法與QT-PCR 法抗酸桿菌陽性檢出率、特異性、靈敏度、準確率。特異性=真陰性例數/(真陰性例數+假陽性例數)×100.00%;靈敏度=真陽性例數/(真陽性例數+假陰性人數)×100.00%;準確率=(真陽性例數+真陰性例數)/總例數×100.00%。
1.4 統計方法
采用SPSS 26.0 統計學軟件對所有數據結果進行統計分析。滿足正態性檢驗與方差齊性檢驗的計量資料以()表示,多組樣本間差異比較采用單因素方差分析,如有顯著性差異,組間兩兩比較用LSD 法檢驗;計數資料以[n(%)]表示,采用χ2檢驗,均作雙側檢驗,P<0.05 為差異有統計學意義。
2 結果
2.1 3 組患者納入對象一般資料比較
3 組患者的性別、年齡、病程3 項一般資料對比,差異無統計學意義(P>0.05),具有可比性,見表1。
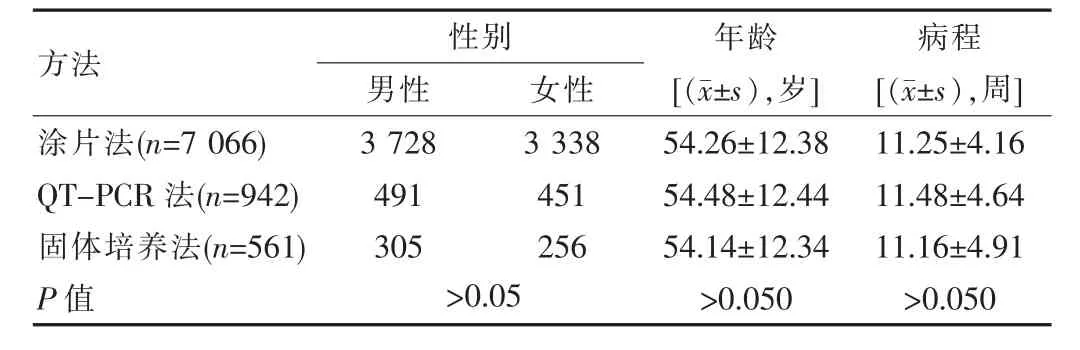
表1 3 組患者一般資料比較
2.2 3 組患者固體培養法抗酸桿菌陽性檢出率比較
共有561 例應用固體培養法檢測,其結核桿菌的陽性例數為205 例,陽性率為36.54%。固體培養法將作為結核桿菌檢出的金標準。典型的結核桿菌菌落呈菜花狀,見圖1、圖2。

圖1

圖2
2.3 3 組患者涂片法與QT-PCR 法抗酸桿菌陽性檢出率比較
涂片法結核桿菌的陽性例數為162 例,陽性檢出率為2.29%;QT-PCR 法結核桿菌的陽性例數為281 例,陽性率為29.83%,對比兩組的陽性檢出率,QT-PCR 法高于涂片法,差異有統計學意義(P<0.05),見表2。
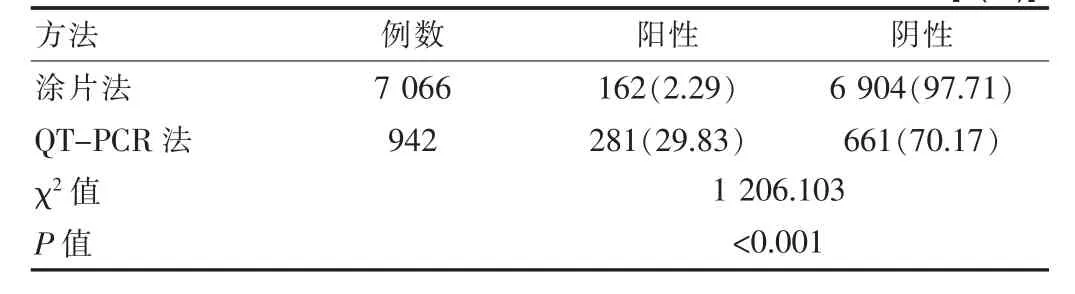
表2 3 組患者涂片法與QT-PCR 法抗酸桿菌陽性檢出率比較[n(%)]
2.4 3 組患者涂片法與QT-PCR 法檢驗靈敏度、特異性和準確率比較
對352 例同時進行固體培養法、涂片法及QT-PCR法的病例進行分析,以固體培養法結果為標準。涂片法(取樣1~3 次,首次陽性即記為陽性,否則繼續采樣第2次或第3 次,有1 次陽性則記為陽性)檢測的靈敏度、特異性和準確率分別為69.78%、90.61%、82.39%;QTPCR 法檢測的靈敏度、特異性和準確率分別為83.45%、86.85%、85.51%,QT-PCR 法靈敏度明顯高于涂片法,差異有統計學意義(P<0.05),見表3。
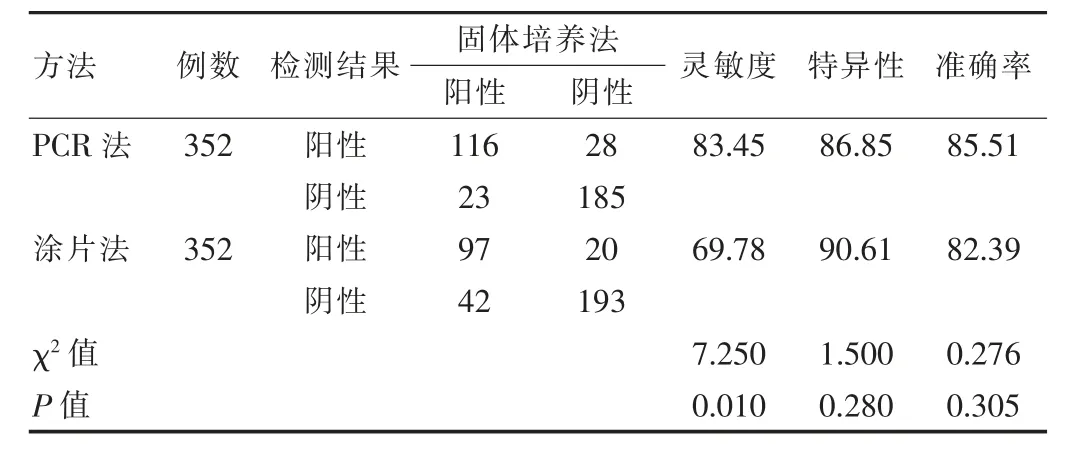
表3 352 例患者同時進行固體培養、涂片和QT-PCR 檢測結果比較(%)
3 討論
肺結核是一種慢性傳染性疾病,該病是由結核分枝桿菌引起,會對患者全身的器官和組織造成傷害,對患者、家庭、社會均會帶來較為嚴重的危害。目前我國的肺結核發病率逐年升高,并且結核病當中出現越來越多的耐藥型病例,1 例活動性的肺結核患者每年可傳染引起20 例左右的新發感染者,20%患者在早期無明顯臨床癥狀或癥狀較輕微,因此在結核分枝桿菌感染的最初階段,快速檢測到結核分枝桿菌,才能有效地從源頭控制結核病的擴散[6-7]。臨床常用的檢測肺結核的方式主要有直接涂片抗酸染色鏡檢,即該次研究所用的涂片法、液體培養法和羅氏固體培養法,該次研究使用固體培養法,并作為研究的金標準,以及該次研究探索的QT-PCR 法檢測,這種方法主要用于檢測結核桿菌核酸。
涂片法是3 種檢驗方法中最早啟用檢測結核桿菌的方法,這種方法的優點是操作較為簡單,便捷,且并不需要特殊儀器設備,適合無法開展分子檢測的基層實驗室使用。其局限性在于染色不僅結核分枝桿菌呈陽性,而非結核分枝桿菌如麻風桿菌也呈陽性;該方法還容易受到溫度、染色時間、染色液質量,以及操作人員的主觀意識影響;該方法使用的標本并未進行消化滅活,容易污染環境,老處理不當會存在巨大的生物安全風險;另外,標本荷菌量較低時,鏡檢也不易查見抗酸桿菌,假陰性的概率特別大,要求檢測人員具備較高的技術水平和職業素養。據盛莉等[8]報道,留痰時留第1口痰和第2 口痰也會影響抗酸桿菌檢出率。多方面因素導致不易控制檢測工作的質量,且涂片法單次送檢的陽性率比文中所訴陽性率更低,通常需多次送檢,在檢驗的時效性與經濟性上并不都優于QT-PCR 法[9]。
固體培養法作為檢驗的金標準,能夠有效降低因標本產生的假陽性和假陰性的干擾因素,能夠通過確定性的陽性標本去考核其他方法的真陽性率。但該方法培養周期長,且非結核分枝桿菌也有生長,實際工作中培養的菌落形態并非都能生長成典型的菜花樣。根據標準和相關規定要求,結核桿菌的培養物如需開蓋進行進一步檢測,需在BSL-3 實驗室中進行[10-11]。目前絕大多數醫療機構尚不具備此條件,因此,只能依靠肉眼觀察菌落形態進行鑒別,故會導致假陽性率的提升,且該方法的靈敏度較低。
QT-PCR 法檢測結核桿菌的特異性及靈敏度均較強,并且能夠對不同類型的標本通過提取結核桿菌DNA 進行精確的檢測,在很大程度上提高了結核桿菌檢測的真陽性率和準確性,適用于體外難于培養和生長緩慢的病原體。QT-PCR 法根據試劑盒不同檢測的靶基因不同,包括插入序列6110(IS6110)、IS986、16Sr-RNA、MPB64、MTP40、65KD、2 個或多個序列聯合應用等[12-14],該研究中所采用的試劑盒的靶基因是針對結核分枝桿菌復合群所特有的IS6110 基因,不會受到各種分枝桿菌種(如龜、鳥、土地、施式、堪薩斯、亞洲分枝桿菌等)的影響,確診的價值較為顯著。隨著全自動核酸提取儀的普及,能夠進行自動化的批量操作,減少了人為因素的影響。但由于開展分子檢測需要專門設計的基因擴增檢測實驗室,且需經專業培訓取得上崗資質的人員才能進行操作,故結核桿菌核酸檢測并未大范圍普及[15],在應用PCR 過程中還應該注意一些問題,例如在樣本收集、處理、運送、保存過程中避免失誤,提高工作質量,減少檢測的誤差,避免在處理標本過程中出現交叉污染等情況,降低假陽性率和假陰性率[16]。該研究中,QT-PCR 法的靈敏度為83.45%,明顯高于涂片法,但仍然遠低于廠家給定的靈敏度值,可能原因為:①沒有去污步驟,不排除存在PCR 抑制因子,在低菌量時影響較大;②固體培養法存在一定的假陽性;③部分樣本過于黏稠,核酸提取前的樣本液化不完全。特異性為86.85%,導致特異性低的原因為:培養陰性而分子檢測陽性的例數稍多,標本荷菌量太低可能會出現培養陰性結果,這與培養的手工操作和檢測的敏感度有關。
該次研究將該院門診與住院部收治的疑似結核病的患者作為研究對象,應用3 種方式進行結核桿菌檢測,結果顯示,7 066 張涂片中陽性例數為162 例,陽性率為2.29%;942 例樣本進行了QT-PCR 法檢測,陽性例數為281 例,陽性率為29.83%;固體培養法的結核桿菌的陽性例數為205 例,陽性率為36.54%,由于固體培養法標本均來源于結核門診,并且作為該次研究的金標準,因此陽性率較高,但是依舊存在一定影響因素。而涂片法陽性率過低,原因可能為:①方法學局限;②與該研究中樣本的來源有關,樣本來源于各臨床科室并非都來自于結核門診,該研究中的涂片法陽性率也與相關報道的2.72%相近[17]。QT-PCR 法陽性率高于涂片法,且樣本來源于涂片法相同,適合進行比較。涂片法檢測的靈敏度為69.78%,QT-PCR 法靈敏度為83.45%,與呂純芳等[18]報道的靈敏度為83.7%的數據相近。QTPCR 法靈敏度高于涂片法(P<0.05)。結果表明,QTPCR 法陽性率、靈敏度、準確率均優于涂片法。涂片法影響因素較多,存在一定的漏診率。PCR 方法靈敏度和特異性均較高,并且較為平均,檢測的準確性更高。
綜上所述,應用QT-PCR 法檢測結核桿菌的應用價值更高,優于傳統的涂片法,具有較高的陽性率、特異性和靈敏度,且QT-PCR 法可在接收標本的當日得出檢測結論,時效性遠優于固體培養法。如同時在PCR基礎上應用固體培養法,能夠增強準確性,最終確定患者結核桿菌為陽性,提高檢測的準確率,因此可以臨床推廣,逐步替代涂片法。

