基于“模型認知”素養導向的高中化學教學設計
姬麗娜
【內容摘要】本文以“沉淀型離子反應”教學為例,以高一學生作為教學對象,從溶解度角度出發,設計教學案例,分析以碳酸鈣、氫氧化鈣、碳酸氫鈉三種物質為代表的難溶物、微溶物、可溶物的沉淀反應,定性建構模型,利用模型幫助學生建立“宏觀辨識與微觀探析”之間的橋梁,使學生對沉淀型的離子反應有本質上的理解,從而提升化學核心素養。
【關鍵詞】模型認知沉淀溶解度離子反應宏觀微觀
一、問題的提出
化學是在原子、分子水平上研究物質性質及其變化的科學,原子、分子不可見,化學客觀規律、物質性質及其變化的解釋亦十分抽象,學生通常無法為宏觀的實驗現象與符號搭起聯系的橋梁,或者只是記憶特定表征形式所建構的化學理論、實驗的結果以及特定的化學反應,這種割裂的、片段式的學習無法統整與理解化學符號與宏觀現象的關聯[1]。宏觀與微觀的聯系是化學學科最具特征的思維方式,“宏觀辨識與微觀探析”也正是化學學科的核心素養要求之一,這就要求執教者有意識的幫助學生在課堂中滲透。
二、化學模型的認識
高中化學學科的核心素養其中之一“證據推理與模型認知”,而模型是指人們為了某種特定目的而對認識對象所作的一種簡化的描述。這種描述可以是定性的(如對原子結構的描述),也可以是定量的(如PV=nRT)。有的借助于具體的實物來描述(如分子結構的球棍模型),有的則通過抽象的形式(如符號、文字、公式等)來描述[2]。《普通高中化學課程標準》(2017版)中對“模型認知”是這樣要求的:“知道可以通過分析、推理等方法認識研究對象的本質特征、構成要素及其相互關系,建立認知模型,并能運用模型解釋化學現象,解釋現象的本質和規律,形成化學學科的思想和方法。”[3]本文以“沉淀型離子反應”教學為例,重新整合教材,在課堂中滲透核心素養要求,幫助學生自主構建定性的思維模型,建立“宏觀辨識與微觀探析”之間的聯系。
三、教學背景
“離子反應”是高一化學必修課程中的重要內容之一,是高一年級學生建立微觀和宏觀之間的重要橋梁,而離子方程式正是對宏觀現象的微觀符號表征。
以往的教學中,老師往往給了學生一些簡單的識記方法,比如離子反應發生的條件之一產生沉淀。從教學現狀看,但大部分學生只是記住溶解性,并未對這一條件進行深入思考和理解。高一大部分學生甚至高二的學生對離子反應的學習僅停留在對反應發生條件記憶的階段,對本質的理解并不透徹且有一定困難,因此當遇到某些微溶物甚至可溶物沉淀時,便會產生困惑,無法將現象與符號表征準確地聯系在一起。基于此,本節課通過模型建構的設計和實踐,幫助學生建立起宏觀現象與微觀活動之間的橋梁。
四、教學思路和目標
1.教學思路
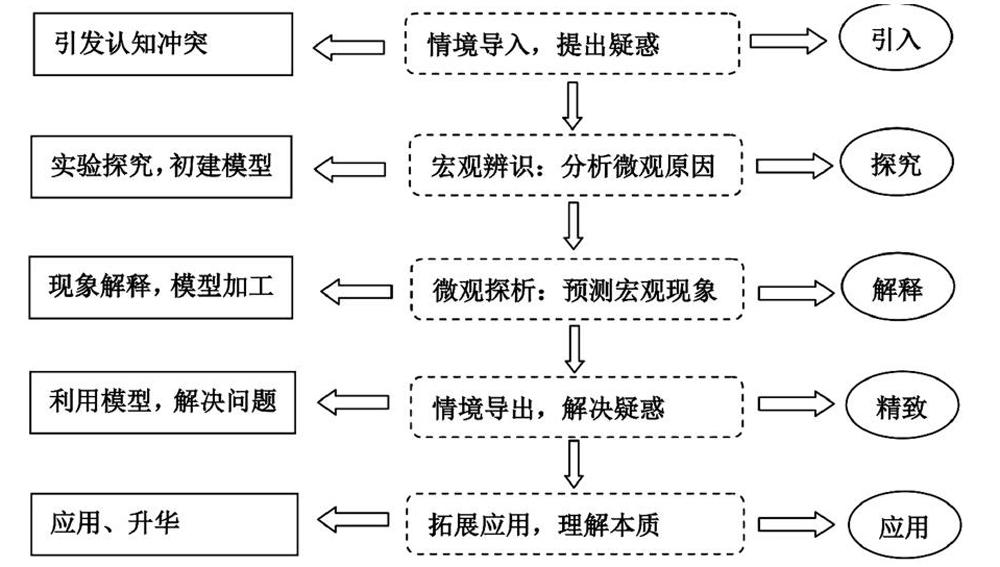
本節課融合建構主義理論為指導思想,以5E教學模式為主要策略,對難溶物、微溶物、可溶物分別產生沉淀的過程進行整合,幫助學生初步建立模型,從微觀層面分析宏觀現象,將宏觀現象與微觀活動聯系起來。通過本節課的學習,學生由已有認知難溶物沉淀導入,思考微溶物沉淀情況,初步建立定性模型,應用于解釋可溶物產生沉淀的情況。并對教材資料進行整合,拓寬學生視野,用模型解釋工業生產過程中的相關問題。
2.教學目標
(1)通過情境創建,感受我國化學工業的發展歷程,了解侯德榜先生的重要的化學貢獻,感受化學工業對經濟發展的重要作用。
(2)通過分析假設和實驗驗證向CaCl2溶液中逐滴加入NaOH溶液的實驗現象,初步建立宏觀認識和微觀探析之間的橋梁。
(3)通過CaCl2溶液與NaOH溶液反應的實驗現象推測和驗證,初步建立沉淀型離子反應條件的模型,并應用于解釋可溶物產生沉淀的離子反應。
3.評價目標
(1)通過對CaCl2溶液與NaOH溶液反應的現象的推測以及依據的說明,發展學生微觀探析和宏觀辨識之間聯系的能力。
(2)通過碳酸鈉溶液中通入CO2現象的分析以及化學方程式的書寫,診斷并發展學生建立模型的水平,發展學生用微觀探析預測宏觀現象的能力。
(3)通過侯氏制堿法原理的分析,以及化學方程式的書寫,診斷并發展學生應用模型的水平。
五、教學設計與實踐
1.認知沖突,引發思考
侯德榜先生與侯氏制堿法原理介紹,由氯化鈉制備碳酸氫鈉,思考:是否是離子反應,離子反應發生的條件是什么?
舉例回顧離子反應發生的條件,其中之一是生成難溶物。
那么微溶物、可溶物是否也會發生類似的反應?
[設計意圖]
從學生較為熟悉書本材料切入,由氯化鈉制備碳酸氫鈉,引導學生思考這個反應發生的條件,在學生的認知中碳酸氫鈉是易溶的物質,與已有知識“離子反應條件之一生成難溶物”這一認知有所沖突,引發學生的思考,重新思考離子反應的本質。
2.初建模型
[問題討論]向CaCl2溶液中逐滴加入NaOH溶液,現象?
生甲:有沉淀。
生乙:無沉淀。
[實驗1]甲乙兩生分別上臺演示實驗。
結果甲無沉淀,乙有沉淀。全班嘩然。
提示:仔細看試劑瓶,所用試劑有何區別?
生甲:我用的是0.01mol/L。
生乙:我用的是1mol/L。
剖析實驗現象:
乙(有沉淀)陳述:存在微粒?混合后情況?離子濃度變化?是否發生離子反應?
書寫離子方程式。
甲(無沉淀)陳述:存在微粒?混合后情況?離子濃度變化?是否發生離子反應?原因?
[歸納]微溶物作為產物的離子反應發生的條件。
【初建模型】微溶物:當溶液中某些離子濃度超過對應物質的溶解程度時,就會產生沉淀,即發生離子反應。
[設計意圖]
高一學生的認知中,難溶物是沉淀,符合離子反應發生的條件之一,但是對于微溶物的離子方程式書寫并不清晰,究其原因還是對離子反應本質的理解不到位。此處用實驗證明,即使物質相同,微觀粒子的濃度不同,得到的宏觀現象也可能會不同,讓學生直觀地認識到宏觀與微觀直接的聯系,同時初步建立起模型。甲乙學生演示實驗時安排與他們自己推測結果不同的實驗組,引發思考,對離子反應條件有深入的理解。
3.模型加工
[問題討論2]
(1)向稀的碳酸鈉溶液中通入CO2,寫出離子方程式。
(2)向飽和的碳酸鈉溶液中通入CO2,預測實驗現象?
[實驗2]向充滿二氧化碳的礦泉水瓶中滴加飽和碳酸鈉溶液,迅速密封,并充分振蕩,觀察并解釋實驗現象。
[學生活動]寫出實驗2結晶過程的離子方程式?
[歸納]可溶物作為產物的離子反應發生的條件。
[模型加工]可溶物:當溶液中某些離子濃度超過對應物質的溶解程度時,也會產生沉淀,即發生離子反應。
[設計意圖]選用碳酸鈉制備碳酸氫鈉沉淀的實驗,為解決開課情境中的問題做好鋪墊。碳酸氫鈉是一種易溶物質,設計不同濃度下的對比實驗,得到現象不同,引發學生對沉淀型離子反應條件本質的再思考。有了前面微溶物模型的建立,對易溶物沉淀的現象的解釋相對容易,對模型的再加工和應用范圍的擴大,也幫助學生更好地理解了沉淀型離子反應的本質。相同物質的反應,離子方程式卻不同,現象也不同,也就意味著微觀活動不同,導致宏觀現象不同,通過微觀探析和宏觀驗證,幫助學生建立起宏觀現象和微觀活動之間的聯系。
4.解決問題
還原情境。侯氏制堿法:向飽和NaCl溶液中通入氨氣,再通入過量的CO2,其反應方程式為:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
2NaHCO3=Na2CO3+CO2↑+H2O
給出Na2CO3、NaCl、NH4HCO3、NaHCO3、NH4Cl、NaOH等物質的溶解度,設計問題:
(1)NaCl溶液為什么要飽和?
(2)將二氧化碳通入氨的氯化鈉飽和溶液中,如果沒有NH3,直接通CO2會得到沉淀嗎?
(3)請寫出沉淀過程的離子方程式。
(4)NaOH溶解度大,能夠提供濃度較大的Na+,CO2又能和OH-反應得到HCO3-,為什么不選?
(5)通二氧化碳先產生的是Na2CO3,為什么要先得到NaHCO3,而不是直接獲得Na2CO3?
[設計意圖]通過一系列的問題思考,引導學生利用已建立的模型,解釋侯氏制堿法中要獲得NaHCO3晶體,本質上要得到濃度足夠大的Na+和HCO3-,再次將微觀活動和宏觀現象聯系在一起。
5.拓展應用
(1)硝酸鉀晶體的制備:工業上多以硝酸鈉和氯化鉀為主要原料生產硝酸鉀,副產品為氯化鈉。(2)硫酸亞鐵氨的制備。
[設計意圖]
《實驗化學》中這兩節內容的制備原理與本節課內容相一致,在此整合引入,拓寬學生視野,明白沉淀型離子反應的應用在實際工業生產中較為廣泛,也是對本節課建立的模型的應用,同時也為高二的實驗化學的學習做好準備。
六、總結與反思
1.明確思想,注重設計
目前發展核心素養的教學被廣泛關注,核心素養如何被滲透于教學中,最重要取決于教師對課堂的設計。不同的理念會篩選出不同的教學思想,選用不同的教學策略。認真思考課程的內容,深入挖掘內容背后所能夠提升的學科素養,才能更好地融入課程設計,提高課堂的有效性。課前充分的準備和設計,能夠使課堂節奏緊湊,環環緊扣,提高課堂效率。
2.做好實驗,深度探索
化學是以實驗為基礎的學科,在化學教學中,實驗是不可或缺的教學手段。實驗是宏觀辨識的最有力的工具,實驗的設計取材應為教學設計服務。特別是當實驗結果與原有認知相沖突的時候,學生會產生較強的求知欲,分析原因,重新認知,對已有知識重新梳理、完善。
3.評價設計,略有欠缺
本次教學設計和實踐過程中,評價的設計不夠到位,在課堂中的評價局限于離子方程式的書寫,問題的解決程度,以定性的評價為主。形式上以教師評價為主,也可以充分發揮學生自評和互評。課后評價可以設計針對核心素養目標設計問題,形成定量的數據反饋。
【參考文獻】
[1]邱美虹,鐘建坪.模型觀點在化學教科書中的角色與對化學教學之啟示[J].化學教學,2014(1):3-6.
[2]雷范軍.新課程教學中強化訓練化學模型方法初探[J].化學教育,2006,27(4):17.
[3]中華人民共和國教育部制定.《普通高中化學課程標準》(2017年版).北京:人民教育出版社,2017.
(作者單位:杭州市余杭實驗中學)

