早期異常卵裂不影響囊胚染色體整倍性
王江,熊順,韓偉,付濤,魏彪,梁延峰,鄒佳益,黃國寧*
(1.重慶市婦幼保健院生殖醫學中心,重慶 400013;2.人類胚胎工程重慶市重點實驗室,重慶 400013)
胚胎選擇是體外受精(in vitro fertilization,IVF)技術的關鍵環節,選擇具有最佳發育潛能的胚胎一直是胚胎學家致力于解決的難題。胚胎形態學評分已有幾十年的歷史,主要是通過評估卵裂球的數量、對稱性以及碎片率來篩選胚胎,胚胎學家認為典型的卵裂模式使每輪有絲分裂后細胞數量翻倍,表現出這種分裂模式的胚胎更有可能經歷了正常的有絲分裂,能夠忠實地復制受精時的遺傳物質。盡管一些新的方法如代謝物分析、呼吸率測定、基因表達和整倍體篩查等逐漸用于胚胎選擇,然而形態學評分具有經濟、快速、無創等優勢仍為胚胎選擇首選方法[1]。近年來新起的延時成像(time-lapse)技術能夠對胚胎體外發育全過程進行監控,獲取胚胎發育的動態信息。Time-lapse 在胚胎形態學評分的基礎上,引入了胚胎分裂時間和異常分裂的概念,彌補了形態學評分的主觀性和靜態觀察的局限性,能更加有效預測卵裂期胚胎發育潛能[2-3]。
Time-lapse技術的應用,使得胚胎發育動力學過程的更多細節被揭示,一些特殊的卵裂模式被胚胎學家認識、研究。常見的特殊卵裂模式有直接卵裂、逆卵裂、不規則卵裂。直接卵裂又分為:多極直接卵裂,即1個細胞直接分裂產生2個以上子細胞;快速直接卵裂,與直接卵裂相同之處在于每次分裂時產生2個以上子細胞,但快速直接卵裂的胚胎首先表現為正常的1-2細胞分裂,隨后發生早成分裂產生3個或更多的子細胞,兩次有絲分裂之間無分裂間期[4-5]。早期胚胎異常卵裂發生率高達40%[5]。研究發現異常卵裂會直接影響人類胚胎單個細胞的基因組,導致染色體丟失、嵌合,從而降低胚胎發育潛能,導致胚胎發育阻滯,囊胚形成率顯著降低[6-7]。
眾所周知,染色體非整倍性及早期植入胚胎中不正確的染色體拷貝數,是影響IVF成功的關鍵因素,它會導致植入失敗、早期妊娠丟失或染色體異常妊娠持續進行,因而異常卵裂胚胎在臨床上的應用一直困擾著胚胎學家。目前鮮有對異常卵裂囊胚整倍體率評估的相關研究報道。本研究旨在通過比較不同卵裂模式囊胚的整倍性來評估異常卵裂囊胚的應用價值,為異常卵裂胚胎的臨床應用提供一個最佳的實驗室策略。
資料和方法
一、研究對象
回顧性分析了2020年于重慶市婦幼保健院生殖醫學中心接受植入前遺傳學檢測(preimplantation genetic testing,PGT)患者夫婦的臨床資料。
納入/排除標準:根據中華醫學會生殖醫學分會的技術規范,所有進行PGT治療的夫婦均具備PGT適應癥[8];排除自然周期PGT患者、單基因疾病植入前遺傳學診斷(PGT-M)患者和睪丸取精患者。
本研究納入符合條件的300個植入前非整倍體或染色體結構變異遺傳學檢測(PGT-A/SR)周期,共1 048枚活檢囊胚。
二、研究方法
1.控制性促排卵:采用常規促排卵方案,包括長方案、拮抗劑和微刺激方案。結合血清性激素水平和B超監測卵泡發育情況,當2個及以上主導卵泡直徑≥18 mm或者3個及以上卵泡直徑≥17 mm時,注射HCG(珠海麗珠)并于35~36 h后超聲引導下經陰道行穿刺取卵。
2.精液處理和受精培養:男方禁欲3~7 d,取卵日手淫取精,待精液液化后采用密度梯度離心法處理精液,將精液清洗后放于培養箱備用。ICSI受精:取卵后2 h將取出的卵丘-卵母細胞復合體置于40 U預熱的透明質酸酶中用巴氏吸管輕柔地反復吹打,去除大部分顆粒細胞(透明質酸酶作用時間約20 s)。然后轉入MOPS體外操作液,換用口徑較細的巴氏吸管繼續吹打去除多余的顆粒細胞并在脫顆粒細胞后3~6 h內完成ICSI受精,將受精卵轉入G1(Vitrolife,瑞典)培養基中放入Time-lapse培養箱Embryoscope+(Vitrolife,瑞典)中培養,培養至第3天,將正常受精發育胚胎對應轉入G2(Vitrolife,瑞典)培養基中繼續培養。
3.胚胎活檢和發育動力學參數標注:選擇D5或D6發育至囊胚、Gardner評分[9]在3BC/3CB及以上的可用囊胚行滋養外胚層活檢,活檢細胞送公司(上海億康醫學檢驗公司,嘉寶仁和醫療科技有限公司)擴增后進行高通量測序診斷分析。同時標注活檢胚胎發育到8細胞期的動力學參數和卵裂模式。標注時,參照“輔助生殖實驗室技術”指南[10],將第2天胚胎中直徑大于45 μm的細胞質結構定義為細胞,最后依據不同的卵裂模式對胚胎整倍性進行分組比較。
4.囊胚分組:依據胚胎動態發育模式將其分為正常卵裂(n=826)和異常卵裂(n=167)組;異常卵裂中的直接卵裂又分為快速直接卵裂(n=87)和多極直接卵裂(n=41)組。
5.胚胎移植及妊娠判斷:整倍體胚胎解凍后在腹部B超的引導下進行單囊胚移植。移植后14 d監測血HCG,28 d后行超聲檢查,見胎心搏動判斷為臨床妊娠。比較囊胚正常卵裂和異常卵裂的臨床妊娠結局。
三、統計學處理
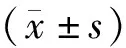
結 果
一、納入周期及活檢囊胚
本研究納入的300個PGT-A/SR周期中PGT-A周期101個,PGT-SR周期199個,共獲得1 048枚活檢囊胚,55枚囊胚由于解凍卵母細胞、解凍胚胎或診斷失敗導致數據信息缺失,最終993枚胚胎數據有效用于分析比較,其中826枚胚胎(83.18%,826/993)早期卵裂正常,167枚(16.82%,167/993)胚胎早期卵裂異常。993枚胚胎中,PGT-A周期胚胎數387枚,其中318枚胚胎(82.17%,318/387)早期卵裂正常;PGT-SR周期胚胎數606枚,其中508枚胚胎(83.82%,508/606)早期卵裂正常。本研究中,兩種不同指征PGT活檢囊胚卵裂模式無統計學差異(P>0.05)。
二、正常卵裂和異常卵裂囊胚組患者基礎資料及PGT結果
兩組之間患者年齡、體質量指數(BMI)、Gn用量以及臨床用藥方案、精液質量、PGT類型構成等均無統計學差異(P>0.05);進一步比較二者染色體整倍性發現,兩組間染色體整倍體率、非整倍體率和嵌合體率亦均無統計學差異(P>0.05)(表1),早期異常卵裂并不影響形成囊胚的整倍性。
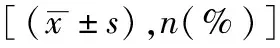
表1 正常卵裂與異常卵裂囊胚組患者基礎資料及PGT結果
三、直接卵裂囊胚亞組患者基礎資料及PGT結果
異常卵裂囊胚組中,直接卵裂囊胚128枚,其中快速直接卵裂囊胚有87枚(52.10%,87/167)、多極直接卵裂有41枚(24.55%,41/167),快速直接卵裂囊胚比例高于多極直接卵裂囊胚。41枚多極直接卵裂囊胚中,僅有6枚發生于第1次有絲分裂異常,第1次有絲分裂多極直接卵裂囊胚發生率構成比低于第2次、第3次直接卵裂。同時,直接卵裂囊胚發育融合過程中至少有44枚觀察到未融合游離細胞存在。此外,逆卵裂、復雜異常卵裂囊胚有39枚,其中有17枚表現為快速卵裂后伴隨逆卵裂發生。
快速直接卵裂和多極直接卵裂兩組之間患者年齡、BMI、Gn用量以及臨床用藥方案、精液質量、PGT類型構成等均無統計學差異(P>0.05),兩組囊胚整倍體率也無統計學差異(P>0.05)(表2)。
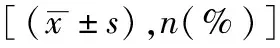
表2 直接卵裂囊胚亞組患者基礎資料及PGT結果
四、早期不同卵裂整倍體囊胚移植結局
正常卵裂與異常卵裂整倍體囊胚的臨床妊娠及流產率均無顯著性差異(P>0.05)(表3),卵裂模式不影響整倍體囊胚臨床結局。此外,13個直接異常卵裂整倍體囊胚移植周期中12個周期獲得臨床妊娠,不同異常卵裂(快速直接卵裂和多極直接卵裂)整倍體囊胚的臨床妊娠率及流產率無明顯差異(表3)。
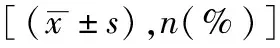
表3 不同卵裂來源整倍體囊胚移植結局
討 論
人類胚胎發育從受精卵開始,經歷一系列有絲分裂事件分裂、分化形成,整個有絲分裂過程按特定的規律進行,嚴格遵循每輪有絲分裂后細胞數量翻倍(1-2-4-8細胞)。但胚胎體外有絲分裂實際過程中,會發生一些特殊分裂活動(異常卵裂)。這些特殊分裂通常導致胚胎遺傳物質異常,嚴重影響胚胎的發育潛能[11]。McCollin等[6]的研究證實異常卵裂會直接影響人類胚胎單個細胞基因組,從而導致染色體丟失、嵌合和胚胎發育停滯。Lagalla等[7]研究了100多例異常卵裂胚胎,其中,有78.4%的胚胎因發育停滯或胚胎質量差而丟棄,并且卵裂期停滯的頻率最高。這些發現與本研究中正常卵裂和異常卵裂囊胚構成比一致,本研究993枚活檢囊胚中83.18%早期卵裂正常,僅有16.82%早期卵裂異常,異常卵裂胚胎囊胚形成率低。然而,通過進一步比較發現異常卵裂不影響囊胚染色體整倍性。胚胎發育過程中的自我篩選、自我校正和低比例嵌合可以解釋這一現象:(1)自我篩選:異常胚胎發育阻滯淘汰了大部分染色體異常胚胎,篩選出部分具有發育潛能的二倍體胚胎。相關研究也證實了發育阻滯胚胎非整倍體率更高[11-12]。(2)自我矯正:異常卵裂主要導致子細胞遺傳物質的增加或減少,這類異常子細胞在細胞壓實過程中無法正常融合而被排除[7,12]。本研究觀察到26.35%(44/167)早期異常卵裂胚胎在融合期有未融合的游離細胞,游離細胞最終以退化、空泡化、碎片化或直接排出等方式消失,也支持了胚胎自我矯正假說,即通過排除染色體異常細胞來實現染色體的整倍性。此外,第二種自我校正方式是三極分裂產生的三個子細胞中,有兩個在分裂末期又發生融合,形成一個雙核細胞[13]。本研究39枚有逆卵裂活動的胚胎中43.59%(17/39)經歷了一個1-3-2的快速卵裂活動。(3)異常細胞以嵌合方式存在:嵌合體發生在15%~90%的卵裂期胚胎中,當前診斷技術無法檢測出低比例嵌合,嵌合位置、比例和所涉及的染色體決定胚胎臨床結局,因而嵌合體胚胎也有機會發育成健康胎兒,目前臨床上已有嵌合體胚胎移植健康胎兒出生報道[14-15]。
本研究還比較了兩種直接卵裂模式與囊胚整倍體率的相關性,結果表明不同直接卵裂模式不影響囊胚整倍性。活檢囊胚中快速直接卵裂和多極直接卵裂的比例分別是52.10%、24.55%。有文獻報道,直接卵裂和多極直接卵裂的發生概率分別是18.0%、8.0%[5,16],由此猜想快速直接分裂對胚泡形成的破壞似乎更小。它與多極有絲分裂不同的是,快速分裂產生的細胞系并不都是亞二倍體,基因的分割只會發生在兩個產生的子細胞中,仍會留下一個二倍體細胞繼續正常發育和囊胚形成,而多極卵裂胚胎的發育能力取決于錯誤分裂發生的階段,異常卵裂發生越早,染色體非整倍性越高。如果第一次有絲分裂發生直接卵裂可能會產生三個核型明顯完全不同的細胞,胚胎發育成整倍體的幾率小[17]。本研究由41枚多極卵裂發育而來囊胚中,僅6枚多極卵裂發生在第1次有絲分裂,胚胎發育潛能差,與文獻報道一致。因此區分這兩種類型的直接卵裂很重要,它們可能發育至囊胚的幾率不同,這對細胞期移植胚胎選擇具有指導意義,但兩種卵裂來源囊胚整倍體率及發育潛能無明顯差異。由于樣本量限制,這一結論有待進一步驗證。
異常卵裂發生機制尚不清楚。Boveri等[18]發現中心體周期調節受損可導致多極紡錘體的形成,可能是直接卵裂的發生機制。中心體調節功能受遺傳、環境和精子等因素影響。精子質量是影響異常紡錘體形成的一個因素,因為精子中心體控制受精后第一次有絲分裂[19]。例如精子氧化應激反應、DNA碎片等都會增加直接卵裂和逆卵裂發生風險[20]。有文獻報道逆卵裂的發生與促排方案相關[21];母體年齡也會影響卵裂模式[22]。此外,遺傳因素也會影響卵裂活動,有文獻報道母體plk4中心體調控因子變異很可能使胚胎發生減數分裂和有絲分裂錯誤[23]。然而,本研究由于樣本量限制,納入了199個PGT-SR周期,該周期患者主要存在一方或雙方染色體易位問題。文獻回顧,目前未見染色體易位患者胚胎異常卵裂率高于染色體正常人群的相關報道,從本研究結果部分可知PGT-SR組胚胎異常卵裂率與PGT-A組沒有明顯差異。由此看來,胚胎異常分裂與有絲分裂相關細胞器及相關調控組件關系更密切。
雖然早期異常卵裂胚胎染色體異常率高,發育能力差,但本研究通過比較囊胚期不同卵裂模式胚胎的整倍體率發現,早期異常卵裂并未顯著影響到囊胚染色體整倍性。眾所周知,非整倍體在早期人類胚胎中普遍存在,是導致妊娠失敗的主要因素,本研究通過比較正常卵裂和異常卵裂整倍體囊胚的移植結局,目前未發現二者之間存在顯著性差異,因而異常卵裂囊胚與正常卵裂囊胚可能具有相似的臨床價值。該研究結果與Ozbek等[24]報道的不一致,有必要擴大樣本量進一步研究早期異常卵裂對囊胚移植結局影響;然而,Ozbek等[24]認為異常卵裂囊胚整倍體率更高,值得斟酌。
異常卵裂會直接影響人類胚胎單個細胞基因組,從而導致胚胎發育阻滯,囊胚形成率降低。但是,我們的研究發現,早期異常卵裂胚胎發育到囊胚期其染色體整倍性及發育潛能與正常卵裂囊胚并沒有明顯差異。因此,胚胎移植、凍存時,優先選擇卵裂正常的細胞期胚胎;對于異常卵裂胚胎建議行囊胚培養后選擇利用,具有與正常卵裂胚胎相似的臨床價值。

