抗破傷風類毒素單克隆抗體的制備與鑒定①
董國霞 張華捷 晁哲 田霖 侯啟明 譚亞軍 馬霄(中國食品藥品檢定研究院百白破疫苗和毒素室,衛生部生物技術產品檢定方法及其標準化重點實驗室,北京102629)
破傷風疫苗是預防破傷風的有效途徑,破傷風類毒素是破傷風疫苗的主要有效組分,破傷風疫苗效價檢測是疫苗有效的重要指標。本研究擬通過抗破傷風類毒素單克隆抗體的制備為破傷風疫苗效價檢測新方法的建立、低含量破傷風類毒素測定、吸附度測定等奠定基礎,以提升我國破傷風疫苗質量控制水平。
1 材料與方法
1.1 材料破傷風類毒素由本室提供;HRP標記的羊抗鼠二抗為Invitrogen產品;石蠟油為MP Bio‐medical產品;DMEM培養液、胎牛血清為Gibco產品;G蛋白柱為GE Healthcare產品;超濾管為Milli‐pore產品;96孔聚苯乙烯酶標板為Greiner Bio-One GmbH產品;抗體亞類鑒定試劑盒為Proteintech產品;其他常用試劑均為國產分析純;SP2/0骨髓瘤細胞由本室保存;BALB/c小鼠、昆明小鼠由中國食品藥品檢定研究院實驗動物生產與供應室提供。3K30高速冷凍離心機為Sigma產品;5810R低速離心機為Eppendorf產品;AKTA層析系統為Amer‐sham pharmacia biotech產 品;Biacore T200為GE Healthcare產品;酶標儀為Bio-Tek產品;電泳儀為Bio-Rad產品。
1.2 方法
1.2.1 抗破傷風類毒素單克隆抗體的制備及純化[1-2]選擇純度較好的破傷風類毒素抗原對BALB/c雌性小鼠進行免疫,按常規方法將小鼠脾細胞與骨髓瘤細胞SP2/0融合,把篩選后獲得的陽性雜交瘤細胞株進行擴種、保存。取BALB/c雌性小鼠,每只腹腔注射0.5 ml石蠟油,10 d后每只小鼠腹腔注射1×106個雜交瘤細胞,注射1周后收集腹水,3 000 r/min離心20 min,收集中間層,-20℃凍存。用AKTA層析系統和Protein G柱對收集的中間層進行純化。
1.2.2 單克隆抗體的效價檢測[3]用破傷風類毒素包被96孔酶標板,4℃孵育過夜,洗板后第一行加入稀釋的單克隆抗體,倍比稀釋至第8行,37℃孵育1 h,洗板后加入過氧化物酶標記的羊抗鼠二抗,37℃孵育1 h,洗板后加入OPD顯色液,孵育10 min,在波長490 nm/630 nm處用酶標儀檢測其OD值。以P/N≥2.1的抗體最大稀釋度作為其抗體效價。
1.2.3 單克隆抗體的亞類鑒定用Proteintech抗體亞類鑒定試劑盒按其說明書操作步驟對單克隆抗體進行亞類檢測。
1.2.4 單克隆抗體的親和力測定利用Biacore T200檢測單克隆抗體與破傷風抗原的親和力數據。按Mouse Antibody Capture Kit說明書通過氨基偶聯法固定鼠源抗體至CM5芯片上,加入合適濃度的破傷風抗原,分別與不同單克隆抗體進行結合再解離,所得傳感圖利用其分析軟件進行擬合,獲得抗體與抗原的親和力數據。
1.2.5 單克隆抗體的蛋白濃度測定用NanoDrop 2000分光光度計的Protein A280進行單克隆抗體的蛋白濃度檢測。
1.2.6 單克隆抗體的純度分析[4]將純化的單克隆抗體用SDS-PAGE電泳進行純度分析。
1.2.7 單克隆抗體的特異性分析[5-6]用破傷風類毒素(T)、白喉類毒素(D)、百日咳毒素(PT)、百日咳絲狀血凝素(FHA)和百日咳黏附素(PRN)分別包被酶標板,4℃孵育過夜,洗板后各包被抗原分別加入T1、T2、T3、T4、T5單克隆抗體,同時設陽性對照、陰性對照,之后同1.2.2中操作。
1.2.8 單克隆抗體的中和活性分析[7]按2015版藥典破傷風抗毒素效價測定法測定單克隆抗體的中和活性。試驗分別設樣品組、標準組、毒素組和空白組;樣品組中昆明小鼠注射T1、T2、T3、T4、T5單克隆抗體各稀釋度與毒素中和后的溶液及T1、T2、T3、T4、T5單克隆抗體混合后各稀釋度與毒素中和后的溶液(分別為T1樣品組、T2樣品組、T3樣品組、T4樣品組、T5樣品組和T6樣品組),樣品組分為3個不同的稀釋度;標準組中昆明小鼠注射破傷風抗毒素標準品與毒素中和后的溶液;毒素組中昆明小鼠只注射稀釋后的毒素溶液;空白組中昆明小鼠只注射緩沖液;注射后連續5 d觀察小鼠存活情況。
1.2.9 雜交瘤細胞株穩定性檢測T1、T2、T3、T4、T5雜交瘤細胞株在液氮罐凍存2個月及13個月后各復蘇1次,檢測復蘇后細胞培養上清效價;并在13個月解凍后連續培養傳至20代,每5代檢測1次細胞培養上清效價,以檢測雜交瘤細胞的活性和分泌抗體的穩定性。
2 結果
2.1 制備及純化抗破傷風類毒素單克隆抗體通過制備、純化獲得T1、T2、T3、T4、T5共5個抗破傷風類毒素單克隆抗體。
2.2 效價檢測檢測T1、T2、T3、T4、T5單克隆抗體的腹水效價為1∶1.60×106~1∶1.28×107,純化后其效價為1∶3.20×106~1∶1.28×107,見表1。
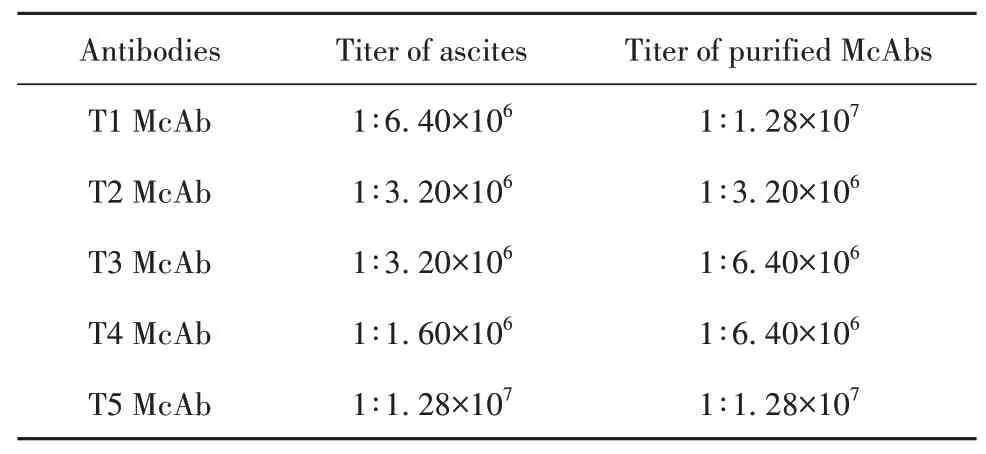
表1 腹水及純化單克隆抗體效價(McAbs)Tab.1 Titer of ascites and purified monoclonal antibodies(McAbs)
2.3 抗破傷風類毒素單克隆抗體的亞類鑒定用抗體亞類鑒定試劑盒對5株單抗進行鑒定,結果表明5株單抗分別為IgG1、IgG2b亞類,輕鏈均為к型,如表2所示。
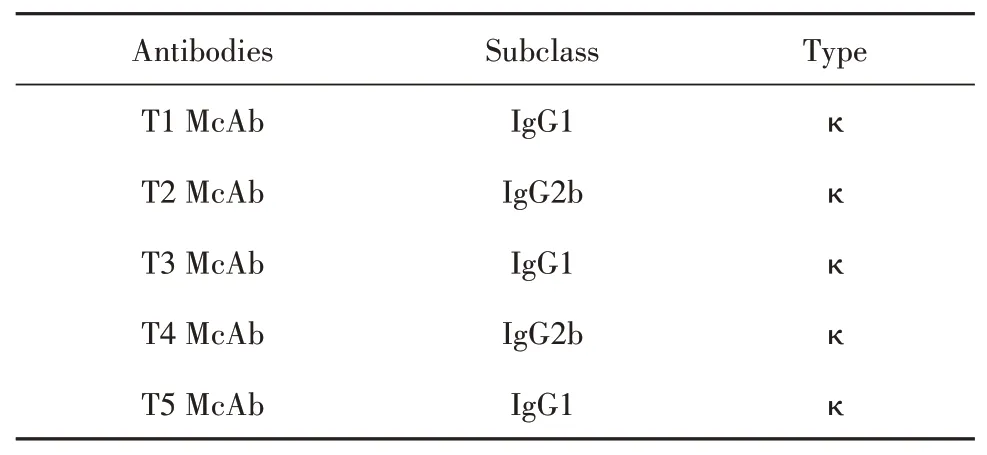
表2 抗體亞類鑒定Tab.2 Identification of antibody subclass
2.4 單克隆抗體的親和力測定通過Biacore檢測單克隆抗體與破傷風類毒素的親和力,見圖1~5,T1、T2、T3、T4、T5單克隆抗體與破傷風類毒素的親和力數據分別為5.455E-9 M、2.074E-8 M、2.050E-9 M、2.021E-9 M和1.295E-9 M。
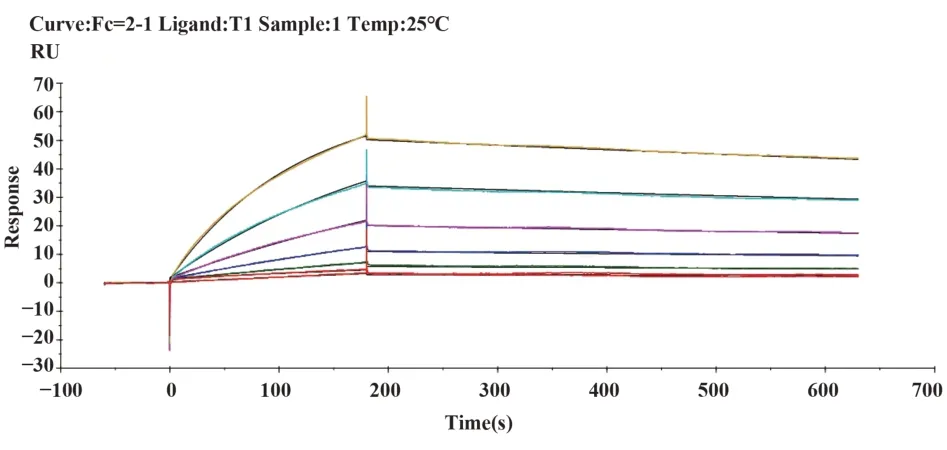
圖1 T1單抗結合動力學曲線Fig.1 Binding dynamics curve of T1 McAb
2.5單克隆抗體的蛋白濃度測定通過NanoDrop 2000分光光度計Protein A280檢測抗破傷風類毒素單克隆抗體T1、T2、T3、T4、T5的蛋白濃度分別為:15.126 mg/ml、5.772 mg/ml、12.278 mg/ml、12.58 mg/ml和16.301 mg/ml。
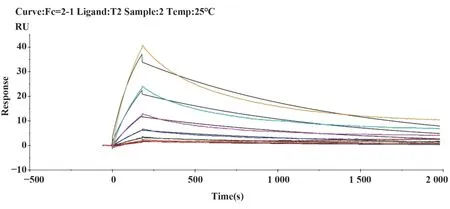
圖2 T2單抗結合動力學曲線Fig.2 Binding dynamics curve of T2 McAb
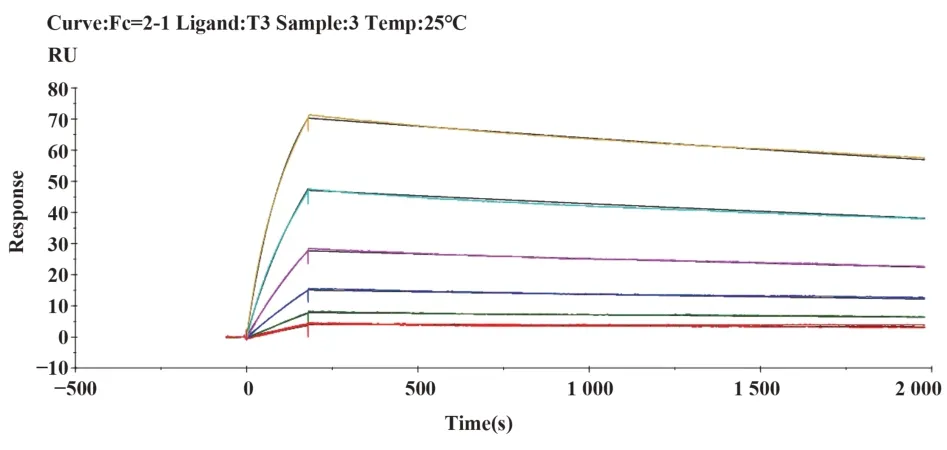
圖3 T3單抗結合動力學曲線Fig.3 Binding dynamics curve of T3 McAb
2.6 單克隆抗體的純度分析將純化的單克隆抗體用SDS-PAGE電泳進行純度分析,電泳結果顯示各單克隆抗體具有較好的純度,分子量在預期范圍內,見圖6。
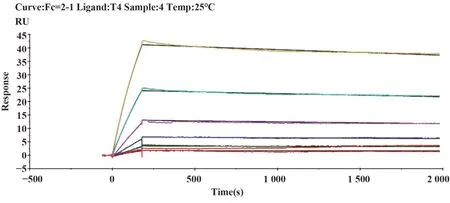
圖4 T4單抗結合動力學曲線Fig.4 Binding dynamics curve of T4 McAb
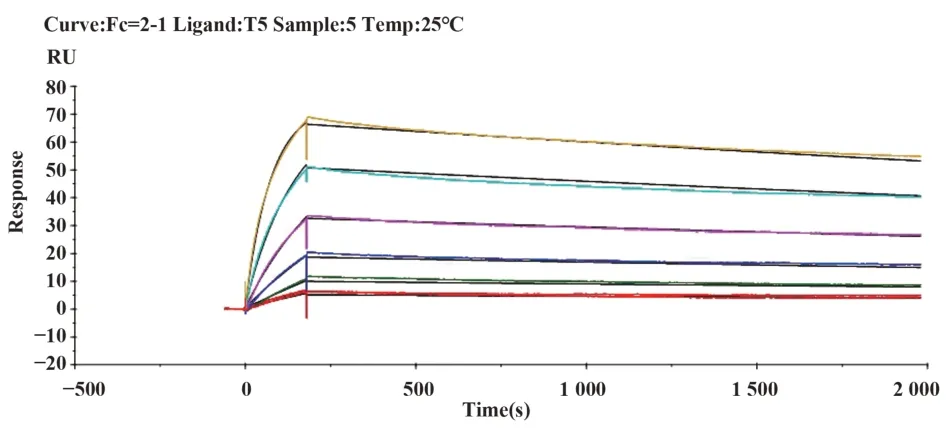
圖5 T5單抗結合動力學曲線Fig.5 Binding dynamics curve of T5 McAb
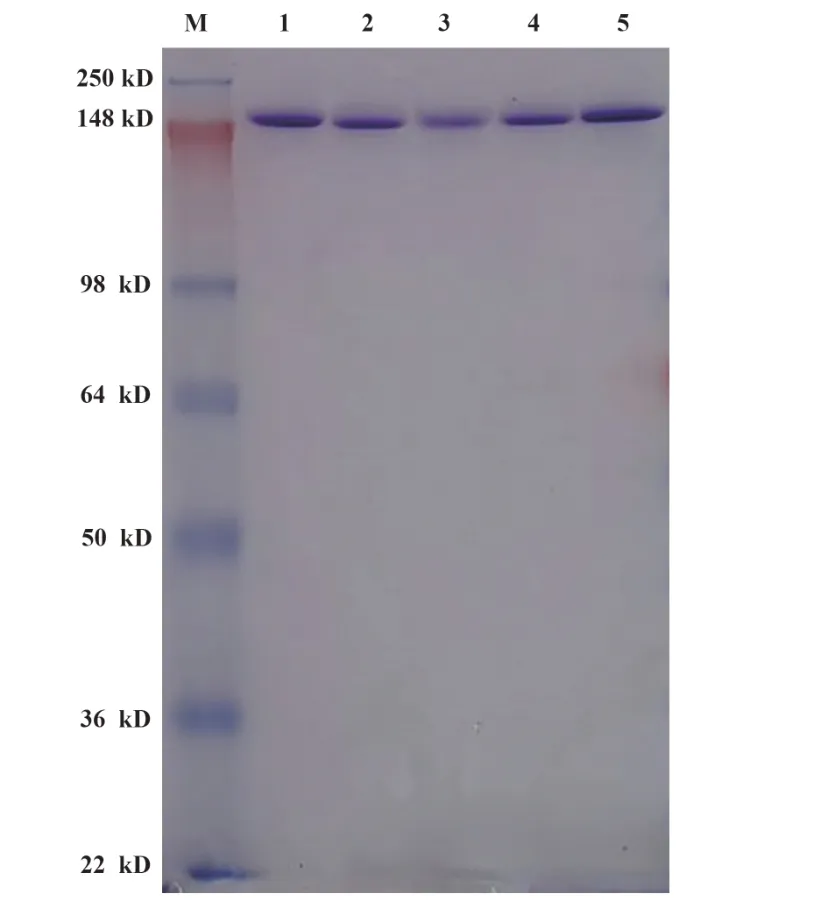
圖6 單克隆抗體的SDS-PAGE電泳Fig.6 SDS-PAGE electrophoresis of McAbs
2.7 單克隆抗體的特異性分析采用ELISA法對T1、T2、T3、T4、T5單克隆抗體的特異性進行分析,檢測結果見表3,從表中可以看出T1、T2、T3、T4、T5單克隆抗體與T抗原具有較好的反應,而與百白破疫苗中的D抗原、PT抗原、FHA抗原和PRN抗原無交叉反應,說明T1、T2、T3、T4、T5單克隆抗體均具有較好的特異性。
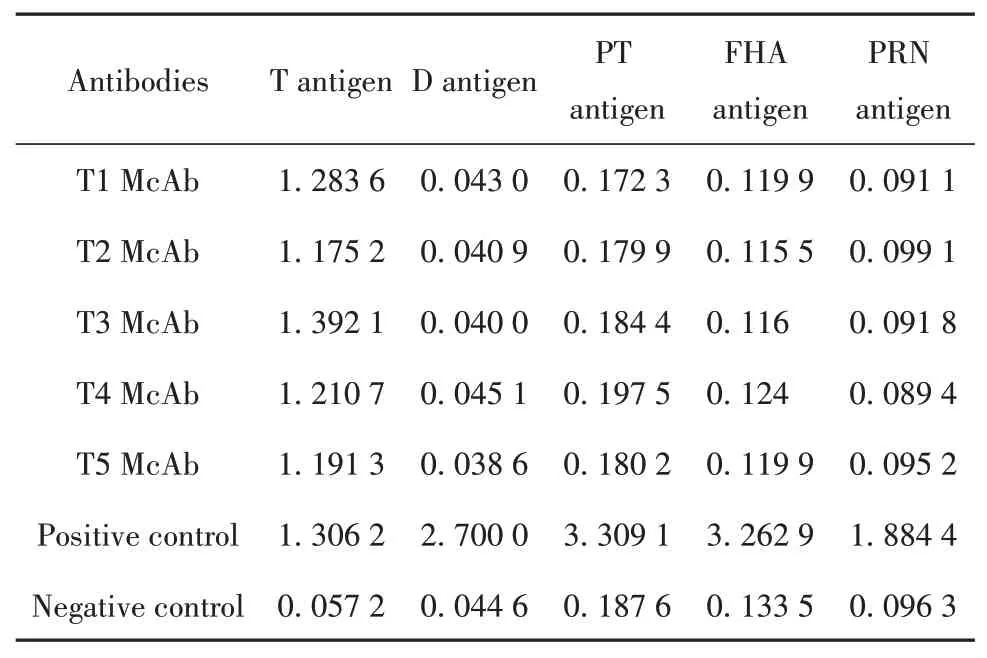
表3 ELISA法對單抗的特異性分析Tab.3 Specific analysis of monoclonal antibodies by ELISA
2.8 單克隆抗體的中和活性分析注射后小鼠存活情況如表4(表中T1-1為低稀釋度,T1-2為中稀釋度,T1-3為高稀釋度,下同)。標準組小鼠在注射后24 h均存活,無發病癥狀,24 h之后開始發病,第5天時全部死亡。空白組和T6樣品組各稀釋度小鼠在注射后5 d內均存活,且無癥狀。毒素組和T2樣品組小鼠在注射后16 h全部死亡。T1、T3、T4、T5樣品組在注射16 h后均有小鼠存活,T1-1有1只小鼠存活,T1-2、T1-3小鼠均死亡,由于T1-1僅有1只小鼠存活,不能確定其是否為中和性抗體;T3-1組的3只小鼠均存活,T3-2、T3-3小鼠均死亡,判斷其為中和性抗體;T4樣品組低、中稀釋度無小鼠存活,而高稀釋度有1只小鼠存活,但發病癥狀明顯;T5樣品組各稀釋度均有小鼠存活,T5-1、T5-2、T5-3的小鼠分別存活3只、2只、1只,隨稀釋度由低到高小鼠存活呈一定梯度,24 h時T5-1的3只小鼠仍存活,T5-2、T5-3的小鼠均死亡,判斷其為中和性抗體。

表4 各組小鼠存活情況Tab.4 Survival numbers of mice in each group
2.9 雜交瘤細胞株穩定性檢測穩定性檢測如表5,結果顯示雜交瘤細胞株在凍存2個月、13個月后復蘇及連續培養20代后,細胞上清效價未見明顯變化,表明其均能分泌特異性抗體,且分泌能力基本保持不變。
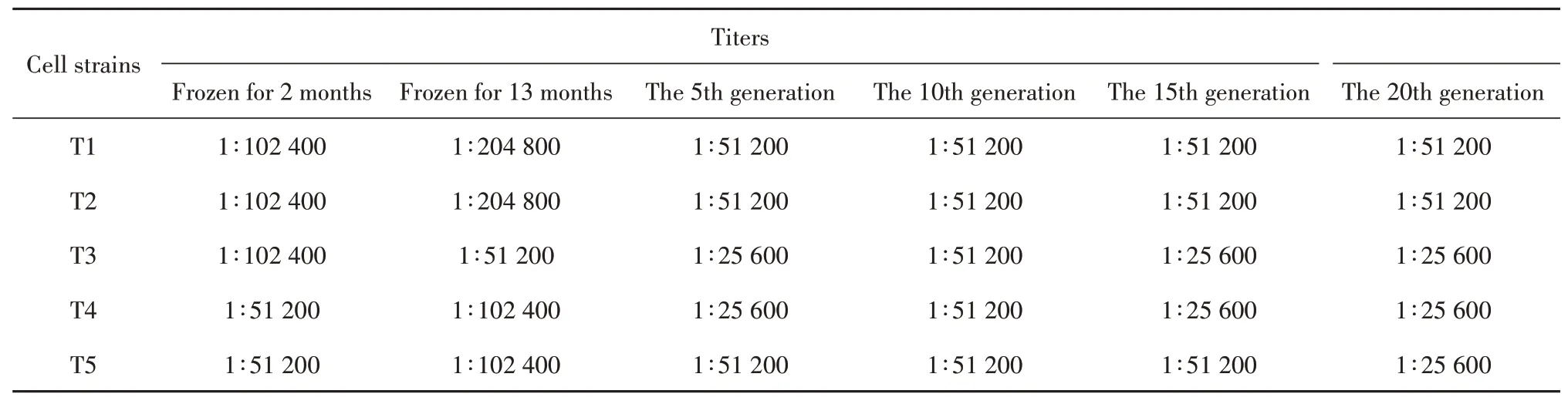
表5 雜交瘤細胞株分泌抗體穩定性檢測Tab.5 Stability test of antibodies secretion by hybridoma cell strains
3 討論
辛酸-硫酸銨鹽析和G蛋白親和層析是純化單克隆抗體時常用的兩種方法,本課題組曾用兩種方法分別對單克隆抗體進行純化,辛酸-硫酸銨鹽析法成本低,一次可進行大量樣品的純化,但回收率遠低于文獻報道的39%~90%[2,8-10],可能與不同抗體類型及不同來源的樣品有關,G蛋白親和層析法純化后單克隆抗體的回收率和純度均較好,因此本研究采用G蛋白親和層析柱進行純化。
本研究純化的T3、T5單克隆抗體對破傷風毒素具有中和作用,當把5個單克隆抗體混合后顯示了更強的毒素中和作用,其與破傷風毒素的作用有待進一步研究。
破傷風疫苗效價是保證疫苗能有效預防疾病的重要指標,當前我國吸附破傷風疫苗效價檢測采用的是小鼠和豚鼠攻毒法[7],所用動物量較大,檢測結果易受動物個體差異影響,且檢測成本高、工作量大、有接觸毒素的生物安全風險,不符合“減少、替代、優化”的3R動物使用原則。針對當前效價檢測方法的不足,本研究擬通過破傷風單克隆抗體的制備,將其用于破傷風抗體體外結合ELISA檢測方法中,為建立破傷風疫苗效價檢測新方法奠定基礎,實現用同一批動物血清同時檢測破傷風、白喉等多種抗體,尤其是隨著越來越多多聯多價聯合疫苗的出現,將大大減少動物的使用量、工作量和實驗成本,提升我國吸附破傷風疫苗效價檢測水平。本研究成功制備了5個破傷風單克隆抗體,其可用于破傷風疫苗效價檢測新方法的建立、破傷風類毒素含量測定和吸附度測定等。