抗CD38單克隆抗體治療多發性骨髓瘤的作用機制及研究進展①
余云艷 鄢玲利 劉白南
(遵義醫科大學免疫學教研室,貴州省基因檢測與治療特色重點實驗室,遵義563000)
隨著腫瘤免疫和細胞生物學研究的不斷深入,針對腫瘤的免疫療法也在不斷發展。腫瘤免疫治療是指直接針對腫瘤抗原,激活腫瘤抗原引起的特異性免疫,逆轉腫瘤環境中引起的免疫抑制等[1]。多發性骨髓瘤(multiple myeloma,MM)是一種惡性漿細胞型血液腫瘤,近幾年,隨著對免疫系統參與MM研究的不斷深入,單克隆抗體逐漸成為MM治療性用藥的研究熱點,治療型單克隆抗體是主要以腫瘤抗原作為靶點的免疫療法[2],其殺傷靶細胞的主要原因是腫瘤抗原在腫瘤細胞和正常細胞表面的表達差異,治療型單克隆抗體與腫瘤抗原特異性結合,通過補體依賴的細胞毒性作用(complementdependent cytotoxicity,CDC)、抗體依賴性細胞介導的細胞毒作用(antibody-dependent cell-mediated cy‐totoxicity,ADCC)、抗體依賴的細胞吞噬作用(anti‐body-dependent cellular phagocytosis,ADCP)和誘導細胞凋亡殺傷腫瘤細胞[3-4]。因此,全面認識抗CD38單克隆抗體治療MM的作用機制,可以正確引導針對腫瘤患者的免疫治療。研究表明,靶向CD38和SLAMF7的單克隆抗體在治療MM后取得了一定進展,其中位生存期可以達7~10年[5-6],在2015年,Daratumumab成為首個被批準用于治療MM的抗CD38單克隆抗體。本文將對CD38的生物學功能和抗CD38單克隆抗體的作用機制、抵抗機制和研究進展進行概括。
1 CD38的生物學功能
CD38是一種單鏈跨膜Ⅱ型糖蛋白,包括1個長的羧基端胞外區(258個氨基酸),1個跨膜區(21個氨基酸)和1個短的氨基端胞內區(21個氨基酸)。CD38基因位于4號染色體(4p15),基因跨度大于80 kb,98%的基因序列由內含子組成,該基因包含8個外顯子,其中有多個元件控制該基因的表達,包括位于CD38啟動子上游的全反式維甲酸(ATRA)反應元件[7-8]。CD38在淋巴細胞、骨髓細胞及無造血功能的組織細胞中均有表達,在MM細胞膜上呈現過表達[9-10]。目前研究表明CD38具有酶活性、黏附功能和受體功能。CD38的胞外酶活性可將煙酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)和煙酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADP+)轉化成環腺苷二磷酸核糖(cyclic adenosine diphosphate ribosyl,cADPR)和煙酸腺嘌呤二核苷酸磷酸(nicotinic acid adenine dinucleotide phosphate,NAADP)[9],而cADPR和NAADP能夠使細胞內Ca2+釋放參與鈣離子動員[11],同時,CD38的酶活性可調節NAD+水平改善蛋白酶抑制劑(protease inhibitor,PI)的功能[12]。不僅如此,在CD38黏附功能的研究中發現,CD38參與細胞間的黏附,引起細胞遷移到組織的模式有所不同。而CD38作為受體,可與T細胞、B細胞和NK細胞的表面分子CD31(CD38天然的配體)相互作用激活跨膜信號傳導,導致鈣離子動員和細胞因子分泌,從而引起T細胞和NK細胞活化[13]。因此,CD38具有多種生物學功能,在MM細胞膜上的過表達使之成為治療MM的理想靶標。
2 抗CD38單克隆抗體的作用機制
研究發現抗CD38單克隆抗體通過引起多種免疫效應機制,即CDC、ADCC、ADCP和細胞凋亡等,誘導腫瘤細胞發生免疫源性死亡(圖1)[14],其中ADCC、ADCP主要依賴抗體的Fc端與免疫效應細胞膜上表達的FcγR相互作用殺傷靶細胞。目前Dara‐tumumab已經被批準單獨用于臨床治療RRMM[15]。同時,還有其他抗CD38單克隆抗體正在進行臨床研究,包括Isatuximab和MOR202[16]。由于每種抗CD38單克隆抗體殺傷靶細胞的作用機制存在差異,對抗CD38單克隆抗體作用機制的認識可以更好地指導臨床治療研究。
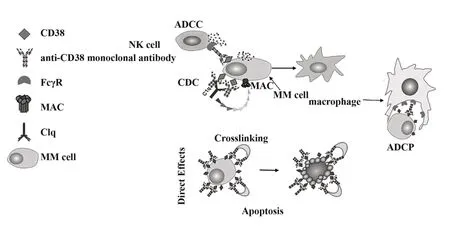
圖1 抗CD38單克隆抗體作用機制示意圖Fig.1 Schematic diagram of the action mechanism on an?ti-CD38 monoclonal antibody
2.1 補體依賴的細胞毒性殺傷機制(CDC)補體在機體的防御機制中起重要作用。其中誘導CDC是當抗CD38單克隆抗體與MM細胞表面的CD38結合形成免疫復合物后,單克隆抗體的重鏈鉸鏈區發生構型改變,暴露出補體結合位點,激活補體的經典途徑,C1q與抗CD38單克隆抗體的補體結合位點結合后,依次活化C1r、C1s、C4、C2、C3,緊接著形成C3轉化酶和C5轉化酶[17],進而形成攻膜復合體(membrane attack complex,MAC),使細胞膜形成小孔導致細胞溶解。同時隨著補體途徑的激活,C3b片段在MM細胞表面上沉積可使吞噬細胞通過補體受體識別并結合MM細胞,由此增強吞噬細胞對MM細胞的吞噬和清除功能[18]。
在目前的抗CD38單克隆抗體中,Daratumumab是最有效的CDC誘導劑[10],與之相反,MOR202誘導的CDC較弱,而Isatuximab誘導的CDC與MM細胞膜表面CD38的表達量密切相關[3]。通過對多種MM細胞系中CD38的表達和MM患者中C3相關片段的檢測證實了以上觀點,且研究發現只有當MM細 胞 膜 表 面過 表達CD38時 才 可以 誘導CDC[3,19]。由于MM細胞膜上CD38的表達存在差異,對MM患者的骨髓樣本進行CDC分析,觀察到MM細胞對Daratumumab的敏感性存在明顯的異質性,與低表達CD38的MM細胞相比,Daratumumab會優先殺死過表達CD38的MM細胞[9]。而NK細胞是免疫效應過程中發揮關鍵作用的固有免疫細胞,其表達CD38,但將來自健康捐獻者的外周血單個核細胞(PBMC)和Daratumumab共同孵育后測定CDC,分析發現CD38-/lowNK細胞、B細胞、T細胞和單核細胞并沒有誘導CDC。該研究表明Daratumumab誘導CDC可能需要細胞膜表面CD38的表達量超過某個閾值,當超過閾值時細胞表面形成的MAC就會誘導CDC的發生[20]。
2.2 抗體依賴性細胞介導的細胞毒作用殺傷機制(ADCC)NK細胞是ADCC中的主要效應細胞,通過細胞表面的FcγR介導ADCC[21]。當抗CD38單克隆抗體的Fab端與MM細胞表面的CD38結合后,Fc端與免疫效應細胞表面的FcγR結合后激活ADCC,NK細胞釋放穿孔素、顆粒酶等細胞毒性物質殺死靶細胞,此外,巨噬細胞、嗜中性粒細胞、嗜酸性粒細胞和γδT細胞也表達FcγR介導的ADCC[22]。現有的研究已經證實Daratumumab、Isatuximab和MOR202通過依賴NK細胞表達的FcγR介導ADCC殺傷MM細胞[1,23],且Daratumumab誘導ADCC的抗腫瘤活性與MM細胞和NK細胞膜表面CD38的表達量緊密相關。臨床數據顯示,MM患者首次使用Daratumumab治療后,MM細胞及其他非惡性細胞(如NK細胞、T細胞、B細胞和單核細胞)中,過表達CD38+MM細胞大量減少,同時CD38+NK細胞也會減少,而CD38+NK細胞減少會引起ADCC對MM的療效下降[19,24]。
2.3 抗體依賴的細胞吞噬作用(ADCP)腫瘤細胞的抗原決定簇(表位)與抗體的超變區相互作用后,抗體的Fc段與單核細胞和巨噬細胞膜表面存在的FcγR(主要為FcγRⅡa和FcγRⅢa)結合誘導AD‐CP,腫瘤細胞被單核細胞和巨噬細胞吞噬消化[25]。由于巨噬細胞是MM腫瘤微環境的組成部分,在體外試驗研究中,活細胞成像儀和流式細胞儀發現Daratumumab與CD38+MM細胞結合后,單個巨噬細胞能夠快速吞噬與Daratumumab結合的MM細胞。OVERDIJK等[14]用缺乏B細胞、T細胞和NK細胞的免疫缺陷SCID-BEIGE小鼠,證實了巨噬細胞的吞噬作用有助于增強Daratumumab的抗腫瘤活性,因此ADCP是Daratumumab有效殺傷MM細胞的機制,但Daratumumab誘導的ADCP與CD38的表達有關,Daratumumab不易誘導低表達CD38的MM細胞的ADCP[26]。另外,巨噬細胞與Daratumumab和其他腫瘤細胞共同培養(如Burkitt淋巴瘤細胞),能夠有效地誘導巨噬細胞吞噬淋巴瘤細胞,表明Daratumumab還可能在其他疾病中發揮免疫作用[27]。此外,Isatuximab和MOR202也能與過表達CD38+MM的細胞結合誘導ADCP[1]。
2.4 細胞凋亡有研究表明,MM細胞膜表面的CD38與抗CD38單克隆抗體結合后,可由Fc-FcγR介導,激活腫瘤細胞的胞內相關信號,誘導腫瘤細胞發生程序性死亡(programmed cell death,PCD),PCD的主要特征是細胞聚集、形態學的改變、磷脂酰絲氨酸易位、線粒體膜電位和膜完整性喪失[4,28]。目前已用正常表達FcγR的NOTAM小鼠和FcγR-/-敲除小鼠進行試驗,確定Daratumumab能通過FcγR介導的交聯引起CD38+MM細胞發生PCD[4,14]。然而Isatuximab與Daratumumab、MOR202有 所 不 同,Isatuximab與過表達CD38+的MM細胞結合后,通過經典的caspase依賴性凋亡途徑和溶酶體相關死亡途徑直接誘導PCD發生,其特點是溶酶體擴充使溶酶體膜通透性增加和組織蛋白酶、水解酶釋放[4]。另外,泊馬度胺和來那度胺與Isatuximab聯合治療可增強Isatuximab直接殺傷MM細胞的活性[3,29]。
3 抗CD38單克隆抗體抵抗機制
最近幾年的臨床數據和試驗研究顯示,抗CD38單克隆抗體在MM的治療中取得了較好的成果,但一些MM患者仍然會發展為RRMM。現有的研究指出,存在一些抵抗機制能夠影響抗CD38單克隆抗體的抗腫瘤活性,例如CD38表達量減少、CDC、ADCC、ADCP(圖2)。
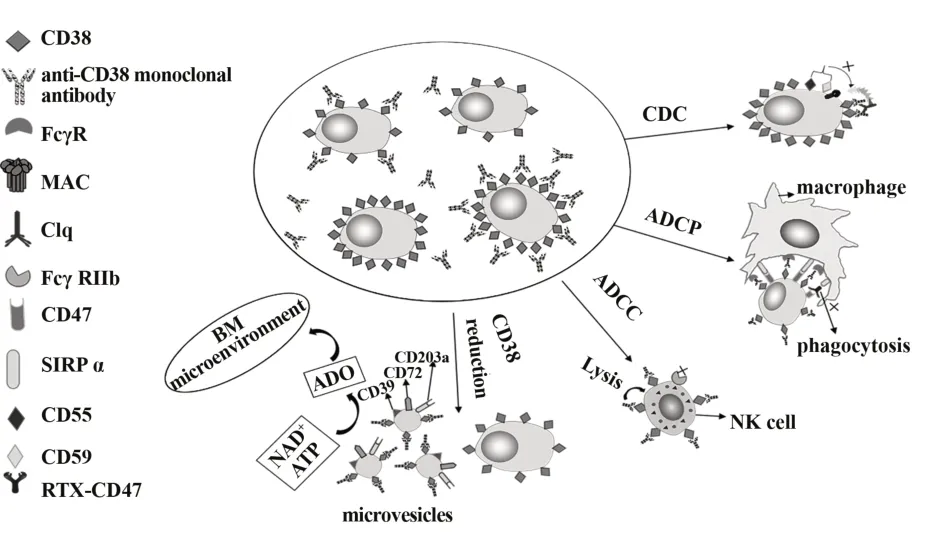
圖2 抗CD38單克隆抗體抵抗機制示意圖Fig.2 Schematic diagram of anti-CD38 monoclonal anti?body resistance mechanism
3.1 CD38表達量減少抗CD38單克隆抗體的抗腫瘤活性主要依賴于MM細胞過表達CD38,而對抗CD38單克隆抗體無反應的患者的MM細胞低表達CD38,因此可以得出CD38的表達量是抗CD38單克隆抗體治療MM患者取得良好療效的關鍵[19]。在GEN501研究中,采用流式細胞術檢測MM患者的骨髓細胞后,發現MM細胞的CD38表達減少不僅發生于Daratumumab治療期間的MM患者,還發生于進展期的MM患者[30]。然而有研究發現,Daratumumab治療MM患者后CD38表達量減少只是瞬時效應,當Daratumumab停止治療3~6個月后,CD38表達量會逐漸恢復,且Daratumumab不僅可使MM細胞表面CD38表達減少,也可使其他細胞(T細胞、B細胞、單核細胞、NK細胞)發生同一種現象[30-31]。
目前認為CD38減少的主要原因有以下兩方面(圖2),首先是Daratumumab通過ADCC和CDC選擇性殺死過表達CD38的MM細胞,使低表達CD38的MM細胞得以存活,因此可以得出CD38的過表達是Daratumumab發揮抗腫瘤活性的關鍵因素之一[32]。其次,研究發現,在37℃條件下,用Daratumumab處理MM細胞時,MM細胞骨架發生改變,通過微囊泡的形式釋放CD38[33-34]。這些微囊泡不僅表達CD38,還表達其他胞外酶(CD39、CD203a、CD73),可分解ATP和NAD+產生腺苷(ADO)釋放到腫瘤微環境中,抑制免疫效應細胞分泌多種細胞因子,誘導免疫細胞不發揮免疫效應作用,從而幫助腫瘤細胞逃逸[32,35]。另外,ATRA和免疫調節藥物(immuno‐modulatory drugs,IMiDs)能增加MM細胞表面CD38表達,因此,IMiDs和Daratumumab聯合治療時能夠增強Daratumumab的抗腫瘤活性[19]。
3.2 補體依賴的細胞毒性的抵抗(CDC resis‐tance)近年研究發現,補體激活產物或腫瘤細胞表面過表達的補體調節蛋白可通過不同的機制介導腫瘤免疫逃逸,促進腫瘤生長。如膜補體調節蛋白CD46、CD59和CD55抑制MAC的形成,從而抑制補體對腫瘤細胞的細胞毒效應,幫助腫瘤細胞逃逸和藥物抵抗[36]。
NIJHOF等[30]研究發現,Daratumumab對低表達CD55和CD59的MM細胞與淋巴瘤細胞系有較好的療效,使用特異性磷脂酶C將細胞膜上的錨定蛋白CD55和CD59水解后,明顯提高了Daratumumab對MM細胞的敏感性。而且NIJHOF等[30]的結果與GEN501和SIRIUS研究的結論一致,但在GEN501和SIRIUS研究中發現,進展期患者的MM細胞過表達CD55和CD59,表明CD55和CD59的過表達可能與Daratumumab介導CDC的抵抗機制有關[27]。更重要的是,ATRA可使腫瘤細胞表面的補體調節蛋白CD55和CD59表達減少,增加CD38表達,從而提高Daratumumab對MM細胞補體攻擊的敏感性[19]。
3.3 抗體依賴的細胞介導的細胞毒性的抵抗(ADCC resistance)抗CD38單克隆抗體介導的ADCC主要與CD38的表達量、NK細胞數和免疫效應細胞表面的FcγR緊密相關,并且能有效地活化NK細胞通過ADCC殺傷MM細胞[22]。
目前研究發現,IMiDs能夠增加CD38表達,并可與Daratumumab通過協同作用誘導ADCC殺傷MM細 胞[21]。在GEN501和SIRIUS研 究 中 發 現,Daratumumab首次治療MM患者后,其介導的ADCC會引起外周血和骨髓中CD38+NK細胞大量減少,因此NK細胞的減少會使ADCC殺傷MM細胞的能力減弱,影響Daratumumab的臨床療效,增加疾病復發的風險,然而存活的CD38-/lowNK細胞比CD38+NK細胞具有更好的增殖能力和細胞毒性,能夠有效地殺傷MM細胞[21,24]。于是WANG等[24]提出是否可以通過輸注體外擴增自體NK細胞去提高Daratumum‐ab的抗腫瘤活性。雖然目前還沒有獲得Isatuximab和MOR202減少NK細胞數的臨床數據,但在體外試驗 中,Isatuximab和MOR202也 能誘 導ADCC減 少NK細胞[37]。
抗CD38單克隆抗體的ADCC是通過免疫效應細胞表達的FcγR實現的,不同的FcγR會產生不同的作用,其中FcγRⅡA-131H和FcγRⅢA-158V與IgG型抗CD38單克隆抗體的Fc段具有高親和力,可以增強ADCC殺傷MM細胞[36]。相反,FcγRⅡb是一種抑制性受體,表達FcγRⅡb的NK細胞具有負反饋調節反應,從而影響抗CD38單克隆抗體誘導ADCC的抗腫瘤活性[37]。
3.4 抗體依賴的細胞吞噬作用的抵抗(ADCP resis‐tance)抗CD38單克隆抗體介導的ADCP與CDC和ADCC相似,也依賴MM細胞過表達CD38,且與ADCC相同,其免疫效應細胞表達不同的FcγR,也會影響ADCP清除MM的能力[19]。
最近的研究發現抗CD38單克隆抗體介導的ADCP與CD47有關,CD47是一種整合素相關蛋白,廣泛表達于正常細胞,過表達于MM細胞,當CD47與巨噬細胞上的受體信號調節蛋白(signal regulatory protein α,SIRPα)結合后,引起SIRPα胞內段免疫受體酪氨酸抑制基序(immunoreceptor tyrosine-based inhibition motif,ITIM)的酪氨酸殘基磷酸化,阻斷了吞噬信號傳遞。而CD47-SIRPα就像是一個“不要吃我的信號”,阻止了巨噬細胞對MM細胞的吞噬作用,促進MM細胞的發生和發展[38]。已有研究證明,可通過一種雙特異性抗體RTX-CD47識別CD47,并阻斷CD47-SIRPα信號傳遞,促進巨噬細胞的吞噬作用。總而言之,CD47的阻斷能增強抗CD38單克隆抗體的抗腫瘤活性[39]。另外,低劑量的環磷酰胺(CTX)能通過增加巨噬細胞表面的FcγR表達和減少腫瘤細胞上的CD47表達增強Daratumumab誘導的ADCP[37]。綜上所述,IMiDs和抗CD38單克隆抗體聯合治療MM患者也能增強ADCP。
4 抗CD38單克隆抗體治療MM的研究進展
4.1 Daratumumab目前在臨床上有許多關于MM治療的研究,其中IMiDs和蛋白酶抑制劑治療RRMM的預后效果較差,而Daratumumab具有良好的抗CD38活性[40]。Daratumumab是重組人源CD38蛋白免疫人源化轉基因小鼠后,通過雜交瘤技術獲得的一種人源化CD38 IgG1單克隆抗體。多項研究表明,無論Daratumumab單獨治療還是聯合用藥治療RRMM都具有一定的效果,根據GEN501研究的結果,在2015年Daratumumab就已經被美國食品和藥物管理局(FDA)批準可以用于治療MM的單克隆抗體藥物,在2016年被歐洲藥品管理局(EMA)批準可用于RRMM[9,41]。
在GEN501試驗中,Daratumumab是第一個作為單獨治療藥物進入Ⅰ/Ⅱ期臨床試驗階段的,該試驗分為兩個部分,首先基于3+3劑量遞增的方式去評估安全性和藥代動力學,最初對患者進行Daratu‐mumab低劑量治療,在0.005~24 mg/kg范圍內,每周靜脈注射1次連續注射8周,未發現最大耐受劑量。其次是進行評估Daratumumab的安全性和有效性,將所有患者分為8 mg/kg和16 mg/kg兩個劑量組,分別對30例和42例患者進行治療,發現16 mg/kg的總反應率(overall response rate,ORR)為36%,而8 mg/kg的ORR為10%[42]。此外,在Daratumumab的Ⅱ期SIRIUS研究中,有106例RRMM患者已經接受過 治療,將GEN501和SIRIUS對RRMM進行16 mg/kg Daratumumab治療的數據進行匯總分析后,其結果顯示ORR為31.1%,中位無進展生存期(progression-free survival,PFS)為4個月,總生存期(overall survival,OS)為20.1個 月[43]。而 在 進 行Daratumumab首次治療時,71%的患者出現了輸液相關反應,大多數患者出現的輸液相關反應是發熱、惡心、疲勞、支氣管痙攣[42]。同時MM是一種非常具有異質性的疾病,對特定藥物的敏感性不同。因此,具有重疊毒性和協同作用機制的多種藥物聯合使用是改善臨床預后的一種策略。基于抗CD38單克隆抗體殺傷靶細胞的作用機制,將抗CD38單克隆抗體與IMiD聯合治療RRMM,可顯著增強NK細胞的活性和巨噬細胞吞噬腫瘤細胞的活性,因此將藥物的聯合治療方案作為Ⅲ期試驗[44]。對569例RRMM患者進行藥物聯合試驗,每位患者之前都已平均接受了一種藥物療法,有40%的患者已經接受PI和IMiDs治療,將569例患者隨機化分組進行對照組來那度胺-地塞米松(dexamethasone)和實驗組Daratumumab+來那度胺-地塞米松治療,隨后進行了13.5個月中位隨訪,發現有169例患者發生了疾病進展或死亡,其中實驗組53例,對照組116例,對照組和實驗組12個月的PFS分別為60.1%和83.2%,ORR分別為76.4%和92.9%,完全緩解率(complete response rate,CR)分別為19.2%和43.1%。以上結果提示Daratumumab聯合治療RRMM可以改善預后,治療期間最常見的毒副反應是血小板減少、中心粒細胞減少和貧血[45]。
4.2 Isatuximab Isatuximab是一種治療MM的新的人源化IgG1單克隆抗體,其可選擇性的與惡性漿細胞表面的CD38結合[46]。如上所述,Isatuximab可通過多種機制殺傷MM細胞,Isatuximab與Daratu‐mumab和MOR202的不同之處在于不需抗體之間的交聯即可直接誘導PCD發生,而Isatuximab在非霍奇金淋巴瘤、MM、急性淋白血病的異種移植模型中也表現出抗腫瘤活性[27,47]。
首先對Isatuximab以劑量遞增的方式在RRMM患者中進行Ⅰ期評估,包括安全性、耐受性、藥代動力學、藥效學和療效,其中有許多RRMM患者已經接受過治療。當采用10 mg/kg Isatuximab治療患者時,ORR為23.8%,CR為6%,Isatuximab最大的耐受劑量可達20 mg/kg,最常見的毒副反應發生在首次注射Isatuximab,包括惡心、發熱、嘔吐、呼吸困難、咳嗽和鼻塞[48]。對Isatuximab和多種藥物聯合進行評估,隨機的選擇307例RRMM患者將其分為2組進行試驗,154例患者為實驗組,采用Isatuximab-泊馬度胺-地塞米松進行治療,而153例患者為對照組,采用馬度胺-地塞米松,隨后進行了11.6個月的中位隨訪期,實驗組和對照組的中位PFS分別為11.5個月和6.5個月,最常見的毒副反應是輸液反應、上呼吸道感染、腹瀉[47]。總之,藥物聯合治療結果表明,Isatuximab-泊馬度胺-地塞米松聯合是治療RRMM的一種有效且耐受性良好的選擇,可為患者提供新的治療方案。
4.3 MOR202 MOR202是 針 對CD38的 一 種 人 源化IgG1單克隆抗體,可通過ADCC、ADCP殺傷靶細胞,也可通過交聯反應促進細胞凋亡,但其CDC作用較弱[49]。目前研究發現,來那度胺和維生素D能夠增強MOR202介導的巨噬細胞毒性作用,補充維生 素D可提 高MOR202對MM患者的療 效[50],而MOR202在RRMM患者中進行Ⅰ/Ⅱ期試驗,MOR202的耐受劑量可達20 mg/kg,還未達到最大耐受劑量,另外來那度胺,硼替佐米也能增強MOR202的細胞毒作用,試驗研究結果顯示MOR202與來那度胺或泊馬度胺聯合治療在一定程度上控制了惡性腫瘤的發展,但需要進一步評估MOR202聯合藥物治療的安全性和療效[23]。
5 總結與展望
由于抗CD38單克隆抗體具有多效性作用機制,同時具有較高的單藥活性和與其他抗癌藥物的協同作用,目前Daratumumab單抗治療RRMM的療效已在Ⅲ期臨床試驗中得到證實,且Daratumumab與其他藥物的聯合治療RRMM也取得了一定效果。此外,其他抗CD38單克隆抗體也正在臨床試驗中。在今后的臨床研究中,應進一步加深對抗CD38單克隆抗體殺傷腫瘤細胞作用機制和抵抗機制的理解,充分利用抗體的抗腫瘤活性,促進其在腫瘤精準治療領域中的應用。