脫氧雪腐烯醇(DON)對牛卵母細胞體外成熟及發育能力的影響
孫 歡,孫克佳,姜曉龍,劉愛菊,馬曉菲,韓紅葉,姚大為,馬 毅*,田樹軍,3*
(1.河北農業大學動物科技學院,保定071001;2.天津市畜牧獸醫研究所,天津300381;3.河北省牛羊胚胎技術創新中心,保定071001)
脫氧雪腐烯醇(deoxynivalenol,DON)是一種常見的霉菌毒素,普遍存在于玉米、小麥和大麥等谷物的秸稈與籽實中。因 DON 的理化性質十分穩定,在飼料加工過程中很難將其破壞,且分子量較小,可快速穿越腸壁進入血液循環并穿越血腦屏障,所以當按每公斤體重給小鼠灌服25 mg的DON時,在5 min后便可在大腦內檢測到(0.8±0.1)μg·g-1DON[1]。當畜禽采食被DON污染的飼料后,其肉、奶、蛋中亦可檢測到DON,雌性動物則出現卵泡退化、發情異常、流產、不孕等癥狀,嚴重威脅人類和動物健康[2]。
有研究發現,DON可在牛卵泡液中發生富集,牛卵泡液中的DON濃度與血漿中的DON濃度呈正相關(y=-0.71+1.50x,y為卵泡液中 DON 濃度,x為血漿中 DON 濃度),引起卵泡中孕酮和雌二醇等生殖激素分泌紊亂[3]。眾所周知,卵泡是卵母細胞發育成熟的重要場所,并受卵泡液中生殖激素的調控。然而,DON究竟如何影響牛卵母細胞的發育成熟及其作用機制,目前尚不清楚。
卵母細胞成熟發育與包裹其外周的顆粒細胞存在復雜的聯系,顆粒細胞對卵母細胞起著營養支持及信號傳導等作用,對卵母細胞正常代謝及后續受精和胚胎發育能力都有著關鍵性的影響。顆粒細胞擴展程度越高越有利于卵母細胞與外界進行營養及信息交換,因此,卵丘顆粒細胞擴展程度可作為評判卵母細胞體外成熟效果的一個重要指標[4]。同時,在卵母細胞逐漸成熟的過程中,其胞質內部的諸多細胞器也會發生明顯的變化,例如排出第一極體可作為卵母細胞的細胞核成熟的標志,細胞質成熟則可通過線粒體分布狀態等指標進行評價。另外,活性氧(ROS)作為卵泡中重要的信號分子,在機體抗氧化系統參與下保持平衡,對保障卵母細胞成熟及其正常發育至關重要。一旦細胞內抗氧化系統不足以對抗應激所產生的ROS,細胞核中染色體就會受到不可逆損傷,使卵母細胞減數分裂無法正常進行。而機體抗氧化系統對抗ROS的分子機制則是通過上調過氧化氫酶(CAT)、谷胱甘肽過氧化物酶(GSH-Px)等相關基因表達,并通過轉錄和翻譯合成CAT、GPx等相應的抗氧化酶來實現[5]。
因此,為探究DON對牛卵母細胞體外成熟發育的影響及其作用機制,本試驗首先通過在牛卵母細胞體外成熟培養液中添加不同濃度的 DON,并檢測卵丘細胞擴展程度及第一極體排出率,構建DON毒性模型;然后,借助此模型研究DON對卵母細胞的線粒體分布及后續受精卵裂率、囊胚發育率的影響,探究DON對牛卵母細胞體外成熟及后續發育能力的影響;通過檢測體外成熟卵母細胞內的ROS、GSH水平和抗氧化基因CAT、GPx4的mRNA表達量,揭示DON影響牛卵母細胞體外發育能力的分子機制。
1 材料與方法
1.1 材料
卵巢取自屠宰場,置于盛有含80 IU·dL-1雙抗的37 ℃生理鹽水(經下簡稱“生理鹽水”)的保溫杯中,于4 h內運送至實驗室。用新鮮生理鹽水清洗卵巢1遍,用滅菌剪刀去掉卵巢系膜,隨后用75%酒精快速清洗卵巢1遍,再用新鮮生理鹽水清洗卵巢2遍。
1.2 主要儀器與試劑
主要儀器:CO2培養箱(美國Thermo公司)、體視顯微鏡(日本Olympus公司)、熒光顯微鏡(日本Nikon公司)。主要試劑:TCM199(美國Gibco公司)、胎牛血清(美國Gibco公司)、2’,7’-二氯熒光素二乙酸酯(美國 Invitrogen 公司)、ThiolTrackerTMViolet(美國Invitrogen公司),丙酮酸鈉、Hepes-sodium、M199、L-谷氨酰胺、碳酸氫鈉、葡萄糖、肝素、青霉素、鏈霉素、DON、FBS、FSH、E2、LH、HP、EGF、IGF、PS、EAA、NEAA、BSA、礦物質油、PBS、PVA 等其他化學藥品均購自 Sigma 公司。
1.3 主要藥品配制
卵母細胞成熟液(IVM液)為含10% FBS、0.01 IU·mL-1FSH、0.01 IU·mL-1LH、1 μg·mL-1E2、10 μg·mL-1肝素、50 ng·mL-1EGF、100 ng·mL-1IGF的TCM199(1×)。體外受精液(IVF液)為含6.55 mg·mL-1NaCl、0.23 mg·mL-1KCl、0.33 mg·mL-1CaCl2·2H2O、1.06 mg·mL-1MgCl2·6H2O、2.6 mg·mL-1NaHCO3、0.137 5 mg·mL-1丙酮酸鈉、0.01 mg·mL-1肝素、2 μL·mL-1酚紅的水溶液。體外胚胎發育培養液(IVC液)為含0.23 mg·mL-1KCl、2.2 mg·mL-1NaCO3、0.162 6 mg·mL-1MgCl2·6H2O、0.161 9 mg·mL-1KH2PO4、0.044 mg·mL-1丙酮酸鈉、0.27 mg·mL-1葡萄糖、2 μL·mL-1酚紅的水溶液。終止液:含10% FBS的TCM199液。
1.4 卵母細胞的采集、體外成熟培養及成熟效果評價
用一次性注射器吸取卵巢上3~5 mm卵泡中的卵丘卵母細胞復合體(COCs),將撿出的COCs在洗卵液中清洗2遍,選擇外周包裹3層以上卵丘細胞且胞質均勻的COCs,在IVM液中清洗3遍,隨后將其轉入到含 DON 濃度分別為0、50、250、500、1 000 ng·mL-1的 IVM液的四孔板中,每孔40~50枚細胞,置于38.5 ℃、5% CO2的培養箱中成熟培養22 h,在顯微鏡下對 COCs 卵丘擴展情況進行評級,并計算卵丘擴展指數。待COCs卵丘擴展效果評價結束后,用濃度為0.1%的透明質酸酶除去卵母細胞外的所有顆粒細胞,用撿卵針輕輕撥動卵母細胞,觀察卵母細胞第一極體是否排出,并計算各組的第一極體排出率。
將卵丘擴展分為 0~4 五個等級;0 級代表卵丘無擴展,計為0分;1 級代表只有卵丘最外周 1~2 層卵丘擴展,計為1分;2 級代表有2層以上卵丘細胞已擴展且呈放射狀,計為2分;3 級代表除緊挨卵母細胞最內層放射冠外其他卵丘均完成擴展,計為3分;4 級代表所有卵丘細胞均擴展,計為4分。卵丘擴展指數=組內COCs卵丘擴展情況分值總和/組內COCs總數,卵丘擴展指數值越大表示卵丘擴展效果越好。
1.5 體外受精及早期胚胎體外發育培養
將從液氮罐中取出的凍精迅速投入到37 ℃溫水中進行解凍,隨后用洗精液充分洗滌精子并調整精子密度為1×106個·mL-1。用移液槍將50 μL的精子加入到去除外周卵丘的卵母細胞的50 μL受精滴中,每個微滴中含15~20枚卵母細胞。精卵共孵育16 h后用撿卵針輔助去除受精卵外所有的顆粒細胞,并將其轉入到前期胚胎培養液中放入培養箱中培養,于受精后48 h統計其卵裂率,隨后將受精卵由前期培養液轉移至后期培養液中,每隔48 h進行半量換液,于受精第7天觀察囊胚數并計算囊胚率。
1.6 卵母細胞內線粒體分布檢測
用濃度為0.1%透明質酸酶消化除掉成熟培養22 h后胞質均勻的卵母細胞外所有顆粒細胞,隨后將卵母細胞置于100 nmol·L-1的Mito Tracker Red CMXRos 中避光孵育 20 min,接著將各組卵母細胞移入到DPBS中洗滌3次,隨后把卵母細胞在已預熱的4%多聚甲醛溶液中固定15 min,在DPBS溶液中漂洗10 min后進行壓片處理,將樣品置于熒光顯微鏡下觀察各組卵母細胞內線粒體的分布情況,整個試驗過程避光操作。其中,將卵母細胞內線粒體分布分為兩種類型,即卵母細胞內線粒體均勻分布和不均勻分布。均勻分布是指線粒體均勻分布于整個卵母細胞胞質中,不均勻分布是指卵母細胞胞質中存在沒有線粒體分布的區域。
1.7 ROS及GSH含量檢測
用濃度為0.1%透明質酸酶消化掉成熟培養22 h 的卵母細胞外的顆粒細胞,隨后將卵母細胞分別置于2’,7’-二氯熒光素二乙酸酯(2’,7’-dichloro-fluorescin diacetate, DCHFDA)及ThiolTrackerTMViolet(Glutathione Detection Reagent)染料中進行避光孵育30 min,隨后各組卵母細胞移入到0.1% PVA-DPBA中洗滌3次。在載玻片上點一滴DPBS,每次將10~15枚已染色處理的卵母細胞轉移到載玻片上的微滴中,調整好曝光時間與參數,在熒光顯微鏡下用NIS Elements f軟件對已進行染色的卵母細胞進行拍照,分別用470 nm與380 nm激發波長進行熒光激發,整個操作均在避光條件下進行。隨后用Image J軟件對細胞內ROS與GSH水平進行量化統計。
1.8 CAT與GPx4基因檢測
1.8.1 樣品收集 用濃度為0.1%透明質酸酶除去體外成熟培養22 h卵母細胞外的顆粒細胞,隨后將裸卵置于終止液中終止消化,隨后在DPBS中漂洗5 min,用撿卵管將處理好的卵母細胞轉移至200 μL離心管中進行凍存處理,每次每組收集卵母細胞40~50個。
1.8.2 引物設計 試驗共選取3個基因,包括1個 內參基因GAPDH和2個卵母細胞抗氧化應急相關基因CAT與GPx4,基因引物參照NCBI(http://www.ncbi.nlm.nih.gov/)中的NM_001034034.2、NM_001035386.2和NM_001034034.2,由生工生物工程(上海)股份有限公司合成,引物序列和擴增目標片段的大小如表1所示。

表1 引物序列及擴增目標片段的大小
1.8.3 cDNA制備 卵母細胞 cDNA 的制備采用 Cells-to-cDNA(Invitrogen,美國)試劑盒進行,具體操作步驟為:①裂解卵母細胞,即將適量 Cell Lysis II Buffer 加入收集卵母細胞樣品的離心管中,然后置于 PCR 儀中 75 ℃ 加熱 l0 min;②去除基因組 DNA,即加入1/50 Cell Lysis II Buffer 體積的 DNase I,PCR 儀中 37 ℃ 加熱 15 min,然后75 ℃加熱 5 min 滅活 DNase I;③RNA 合成,即取10 μL細胞裂解產物,加入4 μL dNTP Mix 和 2 μL Oligo(dT)18 primers 后混勻,PCR儀中 70 ℃加熱3 min,結束后取出立即置于冰上靜置 1 min;④cDNA 合成,即向第三步的產物中加入2 μL 10×RT buffer、1 μL M-MLV 反轉錄酶和1 μL RNase 抑制劑,PCR 儀中 42 ℃ 孵育 30 min,95 ℃ 加熱10 min,即可得到cDNA,于-20 ℃ 保存備用。
1.8.4 熒光定量PCR檢測 以合成的cDNA為模板,根據SYBR?Premix Ex TaqTMⅡ說明書,在EasyCycler 96熒光定量PCR儀上進行分析,反應體系為15 μL:2×TB Green premix 7.5 μL,正反引物各0.3 μL,cDNA 1 μL,ddH2O 5.9 μL。反應條件:95 ℃預變性30 s;95 ℃變性5 s、60 ℃退火延伸30 s,共30個循環。采用 2-△△Ct法計算出各目的基因 mRNA 的相對表達量。
1.9 數據分析
采用生物統計分析軟件SPSS 21.0,運用單因素方差分析或卡方檢驗對數據進行差異顯著性檢驗,P<0.05為差異顯著,P<0.01為差異極顯著。
2 結 果
2.1 不同濃度DON對卵丘細胞擴展的影響
結果如表2所示,250 ng·mL-1組卵丘擴展指數為2.32±0.09,較對照組3.22±0.06顯著下降(P<0.05);500和1 000 ng·mL-1組分別為1.57± 0.07和0.71±0.06,較對照組極顯著下降(P<0.01)。

表2 不同濃度DON對牛卵丘卵母細胞卵丘擴展指數的影響
2.2 不同濃度DON對第一極體排出率的影響
如表3所示,不同濃度的DON(50、250、500、1 000 ng·mL-1)均會降低卵母細胞成熟過程中第一極體的排出率。相較于對照組,250、500 ng·mL-1的DON可顯著降低第一極體排出率(P<0.05),1 000 ng·mL-1組則極顯著降低第一極體排出率(P<0.01)。

表3 DON對牛卵母細胞第一極體排出的影響
2.3 DON對卵母細胞體外發育潛能的影響
根據“2.1”和“2.2”的試驗結果,本試驗及后續試驗選擇500 ng·mL-1DON 作為毒性模型即DON組,與對照組(0 ng·mL-1DON)相比較,探究DON 對卵母細胞體外發育潛能的影響。結果如表4所示,相較對照組,DON處理組的卵裂率與囊胚率均顯著降低(P<0.05)。
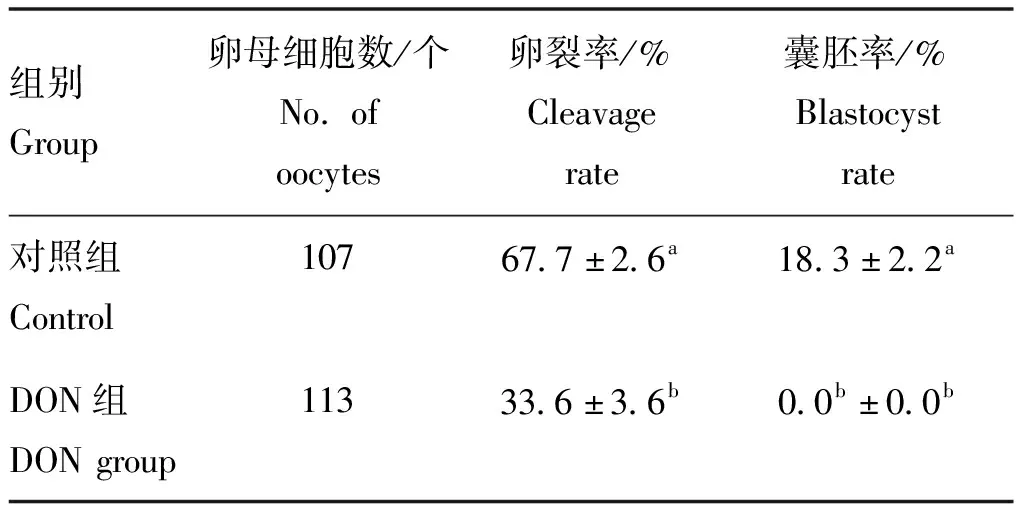
表4 DON對卵母細胞體外發育潛能的影響
2.4 DON對卵母細胞內線粒體分布的影響
牛卵母細胞體外成熟22 h,線粒體呈均勻分布和不均勻分布的顯微鏡下明場和熒光典型圖如圖1A所示,DON對牛卵母細胞內線粒體分布的影響結果如圖1B所示。結果發現,DON組線粒體均勻分布的比例較對照組顯著降低(P<0.05)。

A.卵母細胞線粒體染色圖:a、b分別代表線粒體分布均勻與不均勻的卵母細胞的顯微鏡明場圖;c、d分別代表線粒體分布均勻與不均勻的卵母細胞的顯微鏡熒光圖。B.對照組與DON組間線粒體分布均勻卵母細胞的比例圖,*表示組間差異顯著(P<0.05),下同
2.5 DON對卵母細胞內ROS水平的影響
由圖2A可知,DON組的熒光強度高于對照組;圖2B為卵母細胞內ROS的相對熒光強度量化分析結果,DON組中卵母細胞內ROS水平顯著高于對照組(P<0.05)。

A.卵母細胞活性氧染色圖片:a、b分別為對照組卵母細胞的明場和熒光圖,c、d分別為 DON組的明場與熒光圖。B.對照組與DON組的卵母細胞內ROS水平比較圖
2.6 DON對卵母細胞內GSH水平的影響
由圖3A可知,DON 組熒光亮度低于對照組;圖3B卵母細胞內GSH的相對熒光強度量化分析結果表明,DON組卵母細胞內GSH水平顯著低于對照組(P<0.05)。

A.卵母細胞谷胱甘肽染色圖片:a、b分別為對照組的明場和熒光圖;c、d分別為DON組的明場與熒光圖。B.卵母細胞內GSH相對熒光強度圖
2.7 DON 對卵母細胞內抗氧化基因CAT、GPx4表達的影響
抗氧化基因CAT、GPx4在各組卵母細胞中的表達水平如圖4,DON組CAT、GPx4轉錄水平相較于對照組均顯著降低(P<0.05)。
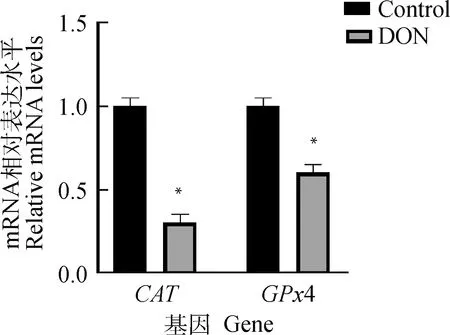
圖4 DON 對卵母細胞抗氧化基因CAT與GPx4表達的影響
3 討 論
卵母細胞成熟與包裹其外周的顆粒細胞存在復雜的聯系,顆粒細胞對卵母細胞成熟起著營養支持及信號傳導等作用,對卵母細胞的正常代謝及后期的受精能力都有著關鍵性的影響。本研究結果表明,在牛卵母細胞體外成熟液中,50 ng·mL-1的DON可顯著抑制卵丘顆粒細胞的擴展,當DON濃度達到500 ng·mL-1時,則可極顯著抑制卵丘顆粒細胞擴展,這與Schoevers等[6]發現DON抑制卵丘細胞擴展的結論相一致。
評價卵母細胞達到細胞核成熟的依據是排出第一極體,線粒體在細胞質中均勻分布則是判斷卵母細胞達到細胞質成熟的重要標志[7]。本研究證實,牛卵母細胞體外成熟液中DON濃度為250 ng·mL-1和500 ng·mL-1時會顯著降低卵母細胞體外成熟的第一極體排出率,當DON濃度達到1 000 ng·mL-1時則極顯著降低第一極體排出率,表明當牛卵母細胞體外成熟液中DON濃度高于250 ng·mL-1時就會抑制卵母細胞的細胞核成熟進程;另外,本研究表明,DON濃度達到500 ng·mL-1時會顯著抑制牛卵母細胞的線粒體正常分布。綜上,以牛卵母細胞體外成熟培養液中含有500 ng·mL-1的DON為毒性模型,進一步開展DON對牛卵母細胞體外發育能力的影響及作用機制研究是可行的。
卵母細胞體外成熟將為其完成正常受精及后續胚胎發育奠定重要基礎。Lan等[1]的體外試驗結果表明,1 μmol·L-1的DON可顯著降低小鼠卵母細胞的成熟率(78.69%vs.68.64%),在其開展的體內試驗中,對雌性小鼠連續7 d按每公斤體重注射0.6 mg的DON后,與雄鼠進行交配,隨后收集受精卵在體外條件下進行成熟培養,結果表明,飼喂DON后的小鼠卵母細胞的卵裂率及囊胚率均顯著降低。Alm等[8]的研究同樣顯示,DON可造成GV期豬卵母細胞的退化及體外培養過程中成熟率的降低,本研究DON毒性處理會顯著降低牛卵母細胞的體外受精卵裂率及囊胚率,與上述試驗結果一致。Schoevers等[6]用不同濃度的DON對豬卵母細胞進行成熟培養,發現培養液中濃度0.02 μmol·L-1的DON不僅顯著降低豬卵母細胞成熟率及囊胚率,同時DON還可造成體外受精過程中多精入卵的比例,此異常受精現象的發生可能是囊胚率降低的因素之一。
已有研究證實,細胞內抗氧化系統處于失衡狀態會造成細胞的氧化損傷,DON毒性作用與誘導氧化應激具有很強的關聯性[9-11]。Yu等[12]報道了小鼠妊娠期采食含DON的飼料后,其胚胎毒性由胎盤內ROS積累造成。Wang等[13]用含DON的飼料對雞進行飼喂,在36 d后的血樣中發現,CAT等酶類抗氧化劑的活性顯著降低。Gao等[14]發現,DON對雄性動物的生殖系統具有顯著的毒性作用,雄性小鼠采食含DON的飼料后會導致精子畸形率增加和精子活力的降低,同時睪丸組織中ROS等水平升高,GSH等酶類抗氧化劑的活性降低。本研究發現,DON可造成牛卵母細胞內ROS水平的顯著增加、GSH水平的顯著降低,進一步證實DON毒性是通過破壞牛卵母細胞細的抗氧化系統平衡途徑來發揮作用的。為探究DON對牛卵母細胞的可能作用機制,本研究進一步檢測DON處理組牛卵母細胞內的抗氧化基因CAT、GPx4的mRNA表達水平,發現其基因表達量均顯著降低。在介導細胞抗氧化應激反應的keap1-Nrf2通路中,其下游調控基因CAT與GPx可轉錄翻譯生成相應的酶,將自由基轉化生成的過氧化氫(H2O2)進行分解,其可直接催化H2O2的氧化分解為H2O和O2,而GPx則需要在GSH的參與下將H2O2分解為對集體無害的H2O,同時GPx還能將有機過氧化物分解H2O和相應的醇類[15]。Huang等[16]用DON濃度分別為0、300、600、900、1 200、1 500 μg·kg-1的飼料對草魚進行了為期60 d的飼養試驗,發現采集的魚鰓樣品中600 μg·kg-1的DON處理組中CAT與GPx4等抗氧化基因表達量相較于對照組顯著降低,300 μg·kg-1的DON可造成組織的氧化損傷與抗氧化能力的降低。Ren等[17]向豬淋巴細胞的體外培養體系中添加不同濃度的DON,發現DON可顯著或極顯著降低CAT、GPx與GSH的蛋白表達水平,證實DON可誘導豬淋巴細胞的氧化損傷。Hou等[18]同樣發現,DON可造成小鼠血清與肝內CAT等的表達量顯著下降。上述研究結果與本研究結果一致,均顯示DON毒性作用的分子機制可能是通過降低CAT和GPx4基因表達。已有研究者發現,DON的羥基官能團在代謝過程中會生成脂類,此代謝產物可與核糖體相結合,破壞核糖體正常功能的發揮,抑制蛋白質合成反應。此應激反應會影響細胞內一系列炎癥細胞因子的表達,造成細胞超負荷氧化應激效應[19]。這與本研究發現DON破壞牛卵母細胞內氧化系統平衡結果相一致。因此,在牛卵母細胞的體外成熟培養液中適當添加抗氧化或許有助于緩解細胞內的超負荷氧化應激反應,從而降低DON對牛卵母細胞成熟及發育能力的損傷。
4 結 論
DON對牛卵母細胞體外成熟具有毒性作用,具體表現為抑制卵丘顆粒細胞擴展、影響線粒體在細胞質中正常分布、降低第一極體排出率及卵母細胞體外受精卵裂率及囊胚率,其作用機制與破壞牛卵母細胞內抗氧化系統的平衡相關。

